2014年全球新药研发报告
——第一部分:新药和生物药品(Ⅱ)
2015-02-01GraulCrucesStringer
Graul A I,Cruces E,Stringer M
2014年全球新药研发报告
——第一部分:新药和生物药品(Ⅱ)
Graul A I,Cruces E,Stringer M
2014的新药批准和上市年终报告显示医药行业的活跃性持续保持在高位。截至2014年12月23日,共有55个新药和生物制品首次上市。此外,29个重要的延伸性新药(新处方、新复方或已上市药物的新适应证)也在2014年上市。在这些新上市的药物中,最多的是抗感染药物,有11个新药和生物制品。它们大多用于多药耐药菌引发的感染或丙肝的治疗。美国再一次成为这些新上市药物最青睐的市场,该国是2014年半数以上新上市药物的首选地区。不过,日本在2014年开发上市新药的能力显著增强,多年来首次超越欧盟。另一重要成果是:2014年上市的新药和生物制品中有15个获得罕见病用药资格,5个获得突破性治疗药物资格,以及3个获得合格传染病产品(QIDP)资格。另外,2014年还有19个产品首度获批,将于2015年初上市。
上市新药;新药批准;延伸性新药;首创药物
13 免疫调节剂及免疫药物
Trumenba™(B群脑膜炎球菌疫苗)是由2个脑膜炎奈瑟菌B血清群的重组脂化因子H结合蛋白(fHBP)变异体组成的疫苗(lp2086 a05和lp2086 b01蛋白变异体)。候选疫苗由辉瑞公司研发并于2014年在美国获批上市。该疫苗是唯一一个获得FDA审批、用于预防10~25岁B群脑膜炎的主动免疫药物。2014年,该疫苗获得了美国突破性治疗药物资格,用于B群脑膜炎奈瑟菌所致的脑膜球菌性脑膜炎。与全球大部分脑膜炎发病相关的脑膜炎奈瑟菌共有5组血清群:A、B、C、 W、Y。2012年,美国约40%的脑膜炎病例由B群引发。
Squarekids®为沉淀型的纯化4价疫苗,用于预防百日咳、白喉、破伤风和脊髓灰质炎,于2014年在日本首次获批。该疫苗由Daiichi Sankyo vaccine公司研制,将由赛诺菲公司和Japan Vaccine联合销售。该疫苗是日本首个包含灭活脊髓灰质炎疫苗(salk 疫苗)的4价疫苗,将于2015年上市。
2014年3月,日本厚生劳动省批准了由Chemo-Sero-Therapeutic Research Institute (Kaketsuken)公司研发的流感疫苗,用于预防H5N1型禽流感。该疫苗研制是基于Valneva公司的 EB66®细胞系,使用了Kaketsuken公司的专利细胞培养及纯化技术,以及葛兰素史克的辅助技术。该疫苗仅用于日本政府的流感计划免疫。
人类乳突淋瘤病毒是一类小型、无包膜的双链环状DNA病毒,可感染鳞状上皮细胞,现存120多种HPV亚型病毒,其中11种(HPV-16,-18,-31,-33,-35,-39,-45,-51,-52,-56,-58)为高危型,可致癌。2014年12月中旬,FDA审批了默克公司的下一代HPV疫苗Gardasil®9。该疫苗以默克公司2006年成功上市的4价HPV疫苗Gardasil®为基础,覆盖了9种HPV病毒。90%以上的宫颈癌、阴道癌及肛门癌均由这些病毒引起。该疫苗适用于9~26岁女性及9~15岁男性,用于预防生殖器尖锐湿疣、癌前期病变及HPV感染相关的癌症。
多中心性Castleman病(MCD)是一种罕见的增殖性疾病,表现为淋巴细胞的过量产生,而导致淋巴结的良性肿大。MCD还会影响到内脏器官的淋巴组织,导致肝脏、脾脏及其他器官的肿大。感染、多系统器官衰竭及癌变是MCD患者死亡的常见原因。虽然白介素6(IL-6)的过量产生被认为是主要机制,但截至目前,该病的原因尚不明确。尽管美国保险公司宣称该病的患者人数大概为1 100~1 300人,但患者的确切数量也尚不明确。2014年4月,FDA批准了Janssen Biotech公司的嵌合性抗IL-6单克隆抗体siltuximab (Sylvant™),用于治疗HIV阴性及8型人类疱疹病毒(HHV-8)阴性的MCD患者(见图6)。在治疗过程中患者的HIV状况比较重要,原因是HPV呈阳性的MCD患者更易患浆细胞病且临床效果也不如HIV阴性患者理想。据国际Castleman病组织数据,可以充分相信HHV8是HIV呈阳性的Castleman病患者的发病原因。Siltuximab 在美国获得了罕见病药物的资格并于2015年5月初上市。
14 抗癌药物
吉利德(Gilead)公司的Idelalisib (Zydelig®,27)为全新的磷脂酰肌醇3激酶δ(PI3Kδ)抑制剂,于2014年7月在美国获批并首次上市,用于治疗3种癌症:慢性淋巴细胞性白血病(CLL)、小淋巴细胞性淋巴瘤和滤泡性非霍奇金淋巴瘤。Idelalisib针对这3种适应证都获得了罕见病药物资格,同时还获得了治疗CLL的突破性药物资格。PI3K的δ型主要在血细胞系中表达,包括能够产生或介导血细胞癌变、炎症反应、自体免疫及过敏反应的细胞。该药只抑制PI3Kδ,其疗效的发挥并不影响PI3K信号通路——该通路对健康细胞的正常功能至关重要(见图7)。大量研究显示对其他类型的PI3K抑制会产生明显毒性,尤其是在维持细胞正常活性的葡萄糖代谢方面。欧盟委员会也在当年的晚些时候批准了idelalisib用于该3种适应证。
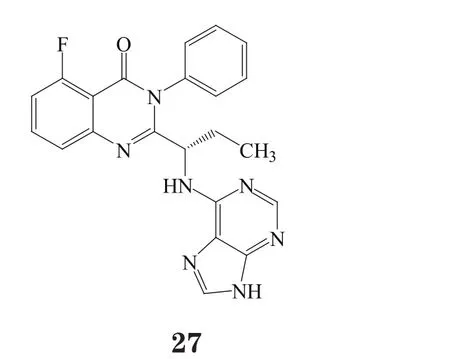
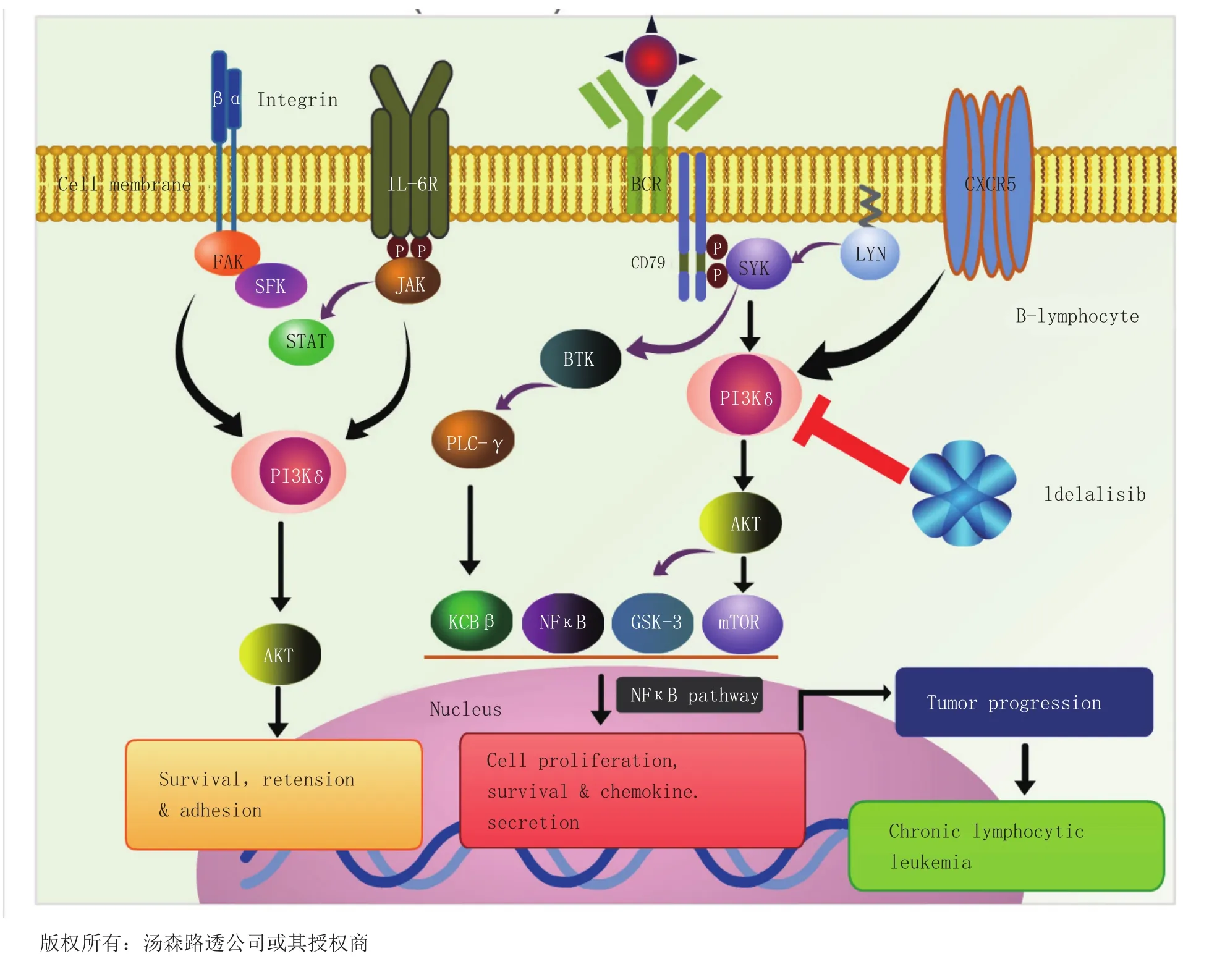
图7 Idelalisib对磷脂酰肌醇3-激酶δ(PI3Kδ)的抑制作用Figure 7 Inhibition of phosphoinositide 3-kinase delta((PI3Kδ) by idelalisib
同样是在2014年7月,Chugai制药公司的ALK抑制剂alectinib hydrochloride(Alecensa®,28)在日本获批用于治疗间变性淋巴瘤激酶(ALK)融合基因阳性非小细胞肺癌(NSCLC)。该药获批是基于在日本进行的多中心Ⅰ/Ⅱ期临床研究(AF-001JP)。参加该研究的患者患有ALK融合基因阳性、复发性、晚期或不可切除性NSCLC,并接受过一种及以上的药物化疗。由24名患者参加的Ⅰ期研究确定了推荐剂量为300 mg,每天2次,该研究未发现剂量限制性毒性。Ⅱ期研究在46名患者中使用推荐剂量进行,有效率为93.5%。在14名发生中枢神经系统(CNS)转移的患者中,9名患者病情在超过12个月的时间里未发生CNS或全身性的病情进展;12个月无进展生存率(PFS)为83% ;无治疗相关的死亡和(或)4级及更严重的不良反应发生。最常见的3级及以上的不良反应为中性粒细胞减少症,在使用300 mg(每日2次)的批准剂量治疗的58例患者中有4例(6.9%)出现该反应。Alectinib在日本也获得了该的罕见病药物资格并于2014年9月上市。全球研究目前正在展开,所获得的结果将用于向美国和欧盟进行申请。
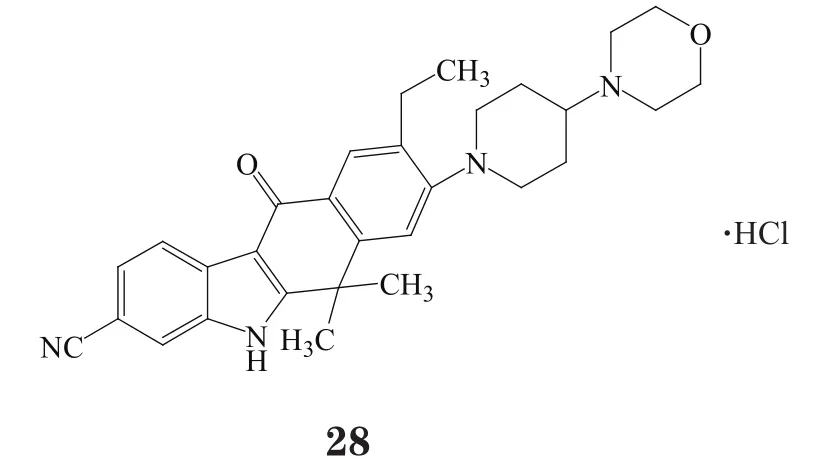
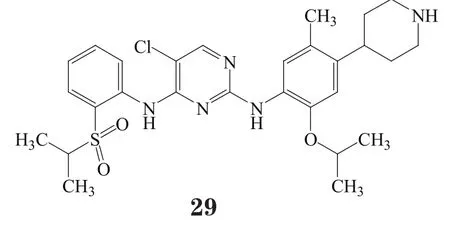
另一个ALK抑制剂是由诺华公司研发的ceritinib (Zykadia™,29),2014年在美国获批并上市。其适应证也类似:ALK阳性的NSCLC转移患者,患者使用crizotinib治疗病情有发展或对crizotinib不耐受。2013年,ceritinib获得FDA突破性治疗药物资格。约有2%~7%的NSCLCs患者病情发展都是由于ALK基因的重排加速了癌细胞生长。
宿主免疫系统在肿瘤监控方面发挥着重要作用,往往能在一段时间内成功抑制早期肿瘤生长及发展。尽管大多数肿瘤最终都会设法摆脱免疫调控而最终发展为临床疾病,免疫检查点抑制剂仍被认为是一类可以恢复患者肿瘤免疫力的抗癌药物,但患者需经过仔细筛选。程序性细胞死亡蛋白1(hPD-1)受体是一类共抑制受体,通过激活T淋巴细胞表达,是免疫检查点调节的靶点。抗hPD-1与抗程序性细胞死亡1配体1(PD-L1)抗体通过阻断PD-1蛋白与其配体之一(PD-L1)的结合增强免疫应答,从而防止活化细胞变成无能细胞,保持抗癌的免疫活性。Ono制药公司的Nivolumab (Opdivo®)是全新的抗PD-1单克隆抗体(见图8),2014年在日本首次获批并上市,用于治疗不可切除型黑色素瘤并获得罕见病药物资格。
时隔不久,第2个抗PD-1单克隆抗体——默克公司的pembrolizumab (Keytruda®)在美国获批上市,该药同样用于治疗黑色素瘤。需特别指出的是,FDA批准该药用于治疗不可切除性或转移黑色素瘤,以及在使用ipilimumab治疗后及BRAF V600突变阳性患者在使用BRAF抑制剂后病情有发展的患者。Pembrolizumab是美国市场上的首个PD-1抑制剂,该药获得了突破性治疗药物和罕见病药物资格。
2014年12月,FDA批准了另一个免疫靶向抗癌药物:blinatumomab (Blincyto™),它是由安进公司研发的全新的双特异性CD19-介导的CD3 T细胞(BiTE®)衔接系统抗体产品。BiTE抗体构建系统可同时衔接2个不同靶点,从而将T细胞并列至癌细胞(见图9)。BiTE构建系统将T细胞置于靶点细胞可触及范围,使T细胞注射毒素引发癌细胞凋亡。Blinatumomab用于治疗费城染色体阴性(Ph-)复发性难治性B-前体急性淋巴细胞白血病(ALL)成年患者,这是一种罕见的、快速发展的血液骨髓癌症。Blinatumomab是首个获批的该适应证的单方免疫治疗药物,获得FDA的突破性治疗药物、罕见病药物及加速审批资格。Blincyto由安进公司的子公司Onyx 制药公司负责销售,在获批不久后即上市。

图8 抗PD-1单克隆抗体nivotumab对免疫检查点的抑制作用机制Figure 8 Mechanism of immune checkpoint inhibition by anti-PD-1 monoclonal antibody nivolumab
血管生成抑制剂ramucirumab是重组人体抗血管内皮生长因子受体(VEGFR-2)的单克隆抗体,于2014年上半年在美国获批上市,作为单方药物,用于接受过化疗的晚期胃癌或胃食管结合部腺癌患者。该药由礼来公司以商品名Cyramza™上市销售。2014年12月,ramucirumab获得FDA审批上市用于另一适应证——非小细胞肺癌。
另一个治疗胃癌的药物是江苏恒瑞制药公司的apatinib mesylate,于2014年11月在中国首次获批。该药为小分子VEGFR-2(FLK-1/KDR)抑制剂,用于标准治疗失败的晚期胃癌患者。据2012年度 Globocan数据库,全球胃癌发病率在所有癌症中居第5位,死亡率居第3位,其中东亚地区发病率最高。Globocan数据还表明,2012年中国胃癌患者达405 000例[8]。
组蛋白去乙酰化酶(HDAC)抑制剂是新一代靶向抗肿瘤药物。HDAC改变了染色质的结构并影响转录后调控,从而导致肿瘤抑制基因转录减少。HDAC抑制剂可以逆转这些作用,从而引发癌细胞凋亡。Onxeo公司的HDAC1/HDAC2抑制剂belinostat (Beleodaq™,30)于2014年在美国获批上市,用于治疗复发性难治性外周T细胞淋巴瘤——非霍奇金氏淋巴瘤的罕见亚型。Belinostat获得该适应证的罕见病药物资格,并通过FDA加速审批程序获得上市许可。

阿斯利康(AstraZeneca)公司全新的聚ADP-核糖聚合酶(PARP)抑制剂olaparib(Lynparza™)于2014年12月在欧盟获批,用于治疗铂敏感复发性并伴有BRCA突变的高级别重度上皮卵巢癌、输卵管癌或原发性腹膜癌患者,铂化疗对这些患者完全有效或部分有效。PARP抑制剂可以阻断使肿瘤细胞对化疗耐药的DNA修复机制。PARP抑制是治疗卵巢癌,尤其是与BRCA1或BRCA2相关的遗传型卵巢癌的新策略。在这些癌症中,已经缺失了一个DNA修复通路,而对PARP抑制敏感度增加。阿斯利康公司称,olaparib将于2015年早期在欧洲的首个市场——英国和北欧的某些国家上市。
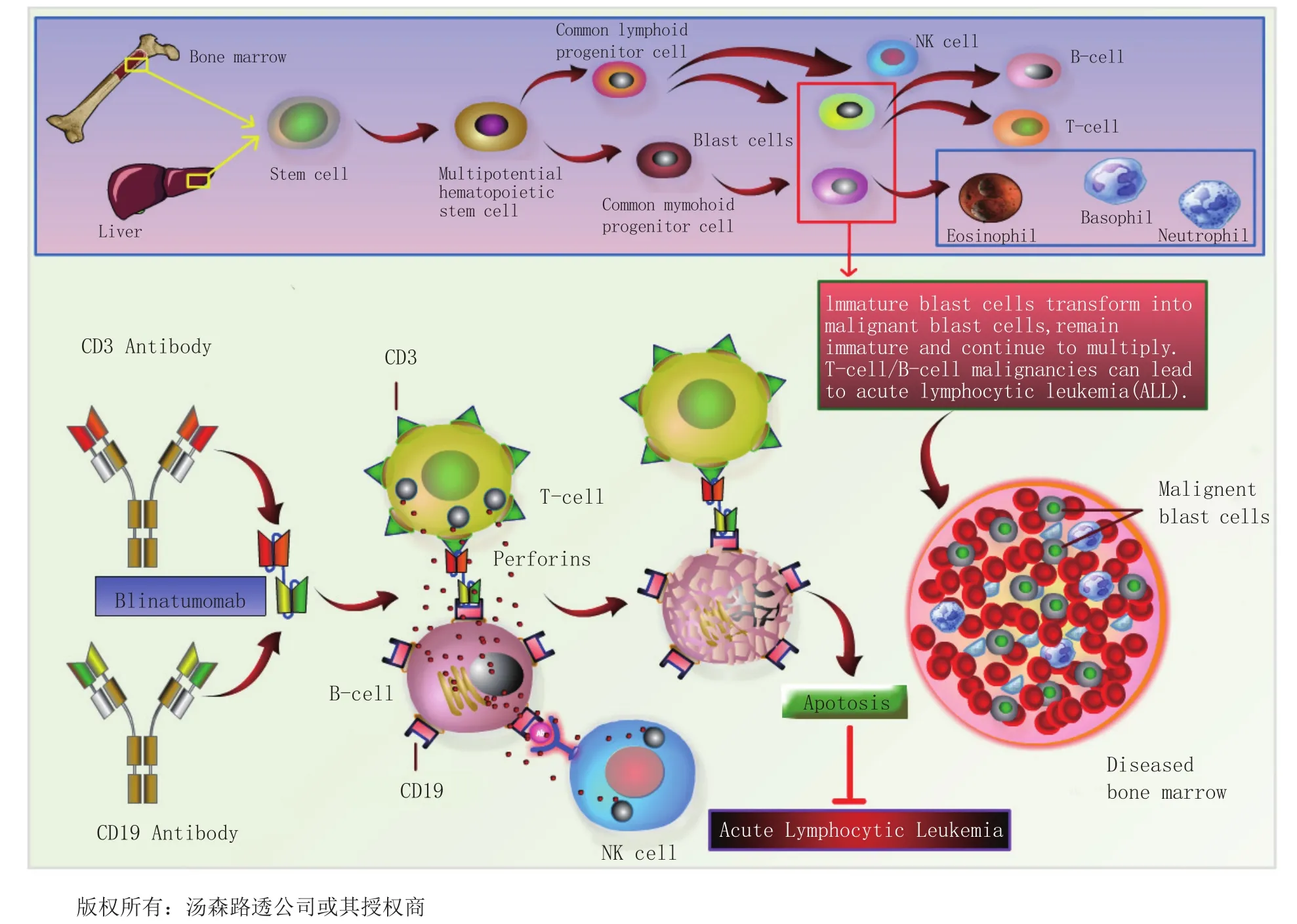
图9 双特异性CD19-介导的CD3 T细胞衔接器(BiTE®)抗体构建系统Figure 9 Bispecific CD19-Directed CD3 T-cell engager antibody(BiTE®) construct
2014年12月,FDA批准了Incyte公司的Janus激酶1和2(JAK1/JAK2)抑制剂ruxolitinib phosphate(Jakafi®)的新适应证——红细胞增多症。Ruxolitinib是FDA批准的首个用于治疗患有此类罕见的、对标准羟基脲疗法无效的进展性血液癌症患者,该药在获批新适应证后立即上市。红细胞增多症(PV)是一种骨髓增殖性疾病,主要表现为红细胞压积(红细胞在全血中体积百分比)增加,从而引起血液黏稠而增加血栓的风险,同时白细胞及血小板计数也会增加。多数PV患者会伴随JAK2基因突变,这是该病的主要发病原因。患者罹患诸如卒中、心肌梗死和心血管死亡等其他心血管系统并发症的风险增加。该病在美国的发病率约为每100 000人22例[9]。红细胞增多症的一线治疗是放血疗法加阿司匹林,二线治疗为使用羟基脲进行化疗以减少骨髓产生的红细胞数量。但是,约1/4的患者对羟基脲治疗效果不佳或者不耐受,目前为止对这类患者也无其他治疗选择。Ruxolitinib自2011年上市用于治疗中度或高危骨髓纤维化症。该药的2个适应证在美国都获得了罕见病药物资格。
PICN是微管稳定剂紫杉醇的纳米颗粒制剂,其不含聚氧乙烯蓖麻油Cremophor及白蛋白,于2014年在印度获批上市。该产品由Sun Pharma Advanced Research Company (SPARC)研发,用于治疗转移乳腺癌。与紫杉醇的传统剂型不同,PICN给药前无需使用甾体药物及抗组胺药物,且不会引发显著的过敏反应。
Taiho公 司 的 三 氟 尿 苷/tipiracil hydrochloride (Lonsurf®,31)是固定剂量的复方片剂,2014年在日本获批上市,用于标准治疗无效、不可切除性、晚期及复发性直结肠癌的治疗。三氟尿苷为胸苷酸合成酶抑制剂,自1975年就已上市治疗单纯性疱疹病毒感染。此次是该药首次获批用作抗癌药的成分。三氟尿苷是核苷类似物,与DNA结合可以影响其功能。Tipiracil是胸苷磷酸化酶(三氟尿苷降解酶)抑制剂。Taiho公司也已向美国申请,将该药用于治疗晚期不可切除性、晚期及复发性直结肠癌。

中性粒细胞减少症表现为非正常低水平的白细胞计数,是化疗常见的严重副作用,会影响约一半的化疗患者,尤其是白血病患者。临床上通常会使用集落刺激因子药物,如非格司亭和沙莫司亭来增加中性粒细胞的产生。2014年,由绿十字(Green Cross)公司研发的聚乙二醇集落刺激因子pegteograstim (Neulapeg®)在韩国首次获批,用于治疗接受细胞毒化疗药物治疗实体瘤和恶性淋巴瘤的患者所出现的中性粒细胞减少症。
15 眼科药物
2014年9月,Kowa公司从日本厚生劳动省获得了ripasudil hydrochloride水合物(Glanatek®,32)的生产销售许可。Ripasudil hydrochloride水合物用于治疗青光眼及高眼压症,具有全新的作用机制:它可以抑制Rho相关的蛋白激酶2(ROCK-2)(见图10),从而促进房水自主要外流通道即小梁网和巩膜静脉窦的外流而降低眼压。在日本进行的由原发性开角型青光眼患者及高眼压症患者参加的临床试验中,该药无论是单独给药还是与现有的青光眼及高眼压症药物联用,均显示出降低眼压的作用。Ripasudil在2014年12月初在其首个市场日本上市。

日本还是另一个青光眼治疗新药——由Santen公司研发的TAPCOM的首个市场。该产品为前列腺素F2α类似物tafluprost和β受体拮抗剂马来酸噻吗洛尔组成的固定剂量复方产品。对于青光眼患者,前列腺素可通过调控基质金属蛋白酶及重塑外细胞基质,显著改善小梁外流机制。该药也可以一定程度地增加房水外流。另一方面,β受体拮抗剂通过减少房水产生而发挥作用。
血管内皮生长因子(VEGF)抑制剂conbercept(Langmu)是治疗老年性黄斑变性(AMD)的新药,由成都康弘药业集团在中国首次上市。Conbercept为人源化融合蛋白,包含VEGFR-1及VEGFR-2的关键域,是血管生成抑制剂。眼部血管生成,即在现有的眼部血管形成异常的新血管,是导致眼部疾病的重要原因。血管生成抑制剂尤其适用于治疗“湿”型(新生血管型或渗出型)AMD,该类型表现为异常新血管生成导致严重的迅速失明。
2014年5月 末,FDA批 准 了Omeros公 司 的ketorolac tromethamine /phenylephrine(Omidria™),用于白内障手术或人工晶状体置换术(ILR),通过防止术中缩瞳维持瞳孔的大小,也可以减轻术后疼痛。该产品是专利复方制剂,由一种扩瞳药和一种在白内障手术及ILR中常用的灌洗液中所添加的抗炎药组成。在关键临床研究中,患者术前接受标准的扩瞳药及麻醉药。与安慰剂相比,Omidria在预防缩瞳及减缓术后疼痛方面有显著提高。该产品于2014年第3季度在美国上市。
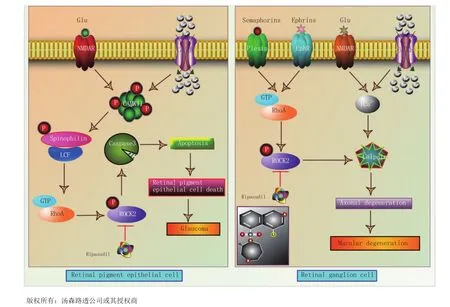
图10 Ripasudil对RHO激酶(ROCK)的抑制作用机制Figure 10 Mechanism of RHO kinase(ROCK) inhibition by ripasudil
16 代谢系统药物
由Orexigen公司推出的盐酸纳曲酮/盐酸安非他酮(Contrave®)是一种新型的中枢作用减肥产品,在2014年9月获得FDA审批,作为低热量饮食及增加运动量的辅助手段,用于初始体质量指数(BMI)为30 kg·m-2(肥胖)或27 kg·m-2及以上(超重)、至少出现一种体质量相关疾病的成人长期体质量管理。纳曲酮是阿片受体拮抗剂,安非他酮为弱的多巴胺及去甲肾上腺素神经元再摄取抑制剂。非临床研究表明纳曲酮和安非他酮作用于下丘脑和边缘系统多巴胺回路,分别与饮食控制和奖赏效应相关。2012年度的国家健康与营养调查研究(NHANES)数据表明,约有35%的美国成人属于肥胖。该产品由Orexigen Therapeutics公司的合作开发商及在北美地区的销售伙伴Takeda制药公司于2014年10月上市。
雅培公司的fenofibrate/辛伐他汀(Cholib®)是含有他汀类药物的新复方产品,2014年首次在克罗地亚、斯洛文尼亚和保加利亚上市。Cholib可以降低三酰甘油脂水平,在单独使用辛伐他汀无法控制LDL-C水平的情况下可以提高HDL-C的水平,用于患有混合型血脂异常的高危心血管疾病成年患者的辅助治疗,作为饮食及运动的补充。
辉瑞公司的固定剂量复方产品结合型雌激素/ bazedoxifene(Duavee™)于2014年2月在美国上市,用于治疗中度至重度绝经性血管舒缩症状,也用于预防绝经后骨质疏松。Duavee™是FDA审批的首个含有雌激素及选择性雌激素受体调节剂(SERM)bazedoxifene的药物。SERM降低由于雌激素成分引起的子宫内膜增生风险。Duavee™最初是由惠氏公司(现辉瑞公司)研发。1994年9月,与Ligand 签署了共同研发协议。该药由辉瑞公司负责销售。
成骨不全症,也称为脆骨病,是一类遗传性罕见病,主要表现为骨脆度增加、骨量低及其它结缔组织症状。已有充分研究证实双膦酸盐可以抑制或降低破骨细胞的骨吸收。Abiogen公司的 neridronate(Nerixia)就属于此类药物。该药于2002年在意大利上市,但在其他国家尚未上市。其他双膦酸药物也被超说明书用于治疗婴儿、儿童及成人成骨不全症。这些药物包括:pamidronate 和 zoledronic acid,二者都是通过静脉滴注给药;alendronate 和 risedronate sodium则为片剂。2014年5月,诺华公司的pamidronate sodium(Aredia®)在日本获批上市,治疗成骨不全症。
戈谢病是一种溶酶体贮积病,由于β-葡萄糖脑苷脂酶缺乏所致。治疗方法有2种:酶替代疗法(ERT)及底物减少疗法。后者包括抑制神经酰胺葡萄糖基转移酶,该酶为合成鞘糖脂系列反应过程中的起始酶。底物减少疗法的目的是将鞘糖脂生物合成率降低至某一水平,使不足量的β-葡萄糖脑苷脂酶活性可以降解底物。2014年,健赞(Genzyme)公司宣布eliglustat tartrate (Cerdelga™,33)在美国上市。该药是第2个以此机制作用的药物(miglustat在2003年上市)。Eliglustat用于CYP2D6强代谢性、中代谢性及弱代谢型的1型戈谢病成年患者的长期治疗。CYP2D6超快代谢型患者体内可能无法达到充足的血药浓度,故疗效无法有效发挥。ERT需静脉滴注,而eliglustat及miglustat都是口服药。Miglustat只适用于不宜使用ERT治疗的患者,而eliglustat则作为一线治疗药物。

BioMarin公司的elosulfase alfa(vimizim™)为酶替代疗法药物,由在G71S细胞上表达的重组人体N-乙酰基半乳糖胺-6-硫酸酯酶(rhGALNS)组成。2014年,该药首次在美国后又在欧洲上市,用于治疗ⅣA型黏多糖症,也称作Morquio A 综合征。该病在发达国家约有3 000例患者。发病原因是由于参与糖胺聚糖(GAG)代谢的GALNS活性缺乏引起。大范围的GAGs逐渐蓄积引起显著发病及多系统损伤,导致系统功能下降、生活质量受损及早期死亡。该病最常见特征为渐进性骨骼发育不良、由于骨骼肌肉系统及呼吸系统功能失常需进行频繁手术及严格限制运动、耐力和呼吸。在α-elosulfase上市前,该病患者只能进行支持性护理。该药在美国、欧盟、日本、澳大利亚都取得了罕见病药物资格。
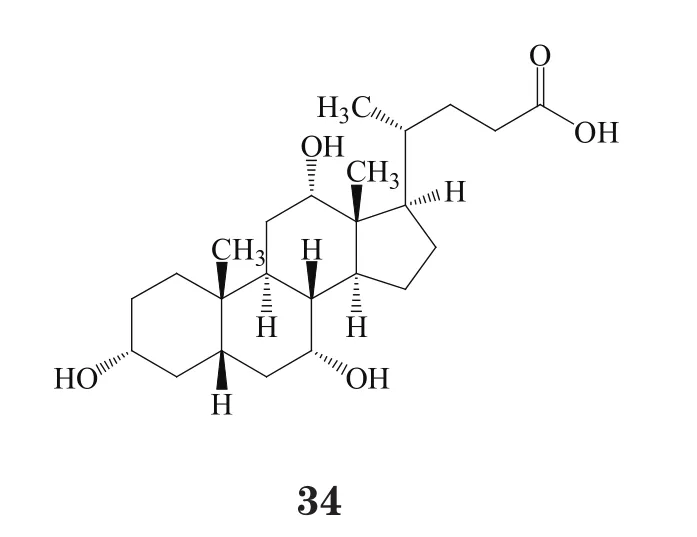
2014年,Laboratoires CTRS的胆酸(Orphacol,34)也在法国首次上市。该产品在欧盟获得罕见病药物资格,用于治疗1个月至18岁的婴儿、儿童、青少年及成人的原发性胆汁合成先天缺陷,该病由于3β-羟基-Δ5-C27类固醇氧化还原酶缺乏或Δ4-3-酮固醇-5β-还原酶缺乏所导致。
17 诊断药物
缺乏好的诊断工具是阿尔茨海默病(AD)治疗所面临的众多问题之一。2014年2种新显像剂的上市在一定程度上解决了该问题,但确切诊断仍只能通过解剖得出。
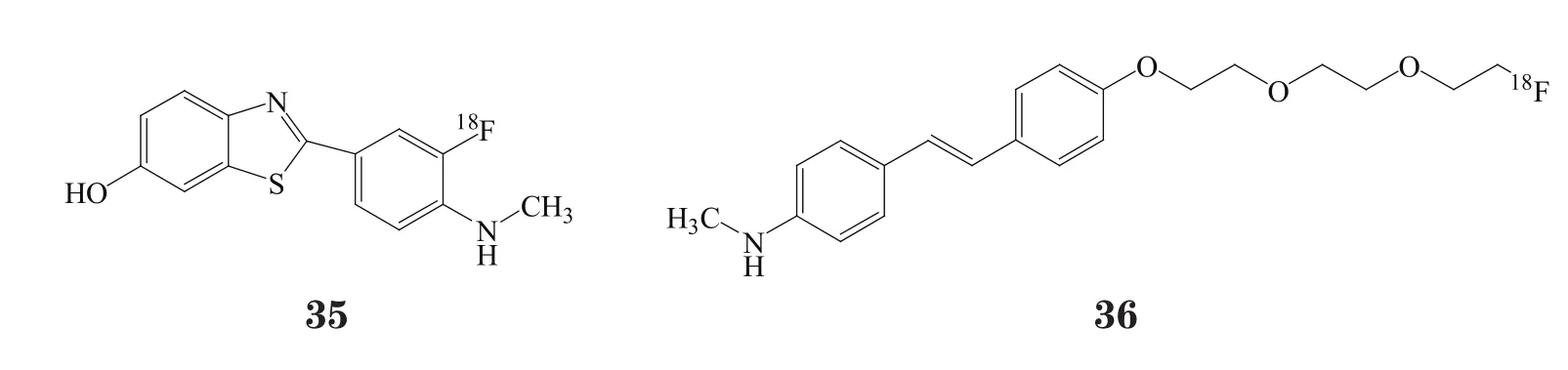
2014年5月,GE Healthcare宣布在美国上市放射诊断试剂flutemetamol[F18](Vizamyl™,35),用于脑部的正电子发射断层(PET)显像。该产品获得FDA审批,用于评估认知受损成年患者的β-淀粉样神经炎斑块密度,这些患者正接受阿尔茨海默病及其他原因导致认知能力下降的评估。Vizamyl™于2014年9月在欧盟获批。
2014年8月,Piramal Imaging同德国Cologne大学核医学医院联合将florbetaben[18F] (Neuraceq™,36) 在德国和美国上市,成为世界上首个能在临床研究范围之外对患者实施Neuraceq PET显像扫描的中心。Neuraceq™为放射性药物,用于脑部PET显像以评估认知受损成年患者的β-淀粉样神经炎斑块密度,这些患者正接受阿尔茨海默病及其他原因导致认知能力下降的评估。β-淀粉样扫描呈阴性有助于排除AD是导致认知能力受损的原因;阳性则意味着,中等至频繁的淀粉样神经炎斑块会出现在阿尔茨海默病及其他类型的神经问题患者以及认知正常的老年人中。使用Neuraceq™时应同时进行临床评价。
SPECT显像剂ioflupane (123I)(DatSCAN®)自2000年就已上市用于帕金森病的诊断。2014年在日本上市用于新适应证——路易体痴呆症的诊断。对于帕金森病或路易体痴呆症患者的诊断是通过脑部多巴胺转运蛋白的显示来评价多巴胺是否变性或缺失。GE Healthcare负责该产品在美国及欧盟市场,而日本市场由Nihon Medi-Physics负责运作。
2013年末,C4 Imaging的C4-ECAM (Sirius™)获得了FDA 510(k)审批。该产品为正信号MRI标记物,用于前列腺癌近距离治疗中使用的放射粒子定位。Sirius MRI标记物含有独特的MRI显像剂C4,由5.5 mm大小的生物相容性聚合物密封胶囊组成。该胶囊作为近距离治疗粒子间隔物植入,帮助使用单一植入后MRI过程的粒子准确定位,避免前列腺癌近距离治疗评估中使用计算机断层扫描。C4 Imaging宣称2014年4月,在德克萨斯州休斯敦MD Anderson癌症中心首次进行了Sirius™植入。
(待续)
原文来源:Drugs of Today,2015,51(1):37-38
A Report of New Drugs Research and Development in 2014——Part I:New Drugs & Biologics (II)
Graul A I, Cruces E, Stringer M
A year-end wrap-up of new drug approvals and launches reveals that activity in the pharmaceutical industry continues at a high level, with 55 new drugs and biologics introduced on their frst markets in 2014 (as of December 23,2014).Additionally, 29 important new line extensions (new formulations, new combinations or new indications for previously marketed products) also reached their frst markets during the year.The most active therapeutic group in terms of new launches was anti-infective therapies, with 11 new drugs and biologics launched, most for the treatment of multidrug-resistant bacterial infections or hepatitis C.The most active market for new launches was again the U.S., site of more than half of all new launches in 2014.However new launch activity increased considerably last year in Japan, which actually pulled ahead of the E.U.For the frst time in many years.In another important new development,15 of the new drugs and biologics launched last year had orphan drug status, 5 had breakthrough therapy designation and 3 had Qualifed Infectious Disease Product (QIDP) status.Another 19 products were approved for the frst time during the year but not yet launched by close of this article, most are slated for launch in the frst months of the new year.
new drug launch; new drug approval; line extension; frst-in-class drug
R97
A
1001-5094(2015)03-0211-10
