健脾化痰方对胰岛素抵抗3T3-L1脂肪细胞NF-κB、脂联素和抵抗素的影响
2015-01-13李保良林冠凯费建平居凌云
李保良, 张 琪, 林冠凯, 费建平, 居凌云
(常州市中医医院脾胃病科,江苏常州213003)
[科研报道]
健脾化痰方对胰岛素抵抗3T3-L1脂肪细胞NF-κB、脂联素和抵抗素的影响
李保良, 张 琪, 林冠凯, 费建平, 居凌云
(常州市中医医院脾胃病科,江苏常州213003)
目的观察健脾化痰方对胰岛素抵抗3T3-L1脂肪细胞NF-κB表达和脂联素、抵抗素分泌的影响,探讨其改善胰岛素抵抗 (IR)的机制。方法采用细胞培养技术,将3T3-L1小鼠前脂肪细胞诱导分化为成熟脂肪细胞,通过地塞米松诱导建立IR细胞模型,将脂肪细胞分为正常组 (基础培养液加10%空白组血清培养正常脂肪细胞)、模型组(基础培养液加10%空白组血清培养IR脂肪细胞)、健脾化痰组 (基础培养液加10%健脾化痰组血清培养IR脂肪细胞)和吡格列酮组 (基础培养液加10%吡格列酮组血清培养IR脂肪细胞),培养48 h,葡萄糖氧化酶法检测细胞培养上清液中葡萄糖浓度,ELISA法检测细胞培养上清液中脂联素和抵抗素量,RT-qPCR检测NF-κB表达。结果与正常组比较,模型组葡萄糖消耗量和脂联素含有量显著降低 (P<0.05),抵抗素含有量显著升高 (P<0.05),NF-κB表达明显上调 (P<0.05);与模型组比较,健脾化痰组和吡格列酮组葡萄糖消耗量和脂联素含有量明显升高 (P<0.05),抵抗素含有量显著降低 (P<0.05),NF-κB表达下调 (P<0.05)。结论NF-κB、脂联素和抵抗素参与IR发生,健脾化痰方可能通过抑制IR脂肪细胞NF-κB异常表达,增加脂联素分泌、减少抵抗素分泌,改善IR。
胰岛素抵抗;健脾化痰方;NF-κB;脂联素;抵抗素;3T3-L1脂肪细胞
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已成为临床常见的一种慢性肝病,其发生发展机制尚未完全清楚。近年来研究表明,胰岛素抵抗 (insulin resistance,IR)在NAFLD发生发展中起关健作用,IR不仅导致脂肪在肝脏堆积,还引起肝细胞炎症、坏死,形成非酒精性脂肪性肝炎甚至肝硬化[1-3]。越来越多的研究表明脂肪组织是IR产生的始发部位,其分泌的脂肪细胞因子如脂联素、抵抗素、IL-6等与IR密切相关,针对脂肪细胞因子表达异常的治疗方法可显著改善IR[3-6],因此,改善IR状态脂肪细胞因子分泌成了目前防治IR相关的NAFLD等病的热点。健脾化痰方是我院治疗NAFLD的有效专方,多年来,在临床应用中疗效显著,并有较好的护肝、调节血脂和抗氧化等作用[7-8]。本实验运用药物血清学研究方法,观察健脾化痰方含药血清对胰岛素抵抗3T3-L1脂肪细胞NF-κB表达、脂联素和抵抗素分泌的影响,探讨健脾化痰方改善胰岛素抵抗3T3-L1脂肪细胞IR的可能作用机制。
1 材料与方法
1.1 动物与细胞株 SPF级雄性Wistar大鼠,由南京中医药大学实验动物中心提供,动物合格证号:SCXK(苏)2002-0031。3T3-L1小鼠前脂肪细胞株,购于浙江大学细胞研究室。
1.2 药物 健脾化痰方 (炒党参10 g、炒白术10 g、茯苓10 g、泽泻15 g、橘络12 g,姜半夏12 g、茵陈30 g、桂枝6 g、姜黄10 g、绞股蓝20 g、炙甘草3 g)购自常州市中医医院中药房,常规水煎,浓缩至1.20 g/mL,-20℃保存备用;盐酸吡格列酮片 (江苏德源药业有限公司,批号41203274)。
1.3 试剂 1640培养基,胎牛血清 (FBS)和胰蛋白酶(GIBCO公司);3-异丁基-1-甲基次黄嘌呤(IBMX);地塞米松,牛胰岛素,油红O干粉 (Sigma公司);葡萄糖测定试剂盒-氧化酶法 (北京普利莱基因技术有限公司);脂联素、抵抗素ELISA检测试剂盒(Uscnk公司);高纯总RNA快速提取试剂盒(Generay公司);逆转录试剂盒(Fermentas公司);qPCR试剂盒(Bio-Rad公司);其余试剂均为国产分析纯。
1.4 仪器 3111型二氧化碳培养箱(Thermo公司);spectra Plus 384型全波长酶标仪(美国MD公司);ECLIPSE Ti-S型倒置荧光显微镜(Nikon公司);SW-CF-2FD净化工作台 (苏州净化设备有限公司);5810R型台式高速冷冻离心机(Eppendorf公司);80-2型台式低速离心机(上海医疗器械 (集团)有限公司);DHG-9070A恒温箱 (上海精宏);Merinton SMA4000高精度分光光度计,CFX connect Real-Time PCR System及配套分析软件(Bio-Rad公司)。
1.5 含药血清的制备 SPF雄性Wistar大鼠40只,体质量 (200±20)g,适应性喂养2 d后,随机分组为空白组、健脾化痰组和吡格列酮组,根据人和动物间体表面积折算的等效剂量比值,换算不同的药物灌胃剂量,然后取等效剂量10倍量灌胃,即健脾化痰方2.4 g/(kg·d),吡格列酮40.5 mg/(kg·d),空白组给予相同体积的生理盐水灌胃,连续给药5次,每日相同时间分别给药2次,在第4次灌胃后禁食不禁水12 h后最后1次给药,1 h后,10%水合氯醛腹腔麻醉,无菌条件下腹主动脉取血,分别制备成空白组血清、健脾化痰组血清和吡格列酮组血清,灭活、过滤除菌、分管,-70℃保存备用。
1.6 实验步骤
1.6.1 3T3-L1小鼠前脂肪细胞培养及诱导分化成脂肪细胞
在37℃、5%CO2的条件下,3T3-L1前脂肪细胞置于含10%FBS的1640培养基的6孔培养板中培养,待细胞融合2 d后,换用含0.5 mmol/L IBMX、1μmol/L地塞米松、5μg/mL胰岛素和10%FBS的1640培养,48 h后再换用含5μg/mL胰岛素和10%FBS的1640培养基培养48 h,随后以10%FBS的1640培养基继续培养,2 d换液一次,诱导分化8~12 d的3T3-L1前脂肪细胞90%~95%呈脂肪细胞表型,进行油红O染色鉴定为脂肪细胞,可用于实验。
1.6.2 建立胰岛素抵抗3T3-L1脂肪细胞模型 参照文献[9-10],采用地塞米松诱导建立胰岛素抵抗3T3-L1脂肪细胞模型,对分化好的脂肪细胞分为正常组和模型组,正常组用10%FBS的1640培养基,模型组用含有1μmol/L地塞米松、10 nmol/L胰岛素和10%FBS的1640培养基,共培养144 h。每48 h换液,取培养上清液,用葡萄糖氧化法检测其葡萄糖量,计算葡萄糖消耗量,二者间差异有统计学意义作为建模成功依据。
1.6.3 分组及处理 正常脂肪细胞为正常组,胰岛素抵抗3T3-L1脂肪细胞模型随机分为模型组、健脾化痰组和吡格列酮组。正常组和模型组均给予含空白组血清的培养基,健脾化痰组和吡格列酮组分别给予含健脾化痰组血清和吡格列酮组血清的培养基,血清浓度均为10%,37℃、5% CO2培养48 h后,收集细胞上清,用于检测脂联素和抵抗素量,同时收集各组细胞,提取细胞总RNA,以测定细胞NF-κB表达。1.6.4 葡萄糖消耗量测定 取细胞培养上清液,2 000×g离心10min,收集上清,以葡萄糖氧化酶法检测每孔培养液中葡萄糖的量,与未接种细胞的空白孔葡萄糖量相减,计算葡萄糖消耗量。
1.6.5 ELISA法测定上清液中脂联素和抵抗素 取细胞培养上清液,2 000×g离心10 min,收集上清,按照ELISA试剂盒说明书操作检测脂联素和抵抗素。
1.6.6 实时荧光定量PCR技术测定脂肪细胞NF-κB基因mRNA水平
1.6.6.1 总RNA的提取及鉴定 每10 cm2生长的培养细胞中加入1 mL Trizol试剂,按说明书提取总RNA,测定RNA的纯度和质量,满足RT-qPCR要求。
1.6.6.2 引物合成 参考16sRND基因文库设计引物。NF-κB引物序列,正向5'-TCA ATGGCTACACAGGACCA-3',反向5'-ATCTTGAGCTCCGCAGTGTT-3';β-actin引物序列,正向5'-CAAAAGCCACCCCCACT CCTAAGA-3',反向5'-GCCC TGGCTGCCTCAACACCTC-3'。以上引物均由上海生工生物工程技术服务有限公司合成。
1.6.6.3 逆转录反应 按下列顺序将试剂加入到EP管中(共12μL)并进行操作:总RNA 3μL(约1μg),Oligo(dT)18引物1μL,随机引物1μL,DEPC水7μL,混匀,短暂离心,65℃干浴5 min;在冰上冷却,短暂离心,再放回冰上;往EP管里面加入以下试剂(共8μL):5 x Reaction Buffer4μL,Ribolock TMRNase Inhibition(20 U/μL)1 μL,10 mmol/L dNTP(mix)2μL,RevertAid TMM-MmLv Reverse Transcriptase 1μL,至总体积20μL;混匀,25℃干浴5 min,接着42℃干浴60 min。70℃干浴5 min终止反应。-70℃保存cDNA。
1.6.6.4 荧光定量PCR扩增实验 PCR扩增反应体系:IQ SYBR Green Supermix 12.5μL,正向引物10μmol/L 1 μL,反向引物10μmol/L 1μL,cDNA10.5μL。qPCR实验参数:①50.0℃预热3 min,②95.0℃预变性3 Min,③95.0℃变性10 sec,④60.0℃退火20 sec,⑤72.0℃延伸30 sec(终点读板模式),⑥从③至⑤重复40次,⑦每10 sec增加0.5℃,在65℃至95℃温度范围内建立熔解曲线 (终点读板模式),⑧结束。实验结果由荧光定量PCR分析软件BIO-RAD CFX Manager自动进行统计和计算,生成相应的数据文件。
1.7 统计分析方法 采用SPSS 13.0统计软件进行统计分析,计量资料数据以均数±标准差 (x±s)表示,组间及自身前后比较采用t检验。
2 结果
2.1 3T3-L1前脂肪细胞诱导分化及鉴定 诱导分化前的3T3-L1脂肪细胞呈梭形,与成纤维细胞相似,胞浆中无脂滴;定向分化为成熟的脂肪细胞典型表现为细胞浆丰富,含有大量脂肪滴,脂滴分布在核周围,呈 “戒环样”结构,油红O染色后可见胞质中脂滴着红色 (见图1)。
2.2 正常组和模型组各时点葡萄糖消耗量 由表1可知,用地塞米松诱导培养3T3-L1脂肪细胞48、96、144 h后,模型组葡萄糖消耗量均显著降低,与正常组比较,差异有统计学意义 (P<0.05),提示分化成熟的3T3-L1脂肪细胞经地塞米松诱导48 h建立IR脂肪细胞模型成功,并在144 h内较稳定。

表1 各时点葡萄糖消耗量比较 (x±s)

图1 3T3-L1脂肪细胞鉴定(×100)
2.3 健脾化痰方对IR脂肪细胞葡萄糖消耗量、脂联素和抵抗素分泌的影响 由表2可知,培养48 h时,模型组葡萄糖消耗量明显低于其他3组,健脾化痰组和吡格列酮组低于正常组,健脾化痰组低于吡格列酮组,差异均有统计学意义(P<0.05),提示健脾化痰方和吡格列酮均可显著提高IR脂肪细胞葡萄糖消耗量,吡格列酮优于健脾化痰方;模型组上清中脂联素量明显低于其他3组,健脾化痰组和吡格列酮组又显著低于正常组,吡格列酮组低于健脾化痰组,差异均有统计学意义 (P<0.05);模型组上清中抵抗素量高于其他3组,差异有统计学意义 (P<0.05),提示IR时,健脾化痰方可增加脂联素分泌和抑制抵抗素分泌。
2.4 各组细胞提取总RNA的质量和纯度 由表3可知,各组细胞所提取的RNA的A260/A280>2.0且<2.3,提示制备的RNA较纯,由图2可知,各组样品RNA均有清晰的5S、28S和18S三条带,且28S/18S约为2/1,提示样品RNA完整性好,RNA的质量浓度>3.2μg/μL,总量>50 μg。说明各样品总RNA的质量、浓度和总量符合进行RT-qPCR实验要求。
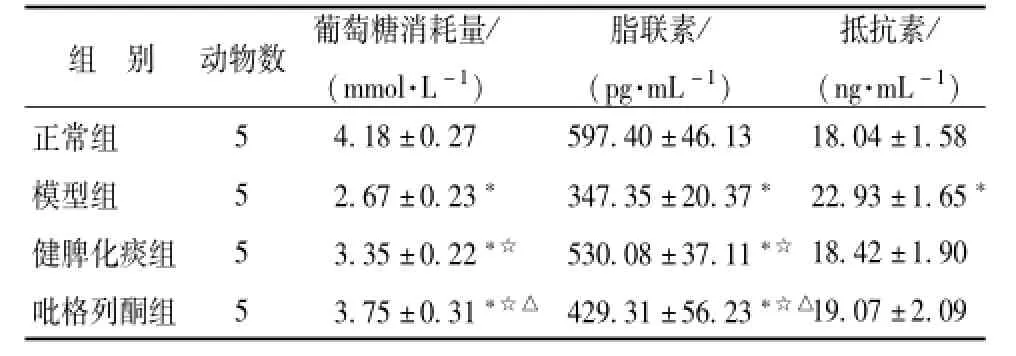
表2 4组上清葡萄糖消耗量、脂联素和抵抗素比较(x±s)

表3 各组细胞总RNA的质量(x±s)
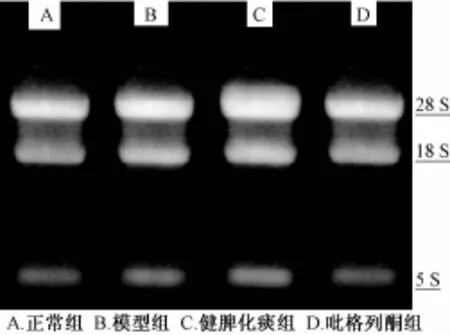
图2 总RNA电泳图
2.5 各组细胞NF-κB基因mRNA表达 由表4可知,当脂肪细胞出现胰岛素抵抗时,与正常脂肪细胞相比,NF-κB基因表达水平显著升高 (P<0.05),健脾化痰组和吡格列酮组均能显著下调其表达 (P<0.05)。
3 讨论
随着社会发展,与IR相关的疾病,如2型糖尿病、NAFLD和肥胖等,发病率呈上升趋势,有关IR产生机制和治疗措施是近年的研究热点,胰岛素作用的主要靶器官脂肪组织不仅是脂质能量贮存库,而且还可以分泌多种细胞因子参与机体物质代谢,调节能量平衡等,如分泌脂联素、抵抗素、瘦素、TNF-α、IL-6等,在参与维持机体组织对胰岛素敏感性中具有重要作用[11]。
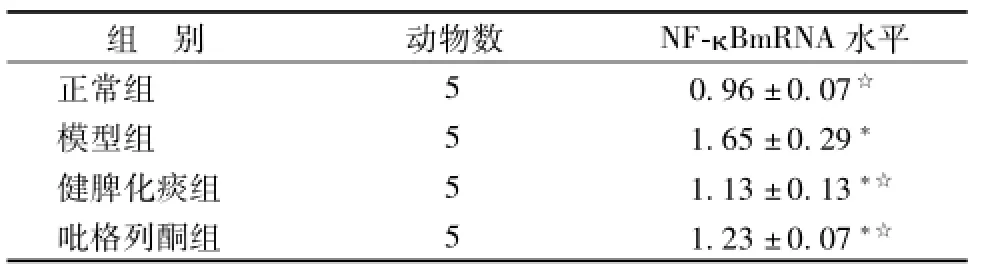
表4各组脂肪细胞NF-κB基因MRNA表达水平比较(x±s)
脂联素主要由脂肪细胞分泌,具有多种生物效能,尤其是与IR和NAFLD、糖尿病等发生发展密切相关。研究发现脂联素表达降低与IR的发生发展密切相关,IR又致脂联素水平进一步下降,脂联素下调和IR之间是互为因果的关系[12]。研究表明IR时,脂联素低表达,而NF-κB过表达,二者呈明显负相关[13],进一步研究提示IKK激活引起NF-kB活化可能与IR时脂肪组织脂联素合成减少有关[14]。
抵抗素是由脂肪细胞分泌的肽类激素,在啮齿类动物的机体生理代谢与调节中起重要作用[15]。Liu等研究说明抵抗素过表达与脂代谢紊乱和胰岛素抵抗有关[16]。进一步研究表明,抵抗素可通过多种途径抑制肝脏、骨骼肌和脂肪组织对胰岛素的敏感性,抑制胰岛素信号转导,影响糖脂代谢,破坏血糖稳态,提高血脂水平,促进高血糖和高脂血症形成,导致IR、2型糖尿病与NAFLD等的发生发展[17]。研究发现给予体外培养的3T3-L脂肪细胞一定浓度的胰岛素,抵抗素能降低其37%葡萄糖摄取量[18],抵抗素不仅能抑制胰岛素受体底物 (IRS)的磷酸化而影响胰岛素上游信号的正常传导,还可通过激活NF-κB抑制其下游通路的传导,而加重IR反应[19-20]。
由上述可见,IR与NF-κB、脂联素和抵抗素异常表达密切相关,因此,调节其异常表达可能对改善IR状态有重要意义。
目前,3T3-L1前脂肪细胞株被国内外学者广泛用于有关IR研究,对成熟的3T3-L1脂肪细胞可采用多种方法诱导建立IR脂肪细胞模型,用地塞米松诱导成熟的3T3-L1脂肪细胞建立IR细胞模型是常用的经典方法[9-10,21],本实验采用此方法,结果培养48 h后,模型组脂肪细胞的葡萄糖消耗量显著减少,与正常组比较,各个时点葡萄糖消耗量差异均有统计学意义 (P<0.05),但各时点各组自身前后比较,差异无统计学意义,提示地塞米松诱导48h是该造模方法成功构建功IR细胞模型的关键节点,且模型稳定性较好,与以往类似研究结果一致。
本研究表明,IR时3T3-L1脂肪细胞NF-κB基因表达上调,脂联素分泌减少,抵抗素分泌增多,再次证实NF-κB、脂联素和抵抗素异常表达与IR密切相关,与上述研究结果相似,提示NF-κB异常表达与脂联素和抵抗素异常分泌参与IR的发生,它们间相互作用机制有待进一步探索阐明。
健脾化痰方是我院治疗NAFLD的有效专方,方中党参、白术益气健脾,切断生痰浊之源;桂枝、茯苓、泽泻、茵陈温化痰浊;陈皮、姜半夏、荷叶、山楂燥湿化痰,消食理气和胃,祛已成之痰滞;姜黄、丹参养血活血通络,祛肝络之瘀滞,诸药合用,共奏健脾化痰,养肝通络之功,取气血并调,痰瘀并治之效。前期研究表明该方治疗NAFLD疗效显著,可明显改善机体血脂代谢、氧自由基代谢和调节有关脂肪细胞因子分泌功能[7-8]。本研究结果表明,健脾化痰方含药血清培养48 h时,IR脂肪细胞葡萄糖消耗量显著提高 (P<0.05),其提高的幅度不及吡格列酮组 (P<0.05),提示健脾化痰方和吡格列酮均可改善IR,吡格列酮优于健脾化痰方;上清中脂联素量明显高于模型组 (P<0.05),其提高的幅度显著高于吡格列酮组 (P<0.05),提示健脾化痰方和吡格列酮均可使IR脂肪细胞增加脂联素分泌,健脾化痰方优于吡格列酮;上清中抵抗素量明显低于模型组 (P<0.05),提示健脾化痰方和吡格列酮均可抑制IR脂肪细胞分泌抵抗素。由此可知,健脾化痰方改善脂肪细胞IR状态可能与其调节IR脂肪细胞分泌脂联素和抵抗素功能有关,这也是其治疗NAFLD具有良好疗效的机制之一。
NF-κB是一种重要的前炎症因子基因的转录调控子,除在肝组织的炎性反应、氧化应激、肝细胞凋亡和再生中发挥着重要作用外[22],还因其活化可致PI3K/Akt胰岛素信号通路障碍在IR的形成和发展中有重要作用[23],而IR又是NAFLD发病机制的中心事件,在NAFLD病情进程中起重要作用,表明NF-κB信号通路在IR和NAFLD发生发展中有重要作用。本研究结果表明,IR时,脂肪细胞NF-κB基因表达水平显著升高 (P<0.05),而健脾化痰方和吡格列酮均能显著下调其表达 (P<0.05),提示健脾化痰方和吡格列酮能下调IR时脂肪细胞NF-κB异常高表达,调节脂肪细胞因子分泌,改善IR。
综上所述,NF-κB、脂联素、抵抗素参与IR发生,健脾化痰方可能是通过抑制IR状态时脂肪细胞NF-κB异常高表达,增加其脂联素分泌和减少抵抗素分泌,从而改善IR,这也可能是其治疗NAFLD作用机制之一。
[1]McCullough A J.Pathophysiology of nonalcoholic steatohepatitis[J].JClin Gastroenterol,2006,40(Suppl 1):17-29.
[2]Utzschneider K M,Kahn S E.Review:The role of insulin resistance in nonalcoholic fatty liver disease[J].J Clin Endocrinol Metab,2006,91(12):4753-4761.
[3]Orlik B,Handzlik G,Olszanecka-Glinianowicz M.The role of adipokines and insulin resistance in the pathogenesis ofnonalcoholic fatty liver disease[J].Postepy Hig Med Dosw(online),2010,64:212-219.
[4]Diehl AM.Tumor necrosis factorand its potential role in insulin resistance and nonalcoholic fatty liver disease[J].Clinics in liver disease,2004,8(3):619-638.
[5]Polyzos SA,Kountouras J,Zavos C.Nonalcoholic Fatty Liver Disease:The pathogenetic roles of insulin resistance and adipocytokines[J].Current Molecular Medicine,2009,9(3):299-314.
[6]曾 俊,杨刚毅.脂肪细胞因子与胰岛素抵抗的关系及其机制研究新进展[J].成都医学院学报,2011,6(1):78-82.
[7]李保良,罗 仁,刘友章,等.健脾化痰法对非酒精性脂肪肝血清SOD和MDA的影响[J].辽宁中医杂志,2008,35(7):992-994.
[8]李保良,张 琪,杨 娟,等.健脾化痰方对非酒精性肝病脂联素、TNF-α和IL-6的影响[J].辽宁中医杂志,2014,41(5):860-863.
[9]刘晓莉,潘 瑜,束金莲,等.氯沙坦改善3T3-L1脂肪细胞胰岛素抵抗的机制研究[J].上海交通大学学报:医学版,2011,31(12):1702-1706.
[10]郭晓农,杨具田,牛 峰,等.胰岛素抵抗3T3-L1脂肪细胞模型的建立及鉴定[J].中药材,2008,31(2):258261.
[11]袁 慧.浅议脂肪细胞因子与胰岛素抵抗[J].科技致富向导,2011,19(30):22.
[12]张 媛,李英敏,冯月秋,等.血清脂联素水平与肥胖、胰岛素抵抗的关系探讨[J].山东大学学报:医学版,2009,47(6):124-127.
[13]杨智勇,赵 晟,夏婷婷,等.脂联素、核因子-κB在胰岛素抵抗大鼠表达[J].解剖科学进展,2007,13(2):131-133.
[14]崔丽娟,都 健,曾芙蓉,等.胰岛素抵抗大鼠脂联素与IKKmRNA表达的相关性研究[J].中国医科大学学报,2007,36(6):964-966.
[15]Steppan C M,Balley S T,Bhat S,et al.The hormone resistin links obesity to diabetes[J].Nature,2001,409(6818):307-312.
[16]Liu Y,Wang Q,Pan Y B,et al.Effects of over expressing resistin on glucose and lipid metabolisMin mice[J].J Zhejiang Univ Sci B,2008,9(1):44-50.
[17]王婉奕,朱 森,杨吉春,等.抵抗素与肥胖和2型糖尿病[J].生理科学进展,2009,40(2):157-160.
[18]Palanivel R,Sweeney G.Regulation of fatty acid uptake and metabolisMin L6 skeletal muscle cells by resist in[J].Febs Letter,2005,579(22):5049-5054.
[19]朱良荣,管小琴,祁明美,等.抵抗素在非酒精性脂肪肝大鼠胰岛素抵抗中的作用[J].中国生物制品学杂志,2012,25(2):185-189.
[20]马毅超,陈民利.NF-κB信号通路与胰岛素抵抗[J].中国比较医学杂志,2013,23(8):61-66.
[21]王丽静,张 尉,刘小莺,等.地塞米松诱导3T3-L1脂肪细胞胰岛素抵抗模型的建立[J].福建医科大学学报,2007,41(3):282-284.
[22]Qi MM,Guan X Q,Zhu L R,et al.The effect of resistin on nuclear factor-κB and tumor necrosis factor-a expression in hepatic steatosis[J].Zhonghua Gan Zang Bing Za Zhi,2012,20(1):40-44.
[23]Ribeiro PS,Cortez-Pinto H,Sola S,etal.Hepatocyte apoptosis,expression of death receptors,and activation of NF-kappaB in the liver of nonalcoholic and alcoholic steatohepatitis patients[J].AMJGastroenterol,2004,99(9):1708-1717.
R285.5
:B
:1001-1528(2015)05-1083-05
10.3969/j.issn.1001-1528.2015.05.035
2014-06-15
江苏省中医药科技项目 (LZ09114);常州市科技计划项目 (CZ20120017)。
李保良 (1965—),男,博士,主任中医师,从事中医药防治慢性脾胃疾病和脂肪肝机制研究。Tel:13912332933,E-mail:lbl513@163.com
