丹参注射液对大鼠肝微粒体CYP450亚型酶体外抑制作用
2015-01-13罗红丽王春燕杨楸楠
叶 娜, 罗红丽, 李 容, 王春燕, 杨楸楠, 万 丽
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137)
丹参注射液对大鼠肝微粒体CYP450亚型酶体外抑制作用
叶 娜, 罗红丽, 李 容, 王春燕, 杨楸楠, 万 丽*
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都611137)
目的评价丹参注射液在体外对大鼠肝微粒体细胞色素P450(CYP450)亚型酶活性的影响。方法将丹参注射液分别与5种CYP450亚型酶(CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4)的特异性探针底物非那西丁、甲苯磺丁脲、奥美拉唑、右美沙芬与大鼠肝微粒体进行孵育,采用UPLC-MS/MS法测定对应5种代谢产物对乙酰氨基酚、4-羟基甲苯磺丁脲、5-羟基奥美拉唑、右啡烷、N-去甲右啡烷的含有量并计算其IC50。结果丹参注射液对CYP1A2、CYP3A4的IC50值均大于100μg/ML,对CYP2C9、CYP2C19和CYP2D6的IC50值分别是3.32、16.44、0.30 μg/ML。结论丹参注射液对CYP1A2、CYP3A4没有抑制作用,但对CYP2C19和CYP2C9分别有弱和中等抑制作用,对CYP2D6表现出强抑制作用。
细胞色素P450酶;丹参注射液;大鼠肝微粒体;抑制
细胞色素P450酶(cytochrome P450 enzyme,CYP450)是一类以铁卟啉为辅基的血红素-硫醇盐蛋白,是生物体内参与各类外源性及内源性物质代谢的主要酶系[1],其主要亚型CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP2E1和CYP3A4参与市面上约90%的药物代谢[2],在决定药物清除率和生物利用度等方面起着关键重要。因此,充分了解药物对CYP亚型酶活性的作用,对于合理用药,提高药物的安全性和有效性具有重要意义;此外,在药物研发过程中,研究主要CYP酶介导的代谢特性已成为发现和筛选有效、安全的新化合物实体的必备环节[3-4]。
中药注射剂作为我国特有剂型,由于其成分复杂,主要还是通过药物代谢酶进行代谢,从而存在对代谢酶的抑制或诱导作用,发生药物相互作用,因此,对中药注射剂的体外代谢进行研究很有必要。丹参注射液为丹参提取物制成的水溶性制剂,含丹参素、原儿茶酸、原儿茶醛、丹酚酸A及B等多种成分,其中以丹参素含有量较高[5]。由于其在心脑血管疾病方面的突出疗效,临床上与多种药物的连用日益增多[6-9],但丹参注射液对CYP450酶作用的研究报道相对较少,刘高峰[10]等指出丹参注射液对家兔CYP2D6有抑制作用。前期课题组对丹参注射液进行了质量评价研究,采用HPLC法对丹参注射液主要水溶性有效成分进行定量测定,并进行了方法学考察。结果表明各成分线性关系良好,日内、日间精密度均小于5%,重复性好,精密度高,其主要有效成分丹参素、原儿茶醛、丹酚酸B、丹酚酸A的含有量分别是1.329 3、0.261 2、0.075 76、0.027 09 mg/mL。试验结果符合丹参注射液每1 mL含原儿茶酸不得少于0.2 mg的标准。因此,本研究采用探针药物法就丹参注射液对大鼠肝微粒体 5种 CYP450亚型酶 (CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4)的影响进行探讨,以期为丹参注射液临床合理联合用药的安全性和有效性等提供参考。
1 材料
1.1 仪器 Waters2010型高效液相色谱仪(600泵、717自动进样器、996PD紫外检测器、Waters MassLynx V4.1 Software数据处理系统);Thermo Heraeus Fresco 17低温冷冻离心机(Thermo Scientific公司);XW-80A微型旋涡混合仪(上海沪西分析仪器厂);HGC-24型氮吹仪 (北京瑞邦兴业科技有限公司);Millipore纯水系统(美国Millipore公司)。
1.2 药品与试剂 丹参注射液 (批号1405010,安徽天洋药业有限公司);SD大鼠肝微粒体 (20 mg/mL)购自武汉普莱特生物医药技术有限公司,于-80℃冷冻保存;NADPH发生系统(A液、B液)购自武汉普莱特生物医药技术有限公司,于-80℃冷冻保存;非那西汀(Sigma-Aldrich公司),对乙酰氨基酚(Sigma-Aldrich公司),甲苯磺丁脲(Sigma-Aldrich公司),4-羟基甲苯磺丁脲(Toronto Research Chemicals Inc公司),奥美拉唑(Sigma-Aldrich公司),5-羟基奥美拉唑(Toronto Research Chemicals Inc公司),右美沙芬(国家药品生物制品检定所),右啡烷(Toronto Research Chemicals Inc公司),N-去甲右啡烷(Toronto Research Chemicals Inc公司);地西泮对照品购自中国食品药品检定研究院,纯度大于99.0%。甲醇、乙腈为色谱纯,购自Fisher Scientifics公司,其他化学试剂均为分析纯。
2 实验方法
2.1 孵育体系 每个孵育体系总体积为200μL,体系包括0.1 mol的PBS缓冲液(pH=7.4)188μL,NADPH发生系统12μL(A液10μL;B液2μL),临用时冰浴上混合制得。各探针底物及对应的代谢产物、孵育浓度和时间如下[11-12]:非那西丁(对乙酰氨基酚,50μmol/L,30 min,CYP1A2);甲苯磺丁脲 (4-羟基甲苯磺丁脲,100 μmol/L,30 min,CYP2C9);奥美拉唑(5-羟基化奥美拉唑,20μmol/L,20 min,CYP2C19);右美沙芬(右啡烷,150μmol/L,10 min,CYP2D6);右美沙芬(N-去甲右啡烷,50μmol/L,10 min,CYP3A4)。
2.2 样品处理 取上述孵育体系,冰浴上加入1μL的系列质量浓度的丹参注射液 (1、10、100、1 000、10 000μg/mL)和1μL的各特异性探针底物 (空白对照样品不加丹参注射液,只加等量溶剂),在37℃水浴中预热5 min,冰浴上加入2μL的肝微粒体酶,轻轻混匀,根据不同的探针底物在37℃水浴中孵育10~30 min,加入4℃甲醇溶液(含内标地西泮20 ng/mL)1 000μL混匀终止反应,每个样品平行测定3次。实验中加入孵育体系中的药物体积控制在1%以内。
取终止反应后含内标的肝微粒体反应体系样品,旋涡振荡混匀3 min,12 000 r/min离心10 min,取上清液1 000μL,40℃下氮气吹干,相应的流动相100μL复溶,旋涡振荡混匀3 min,12 000 r/min离心15 min,吸取上清液适量,进样5μL,用LC-MS/MS法测定各特异性底物对应的代谢产物的生成量。
优化各代谢物的提取方法,其中对乙酰氨基酚、4-羟基甲苯磺丁脲用乙酸乙酯液-液萃取,5-羟基奥美拉唑、右啡烷和N-去甲右啡烷用甲醇萃取。
2.3 UPLC-MS/MS条件
2.3.1 色谱条件 对乙酰氨基酚、4-羟基甲苯磺丁脲、右啡烷和N-去甲右啡烷选用色谱条件为色谱柱为Waters Acquity UPLCTMBEH C18(2.1 mm× 50 mm,1.7μm);流动相为乙腈-0.1%甲酸水(65/35,V/V),体积流量0.2 mL/min;柱温30℃;样品室温度10℃;运行时间2 min;进样体积5μL。
5-羟基奥美拉唑色谱条件如下:Phenomenex kinetex C8色谱柱(2.1 mm×100 mm,1.7μm);流动相为乙腈-水梯度洗脱 (0~2.5min,35%乙腈~60%乙腈);体积流量0.2 mL/min;柱温30℃;样品室温度10℃;运行时间2.5 min;进样体积5μL。
2.3.2 质谱条件 通过优化选择质谱参数,最终确定的5种代谢物的质谱条件结果列于表1。

表1 各代谢产物测定的质谱参数及MRM检测条件Tab.1 Mass SpectruMparameters and MRMconditions ofmetabolites
2.4 数据处理 用各模型底物的代谢物的生成速率反映微粒体孵育体系中各CYP450亚型酶的活性;设定不加丹参注射液的代谢底物的孵育体系中各同工型酶活性为100%,作为对照组;样品组代谢物生成速率相对于对照组生成速率的百分比,作为各亚型酶的剩余活性。
剩余活性百分比=(各探针底物样品代谢物生成速率/对照样品代谢物生成速率)×100%。
采用SPSS statistics 17.0数据处理软件进行数据的统计分析。对于正态分布的参数,两组间比较采用独立样本t检验,P<0.05时认为该组数据具有统计学意义。用Excel对数据作图,以丹参注射液质量浓度对数值为横坐标,剩余酶活性百分率为纵坐标,得到剩余酶活性百分率为50%的对应丹参注射液质量浓度即为IC50。
3 实验结果
3.1 方法学验证
3.1.1 专属性 各待测组分及内标的峰形及分离良好,具有较高的特异性。对乙酰氨基酚,4-羟基甲苯磺丁脲,5-羟基奥美拉唑,右啡烷,N-去甲右啡烷及内标地西泮的保留时间分别是1.46、1.33、2.29、1.19、1.01、1.25 min。
3.1.2 标准曲线 采用上述选定的液相、质谱条件对5种代谢物进行定量,各代谢产物质量浓度(ng/mL)为横坐标,待测物峰面积 (A s)与内标峰面积(A i)的比值(A s/A i)为纵坐标,采用加权最小二乘法进行线性回归,得质量浓度与响应值的回归方程,线性范围如表2所示。

表2 各代谢物的线性范围Tab.2 Linear ranges ofmetabolites
3.1.3 精密度和准确度试验 取空白肝微粒体孵育体系,分别加入低、中、高质量浓度的不同代谢产物,样品处理同 “2.2”项下终止反应后含内标的肝微粒体反应体系样品,即再加入4℃甲醇溶液(含内标地西泮20 ng/mL)1 000μL,旋涡振荡混匀3 min,12 000 r/min离心10 min,取上清液1 000μL,40℃下氮气吹干,相应的流动相100 μL复溶,旋涡振荡混匀3 min,12 000 r/min离心15 min,吸取上清液适量,进样5μL,测定批内和批间差异。结果见表3,表明低、中、高3个质量浓度的批内、批间精密度均小于15%,符合要求,精密度良好。
3.1.4 提取回收率 取空白肝微粒体孵育体系,分别加入低、中、高质量浓度的不同代谢产物(对乙酰氨基酚、4-羟基甲苯磺丁脲、5-羟基奥美拉唑、右啡烷、N-去甲右啡烷),样品处理同“3.1.3”项样品处理方法,测定提取回收率。结果见表3,表明该质量浓度范围内回收率较高,准确度符合要求,测定结果准确、可信。

表3 不同探针代谢物批内、批间精密度和准确度 (x±s,n=6)Tab.3 Intra-assay precision,inter-assay precision and recovery of probemetabolites(x±s,n=6)
3.1.5 稳定性试验 取空白肝微粒体孵育体系,分别加入低、中、高质量浓度的不同代谢产物(对乙酰氨基酚、4-羟基甲苯磺丁脲、5-羟基奥美拉唑、右啡烷、N-去甲右啡烷),样品处理同“3.1.3”项,分别测定于进样器中放置 (4℃)24 h和-80℃冰冻放置7 d条件下的稳定性。结果见表4,说明各代谢产物于微粒体样品中稳定性良好。
3.1.6 基质效应 取空白肝微粒体孵育体系,分别加入低、中、高质量浓度的不同代谢产物 (对乙酰氨基酚、4-羟基甲苯磺丁脲、5-羟基奥美拉唑、右啡烷、N-去甲右啡烷),样品处理同“3.1.3”项样品处理方法,与相应浓度代谢产物样品结果进行比较,以两者峰面积的比值来计算基质效应。结果表明,各组分基质效应的平均值在87.98%~103.03%范围内 (表4)。
3.2 丹参注射液对大鼠CYP450酶各亚型的IC50的测定 丹参注射液对大鼠肝微粒体CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4的IC50值分别为见表5,抑制曲线见图1。实验结果可见,丹参注射液对CYP1A2,CYP3A4的IC50值>100 μg/mL,对CYP2C9,CYP2C19和CYP2D6的IC50值分别是3.32、16.44、0.30μg/mL。
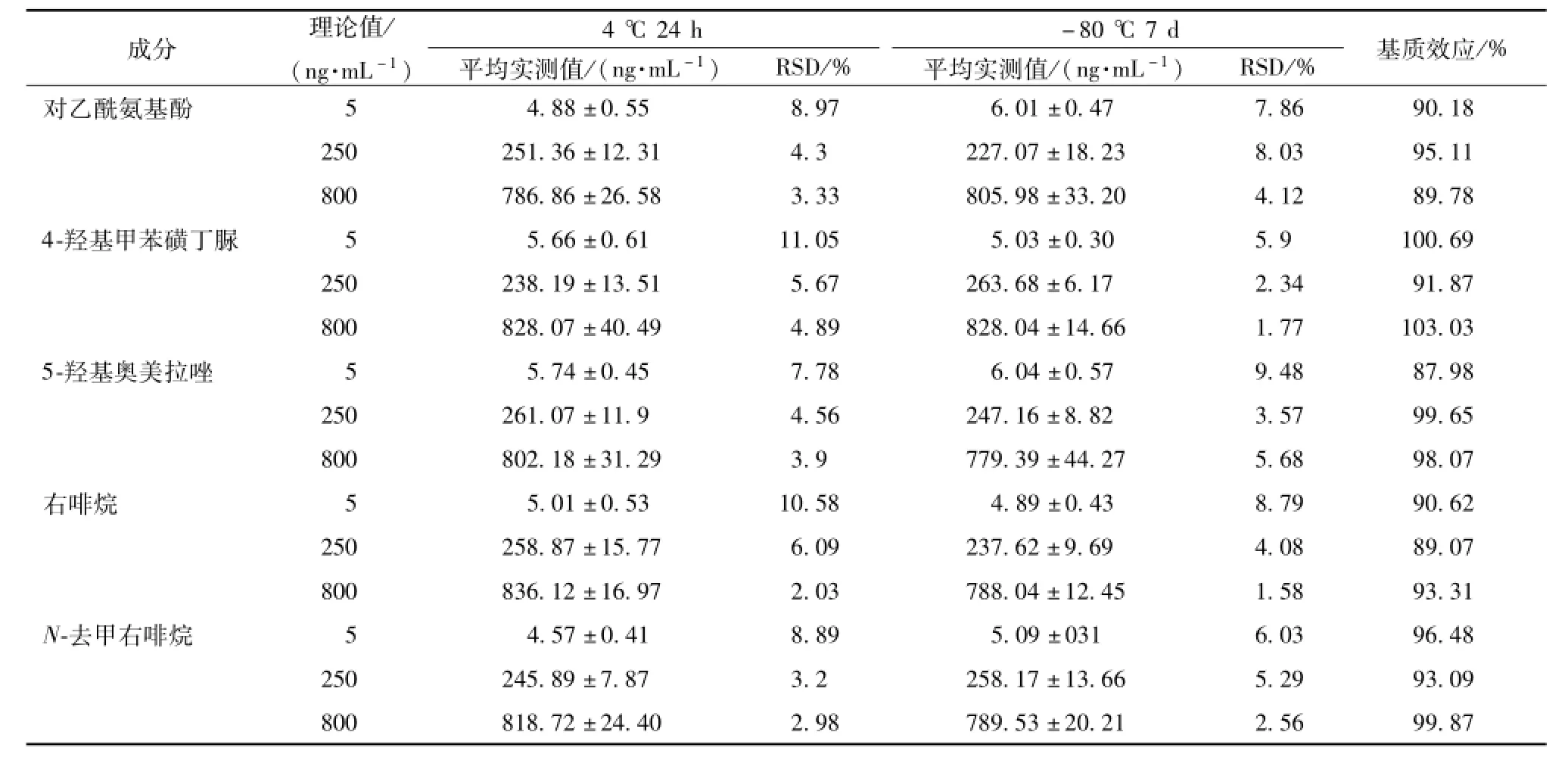
表4 不同探针代谢物的稳定性及基质效应 (x±s,n=6)Tab.4 Stability and matrix effect of probemetabolites(x±s,n=6)

表5 丹参注射液抑制大鼠CYP450酶各亚型的IC50值Tab.5 IC50values of Danshen Injection on five specific probes of CYP450

图1 丹参注射液对各5种大鼠CYP450亚酶活性的影响Fig.1 Effects of Danshen Injection on the activities of five rat cytochrome P450 enzymes
4 讨论
酶抑制作用是代谢研究的关键,是预测药物-药物相互作用和药物安全性评价的重要指标。本研究建立了较为简单快捷的分析方法,专属性强,线性范围宽,灵敏度、准确度高,满足生物样品分析方法的一般准则。
从实验结果可知,丹参注射液对CYP1A2、CYP3A4没有抑制作用,对CYP2C9具有中等抑制作用,对CYP2C19具有弱抑制作用,对CYP2D6表现出强抑制作用。文献[13-14]报道丹参的乙醇提取物主要含脂溶性成分,丹参酮类对CYP1A2、CYP3A4/5表现出相应程度的抑制作用,水溶性成分中的丹参素则是CYP2C9的中等强度抑制剂。丹参注射液主要是水溶性活性成分,因此对CYP1A2,CYP3A4几乎没有抑制作用,而对CYP2D6的强抑制作用与文献 [10]报道结果一致。秦崇臻等[15]指出丹参多酚酸盐能显著抑制人CYP3A4酶活性,复方丹参片对大鼠CYP1A2活性具有一定的诱导作用[16],可见,不同丹参制剂可能因为成分差异对不同CYP450的影响不同。但是,由于种属差异,人与大鼠的实验结果是否一致,还有待于下一步采用人肝微粒体或与人体合并用药等实验进行验证。
虽然体外实验证明丹参注射液对大鼠CYP450酶具有一定的抑制作用,且其主要化学成分如丹参素等蛋白结合率低[17],再者中药复方成分复杂,所以,在临床上与经CYP2C9、CYP2C19,尤其是CYP2D6代谢的药物联合应用时应特别注意。
综上所述,本研究采用体外肝微粒体孵育体系,研究了丹参注射液对5种大鼠CYP450亚型酶的抑制作用,为预测药物-药物相互作用,临床上应用丹参注射液及含丹参成分的注射液的安全性提供了参考。
[1]李丽波,孙 超,王玉春.蹄叶橐吾乙醇提取物对肝细胞色素 P450的影响[J].时珍国医国药,2010,21(5):1262-1264.
[2]刘高峰,甄立棉,杨 芳.Cocktail探针药物法在中药细胞色素P450酶代谢研究中的应用[J].医学导报,2009,28(8):1049-1052.
[3]Veith H,Southall N,Huang R,et al.Comprehensive characterization of cytochrome P450 isozyme selectivity across chemical libraries[J].Nat Biotechnol,2009,27(11):1050-1055.
[4]Zlokarnik G,Grootenhuis P D,Watson JB.High throughput P450 inhibition screens in early drug discovery[J].Drug Discov Today,2005,10(21):1443-1450.
[5]王 娟,马张庆,汪五三,等.丹参素钠及丹参注射液在大鼠体内的药动学比较[J].中国中药杂志,2009,34(22):2943-2945.
[6]Wang X,Yeung J H.Investigation of cytochrome P450 1A2 and 3A inhibitory properties of Danshen tincture[J].Phytomedicine,2012,19(3-4):348-354.
[7]马媛媛,李雪宁.丹参注射液与临床常用注射液配伍的稳定性[J].中成药,2013,35(4):705-708.
[8]何红晖.丹参注射液与黄芪注射液的药理作用及临床联用效果分析[J].中国药物经济学,2014,4(9):54-55.
[9]倪建江,傅理均.丹参注射液联合苯溴马隆治疗痛风性关节炎急性发作 36例[J].浙江中医杂志,2014,49(6):407.
[10]刘高峰,甄立棉,黄丽军.丹参注射液对家兔体内CYP1A2、CYP2D6和CYP3A4活性的影响[J].中国临床药理学与治疗学,2010,15(7):775-780.
[11]任 磊.液质联用技术对抗癌药物PAC-1的代谢研究[D].沈阳:沈阳药科大学,2009.
[12]Cohen L H,Remley MJ,Raunig D,et al.In vitro drug interactions of cytochrome p450:an evaluation of fluorogenic to conventional substrates[J].Drug Metab Dispos,2003,31(8):1005-1015.
[13]Wang X,LeeW Y,Or PM,etal.Effects ofmajor tanshinones isolated froMDanshen(Salvia miltiorrhiza)on rat CYP1A2 expression and metabolisMof model CYP1A2 probe substrates[J].Phytomedicine,2009,16(8):712-725.
[14]Qiu F,Zhang R,Sun J,et al.Inhibitory effects of seven components of danshen extract on catalytic activity of cytochrome P450 enzyme in human livermicrosomes[J].Drug Metab Dispos,2008,36(7):1308-1314.
[15]秦崇臻,陈 尧,谭志荣,等.丹参多酚酸盐对人肝微粒体中CYP450酶的抑制作用[C]//中南地区第八届生理学学术大会论文集.长沙:中国生理学会,2012:81-82.
[16]杜 玮.丹参多组分药物动力学研究及其制剂的质量评价[D].兰州:兰州大学,2008.
[17]李俊娟,吴 阳,张英丰.平衡透析法测定丹参素血浆蛋白结合率[J].河南中医,2012,32(6):763-764.
Inhibitory effect of Danshen Injection on rats liver cytochrome P450 enzyme in vitro
YE Na, LUO Hong-li, LIRong, WANG Chun-yan, YANG Qiu-nan, WAN Li*
(School of Pharmacy,Chengdu University of Traditional Chinese Medicine;Key Laboratory of Standardization of Chinese Herbal Medicine,Ministry of Education;State Key Laboratory Breeding Base of Systematic Research,Developmentand Utilization of ChineseMedicine Resources,Chengdu 611137,China)
cytochrome P450 enzyme;Danshen Injection;rat livermicrosome;inhibition
R285.5
:A
:1001-1528(2015)05-0948-06
10.3969/j.issn.1001-1528.2015.05.005
2014-06-19
叶 娜 (1989—),女,硕士生,从事药物分析、中药有效成分及质量标准研究。Tel:13808206512,E-mail:yena310@ 126.com
*通信作者:万 丽 (1965—),女,教授,博士生导师,从事药物分析、中药有效成分及质量标准研究。Tel:5982418713,E-mail:wanli8801@163.com
日期:2014-10-30
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20141030.1057.001.htMl
ABSTRACT:AIMTo investigate the inhibitory effect of Danshen Injection on the activities of five rat cytochrome P450 enzymes in vitro.METHODSDanshen Injection was incubated with five specific probes(phenacetin,orinase,omeprazole,dextromethorphan,and dextrorphan)belonging to five cytochrome P450 enzymes(CYP1A2,CYP2C9,CYP2C19,CYP2D6,CYP3A4)originated froMrat liver microsome,respectively.Their fivemetabolites(including acetaminophen,4-hydroxy tolbutamide,5-hydroxy omeprazole,dextrorphan,N-demethyl dextrorphan)were analyzed by UPLC-MS/MSassay.The IC50valueswere calculated.RESULTSDanshen Injection IC50values of CYP1A2 and CYP3A4 were more than 100μg/ML,and of CYP2C9,CYP2C19 and CYP2D6 were 3.32μg/mL,16.44μg/ML,and 0.30μg/mL,respectively.CONCLUSIONThe inhibitory effects of Danshen Injection on the activities of CYP2C9,CYP2C19,CYP2D6 aremedium,weak and strong,respectively,butno effecton the activities of CYP1A2 and CYP3A4.
