多层螺旋CT在原发性小肠淋巴瘤诊断中的价值
2014-12-28何贤纪念医院放射科广州番禺511400
何贤纪念医院放射科(广州 番禺 511400)
李胜华 孙庚喜
原发性小肠淋巴瘤(primary small intestinallymphoma,PSIL)系指原发于小肠壁淋巴组织的恶性肿瘤,是较常见的结外淋巴瘤之一。PSIL大多数为非霍奇金淋巴瘤(NHL),极少数为霍奇金淋巴瘤(HD)。随着多层螺旋CT(MSCT)的广泛应用,越来越多的小肠肿瘤得以发现和确诊。本研究回顾性分析我院经手术和病理证实的18例PSIL,总结分析其CT表现及相关临床资料,以进一步提高对PSIL认识。
1 材料与方法
1.1 一般材料 搜集我院2003年1月至2012年12月经手术病理证实且CT检查资料完整的PSIL18例,所有病例均符合Dawson标准[1],其中男13例,女5例,年龄32~75岁,平均年龄52岁。临床表现:腹部疼痛16例,多为持续性脐周疼痛;腹部包块7例;消化道出血伴贫血6例;恶心、呕吐、纳差伴体重下降5例;低热2例。
1.2 CT设备与检查方法 CT检查采用GE Lightspeed plus 4排螺旋CT机。患者检查前1日晚上用1000ml开水泡番泻叶15g饮用,以清洁肠道;检查前禁食12h;检查前2h至30min饮用纯净水l000~1500ml以充盈肠道。CT扫描范围从膈顶部至耻骨联合下缘,层厚5mm,螺距1.0。平扫后立即做增强扫描,用高压注射器自肘静脉以3ml/s静脉团注非离子型对比剂欧苏(300mgI/ml) 80~100ml,开始注射造影剂后20~25s为动脉期,60~70s为静脉期,延迟期3~8min不等。重建层厚、间距为5mm,必要时进行2.5mm重建。扫描所得图像传至工作站进行必要的MPR、CPR、MIP等图像重建。所有CT检查均经2名影像专科医师读片后做出诊断。
2 结 果
2.1 发病部位 18例PSIL患者均为单发病灶,其中回肠12例,空肠5例,十二指肠1例。
2.2 CT所见 根据本组PSIL患者的CT表现特点,可分为4型:肠壁增厚型、动脉瘤样扩张型、息肉肿块型、肠系膜浸润型。⑴肠壁增厚型:9例,肠壁呈不规则增厚,可对称或呈偏心性,厚度约1.5~4.0cm,受累肠管较长,部分病变肠管可有不同程度狭窄,2例伴有不全性肠梗阻,余未见明显梗阻征象;3例伴有邻近肠系膜淋巴结肿大;2例肠管浆膜面毛糙,邻近脂肪间隙见有条索影;增强扫描病变肠管及肿大淋巴结均呈轻、中度强化(见图1、2)。(2)动脉瘤样扩张型:6例,尽管受累肠管有明显的肠壁增厚,但管腔并不出现狭窄,反而明显扩张,呈“动脉瘤样”改变;3例伴有邻近肠系膜淋巴结肿大;2例肠管浆膜面毛糙,邻近脂肪间隙见有条索影;增强扫描病变肠管及肿大均呈轻、中度强化(见图3)。(3)息肉样肿块型:2例,表现为突向肠腔较大的息肉状软组织肿块影,形态规则或呈分叶状,密度较均匀,邻近肠壁见有增厚,增强扫描肿块呈轻中度强化。(4)肠系膜浸润型:1例,表现为肠系膜增厚,脂肪间隙密度增高,其内见条索影及形态不规则的结节或肿块,部分相互融合,包绕相应部位的肠系膜血管及其周围脂肪,形成 “夹心面包征”或 “三明治征”:即增强扫描时肠系膜肿块呈轻一中度强化,中间包绕着显著强化的肠系膜血管和低密度的肠系膜脂肪 (见图4),腹膜后见有多发肿大淋巴结。
2.3 病理结果 18例PSIL中非霍奇金淋巴瘤(NHL)17例,霍奇金淋巴瘤(HD)1例。免疫表型B细胞淋巴瘤16例,T细胞淋巴瘤2例。
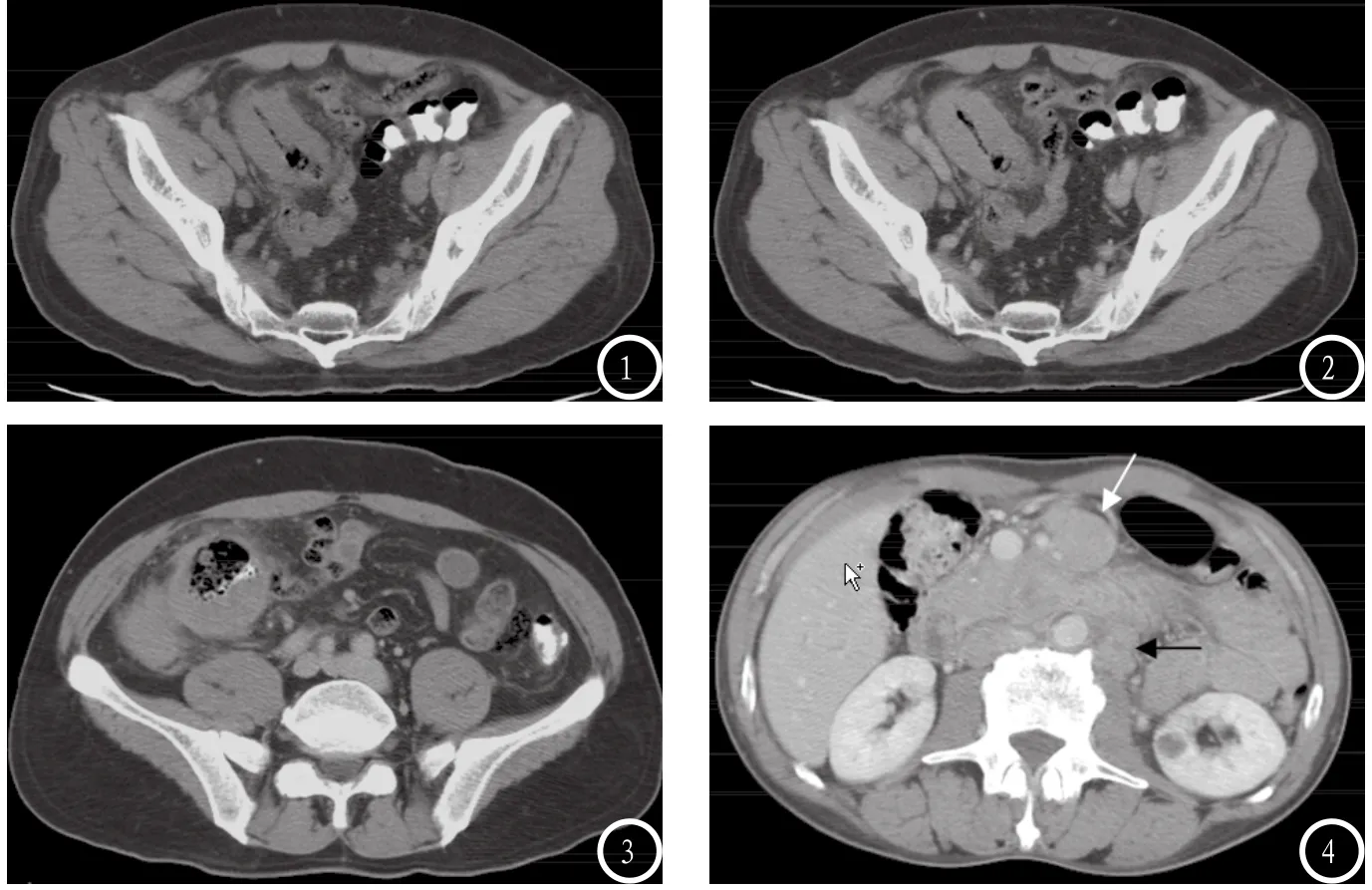
图1 CT平扫,盆腔右侧见回肠末段管壁对称性增厚,边缘清晰,密度均匀,CT值约45HU,管腔未见明显狭窄,周围脂肪间隙密度增高,见有少量条索影。图2 增强CT扫描,与图①同一病例,回肠末段病变见有中度均匀强化,CT值约70HU,较平扫增加约25HU。图3 增强CT扫描,盆腔右侧见回肠末端管壁呈不对称性明显增厚,密度均匀,见有中度强化,较平扫强化约22HU,局部管腔呈“动脉瘤样”扩张,部分浆膜面稍毛糙,周围脂肪间隙密度增高,见有少量条索影。图4 增强CT扫描,十二指肠水平段淋巴瘤沿肠系膜浸润形成多发结节,包绕强化的肠系膜血管,呈“夹心面包征”(白箭头),周围脂肪间隙密度增高,腹膜后腹主动脉旁见有多发肿大淋巴结(黑箭头)。
3 讨 论
3.1 PSIL发病情况及临床表现 PSIL是原发于小肠壁淋巴组织的恶性肿瘤,是最常见的小肠恶性肿瘤,在我国占小肠恶性肿瘤的40%~75%[2]。PSIL可发生于各个年龄段,以中老年男性多见。发病部位以回肠多见,尤其好发于回盲部和末端回肠,其次是空肠,十二指肠少见,这和小肠壁淋巴组织的分布情况相一致[3]。本组13例发生于回肠,约占67%。PSIL的临床表现主要有腹痛、腹部包块、消化道出血、恶心、呕吐、纳差、消瘦、发热及肠梗阻等非特异性表现。
3.2 PSIL的病因及病理 PSIL的致病原因目前尚未完全明确,有学者认为免疫缺陷及病毒感染与PSIL的发病有关。PSIL可分为霍奇金淋巴瘤、非霍奇金淋巴瘤,按其细胞来源又可分为B细胞淋巴瘤和T细胞淋巴瘤。临床上绝大多数为B细胞来源的非霍奇金淋巴瘤,组织学类型以弥漫性大B细胞淋巴瘤最常见。苏伟[4]等报道,霍奇金淋巴瘤占90%,B细胞淋巴瘤占85%。本组病例非霍奇金淋巴瘤(NHL)17例,B细胞淋巴瘤16例,与文献报道基本一致。
3.3 PSIL的CT表现 PSIL的主要CT征象有肠壁增厚、肠腔内息肉样肿块、肠管动脉瘤样扩张、肠系膜结节或肿块影、“夹心面包征”、腹腔及腹膜后淋巴结肿大、肠套叠等。参阅文献及仔细分析本组病例的CT表现,PSIL的上述CT表现有如下特点:(1)大部分PSIL均有不同程度的肠壁增厚(正常小肠壁厚小于3mm),并且增厚的程度多较明显,胡中华[5]等报道肠壁最厚可达5.1cm。肠壁增厚可对称或呈偏心性。增厚显著者形成息肉、结节或肿块,肿块大而形态不规则,可呈分叶状,边界清楚。受累肠段多较长,可呈多节段性分布,病变与正常组织间常无明确分界。(2)大部分病变肠管形态仍可变,仍能保持一定的扩张度和柔软度,即使肠管发生狭窄也较少发生完全性肠梗阻,这可能与淋巴瘤无诱导成纤维细胞反应的因素存在有关。本组18例中仅2例发生不全性肠梗阻。(3)病变肠腔可狭窄、正常或动脉瘤样扩张,后者主要是肿瘤在肠壁内浸润,破坏肠壁肌层内植物神经丛所致[6]。伴有肠腔动脉瘤样扩张的肠壁环形增厚以及后腹膜、肠系膜淋巴结肿大是PSIL特征性CT表现[7]。(4)肿瘤沿肠系膜浸润形成结节或肿块,肠系膜和后腹膜淋巴结可受累肿大,二者均可包绕肠系膜血管及其周围脂肪,可形成所谓的“夹心面包征”。(5)PSIL病灶密度多较均匀,增强扫描呈轻-中度强化,增强前后CT差值为20~35 HU,且各型PSIL病灶增强前后CT值差异无统计学意义[8]。本组18例PSIL,增强扫描静脉期11例中度强化,CT值较平扫增加20~32HU;7例轻度强化,CT值较平扫增加10~19HU。(6)肠套叠、肠穿孔是PSIL的重要的并发症。梗阻多由肠套叠引起,而肠套叠则多由淋巴瘤的息肉样腔内肿块诱发[9]。当临床遇到不明原因肠套叠时,应考虑小肠淋巴瘤的可能。肠穿孔则是由肿瘤形成溃疡穿破肠管浆膜层引起。据文献报道小肠淋巴瘤较结肠淋巴瘤更易穿孔[10],这可能与小肠壁薄、管腔窄有关。本组未见肠套叠及肠穿孔病例,可能与病例数较少有关。
3.4 MSCT图像重建技术在PSIL诊断中的价值 MSCT容积扫描的薄层重建及三期增强扫描,对细微病变、病变的血供情况、供血血管及肿瘤与周围组织器官的关系显示得更为清晰。MPR图像能达到各向同性,结合冠状、矢状MPR图像能更直观地观察病变的部位、形态、范位及其与周围组织器官的关系。CPR图像能够显示迂曲小肠病变的全貌及其与邻近组织器官的关系,为病变的诊断提供更为客观、直观的影像。MIP不但能够了解病变与周围大血管的关系,还可以帮助观察肿瘤的血供,特别是显示肿瘤血管的来源,为临床治疗提供重要的信息。本组病例经MIP重建,2例显示“肿瘤包绕血管”征像。值得注意的是各种重建图像不能孤立看待,必须结合容积扫描轴位图像进行综合分析,才能做出更加准确的诊断。
3.5 鉴别诊断 在临床工作中,PSIL主要应与如下良恶性病变相鉴别。(1)小肠腺癌:肠壁增厚型PSIL应主要应与小肠腺癌鉴别。小肠腺癌好发于十二指肠降段,尤以十二指肠以壶腹区十二指肠乳头周围多见;管壁僵硬、毛糙,管腔向心性狭窄,容易引起肠梗阻;增强扫描动脉期即明显强化,静脉期强化稍减弱,呈“快速上升-平台”模式[11]。PSIL好发于发于回盲部和末端回肠;特征性改变为肠壁明显环形增厚伴肠腔动脉瘤样扩张以及后腹膜、肠系膜淋巴结肿大;病变的肠壁能保持一定的扩张度和柔软度,很少引起肠梗阻;增强表现为轻-中度强化,呈“缓慢上升”模式。(2)小肠间质瘤:息肉样肿块型PSIL需与小肠间质瘤鉴别。小肠间质瘤好发于空肠,呈较大的类圆形或分叶状肿块,边缘清晰,周围肠壁无增厚,常伴坏死、囊变,富血供,增强扫描动脉期即明显强化,呈“快速上升-平台”改变[12],不伴邻近肠系膜及腹膜后淋巴结肿大。PSIL坏死、囊变少见,病变相邻部位的肠壁常明显增厚,增强呈缓慢上升轻-中度强化,常伴系膜及腹膜后淋巴结肿大。(3)小肠Crohn病:小肠Crohn病亦好发于末端回肠,需与PSIL鉴别。病变节段性分布是小肠Crohn病的特征,受累肠壁增厚一般较轻,厚度较均匀规则,累及范围较广泛,肠管狭窄较明显,增大的肠系膜淋巴结一般体积较小。PSIL肠壁增厚常较明显,累及范围相对较局限,肠管狭窄多不明显,肠系膜淋巴结多明显肿大,典型者呈“夹心面包征”。(4)小肠结核:小肠结核多发生于回盲部,需与PSIL鉴别。小肠结核多表现为升结肠和回肠末端肠管环形增厚,管腔狭窄、变形,可呈跳跃性分布,增强扫描病变区常可见不规则溃疡面,肠系膜、腹膜后肿大淋巴结呈环形或多环形强化,可伴高密度腹水及饼状、污垢状腹膜网膜增厚[13]。(5)小肠平滑肌肉瘤:小肠平滑肌肉瘤的特征性表现为肠襻间巨大的软组织肿块影,中央见低密度坏死区,增强后呈明显不均匀强化[9]。小肠淋巴瘤则多密度均匀,瘤体内很少出现坏死、液化。
MSCT扫描速度快、空间分辨率高、覆盖范围广、能够任意平面薄层重建,因而能够清晰显示小肠肿瘤的大小、形态、密度、内部结构、边界及强化方式,在PSIL的检出及定性中较其它检查方法具有较明显的优势。MPR、CPR、MIP等重建图像更能够直观显示PSIL的形态、累及范围以及肿瘤与周围组织的关系,对外科医生术前治疗方案的制定具有重要作用。因此,MSCT常规扫描结合后处理重建图像在PSIL的诊断中具有较明显的优越性,是一种较好的诊断PSIL的影像学方法。
1.Dawson IM,Comes JS,Morson BC.Primary malignantlymphoid tumours of the intestinal tract.Report of 37cases with a study of factors influencing prognosis[J].Br J Surg,1961,49(1):80-89.
2.黄文柱,张亚历,但汉雷.现代小肠病学[M].北京:军事医学科学出版社,2002,412-415.
3.汤钊猷主编.现代肿瘤学[M],第2版.上海:复旦大学出版社,2009.1118.
4.苏伟,黄美雄.原发性胃肠道淋巴瘤的临床进展[J].中国现代普通外科进展,2004,4(7):323-326.
5.胡中华,张冰,周科峰,等.小肠淋巴瘤的16排螺旋CT诊断[J].中国临床医学影像杂志,2006,17(10):578-580.
6.冯纪涛,丁志强,黄德健,等.原发胃肠道非霍奇金淋巴瘤的MSCT诊断[J].中国中西医结合影像学杂志,2012,10(5):441-443.
7.韦璐,陈刚,许彪,等.多层螺旋CT在诊断原发性小肠淋巴瘤中的应用[J].广东医学,2012,33(1):112-114.
8.唐永华,陈克敏,钟捷,等.原发性淋巴瘤的多层螺旋CT诊断[J].诊断学理论与实践,2008,7(1):42-46.
9.Julie A,Buckley,MD,Elliot K,et al.CT evaluation of small bowel neoplasms:spectrum of disease.Radiographics 1998,18(2):379-392.
10.Patel ZF,D,Ahorio R,Daly CJ.Lymphoma presenting asa large ulcerating small bowel lesion[J].Am J Surg,2001,181(4):362.
11.娄启田,钱海峰.小肠淋巴瘤与小肠腺癌的多层螺旋CT诊断及鉴别诊断[J].实用医学杂志,2010,26(24):4553-4555.
12.王小平 金中高.小肠淋巴瘤和小肠问质瘤的16层螺旋CT征象分析[J].影像诊断与介入放射学,2009,18(6):308-310.
13.奈日胜,童斌斌,李蓉芬.中华结核和呼吸杂志[J].肠结核的影像学诊断,2001,24(7):404-406.
