基于液相色谱与质谱联用技术的良性前列腺肥大小鼠血清代谢组学分析
2014-12-26孙丰霞邓立刚吕建云王聪聪
耿 越 , 孙丰霞, 马 玉, 邓立刚, 吕建云, 李 腾, 王聪聪
(1. 山东省动物抗性生物学重点实验室,山东师范大学生命科学学院,山东 济南250014;2. 山东省农业科学院农业质量标准与检测技术研究所,山东 济南250100)
随着国民经济水平的不断发展,我国已经进入老龄化社会阶段,而作为老年男性的常见病——良性前列腺肥大(benign prostate hyperplasia,BPH)也已成为影响老龄男性生活质量的一个常见因素,但其发病机制迄今尚未完全阐明。目前针对BPH治疗的化学药物主要有两种,一种是α-受体拮抗剂,包括多拉唑嗪、特拉唑嗪和盐酸坦索罗辛;另一种是5α-还原酶抑制剂,如非那雄胺和度他雄胺[1]。对中国11 个不同城市的33 个医疗中心的调查显示,60 岁以上男性良性前列腺肥大患者比例达47%,最常用的处方药是非那雄胺,其次是坦索罗辛[2]。代谢组学是继基因组学和蛋白质组学之后发展起来的一种研究生物系统的组学方法,通过分析生物体液及组织中所有小分子物质以观察有机体内物质代谢状况,研究生物体系的内源性代谢物质种类、数量及其变化规律,探索生物整体、系统或器官的内源性代谢物质与内在或外在因素的相互作用[3]。近年来,关于前列腺癌的代谢组学研究较多[4-6],而关于良性前列腺肥大疾病的代谢组学研究鲜有报道。本研究利用超高压液相色谱-四极杆飞行时间串联质谱技术(UPLC-QTOF-MS)检测正常小鼠、良性前列腺肥大小鼠及非那雄胺干预的模型小鼠血清代谢物的变化,并结合模式识别分析,寻找潜在的生物标志物,有助于了解前列腺肥大的发生发展过程。
1 实验部分
1.1 试剂与仪器
丙酸睾酮注射液,上海通用药业股份有限公司(L/N:121203);非那雄胺(艾世列),杭州康恩贝制药有限公司(L/N:20130201);乙腈和甲酸,色谱纯,美国Thermo Fisher Scientific 公司;纯净水,杭州娃哈哈集团有限公司;Acquity BEH C18 分析柱(100 mm×2.1 mm,1.7 μm),Waters XEVO G2-S QTOF 质谱仪,美国Waters 公司;Centrifuge 5804R 高速冷冻离心机,德国Eppendorf 公司;VORTEX QL-90 涡旋混合器,江苏海门其林贝尔仪器制造有限公司。
1.2 动物分组
4 周龄雄性昆明种小鼠(20 ±2)g,自由饮水摄食,适应性喂养一周。随机分为3 组,分别为空白对照组(control,n =8)、丙酸睾酮组(BPH model,n=7)和非那雄胺组(finasteride,n =8)。实验动物自由饮水。第1 ~4 周丙酸睾酮组和非那雄胺组每日按5 mg/kg 剂量腹腔注射丙酸睾酮,空白对照组每日注射等体积生理盐水。第4 ~6 周,非那雄胺组每日按0.8 mg/kg 剂量灌胃非那雄胺,其余两组每日灌胃等体积生理盐水。
1.3 样品收集和制备
第6 周末,将小鼠用乙醚麻醉后摘除眼球取血,并于4 000 r/min 离心后取上清液;加入20 倍体积乙腈去除蛋白质,涡旋混匀,于10 000 r/min 下离心10 min;取上清液,0.22 μm 微膜过滤,供UPLCQTOF-MS 测定。解剖分离前列腺组织,立即称重,计算前列腺指数(=前列腺平均重量/平均体重,mg/10 g)。
1.4 色谱和质谱条件
色谱条件:流动相A 为0.1% (v/v)甲酸水溶液,B 为0.1% (v/v)甲酸乙腈溶液,采用梯度方式洗脱样品。梯度程序:0 ~3 min,5% B ~70% B;3~8 min,90% B;8 ~9 min,100% B;9 ~10 min,5% B ~100% B;10 ~12 min,5% B。柱温:35 ℃,流速:0.3 mL/min。自动进样器温度设定为15 ℃,进样量:2 μL。
质谱条件:采用正离子模式;毛细管电压3.0 kV;锥孔电压40 V;脱溶剂气温度350 ℃;离子源温度120 ℃;锥孔气流量50 L/h;脱溶剂气流量600 L/h;采集时间范围0 ~12 min;扫描范围m/z 100~1 000;扫描时间0.1 s;扫描间隔0.02 s;使用甲酸钠对质谱仪器进行调谐,亮氨酸-脑啡肽实时精确校正质量。
1.5 数据处理
采用Markerlynx 软件(Waters,USA)进行色谱峰自动识别和峰匹配,每个样本的总峰面积归一化至10 000。导出的峰表按照80% 原则去除零值[7]。将数据导入软件SIMCA-P +12 (Umetrics,Umea,瑞典)进行偏最小二乘-判别分析(PLSDA)。采用Mann-Whitney U 检验分析生物标志物在各组间的差异。
2 结果与讨论
2.1 前列腺指数
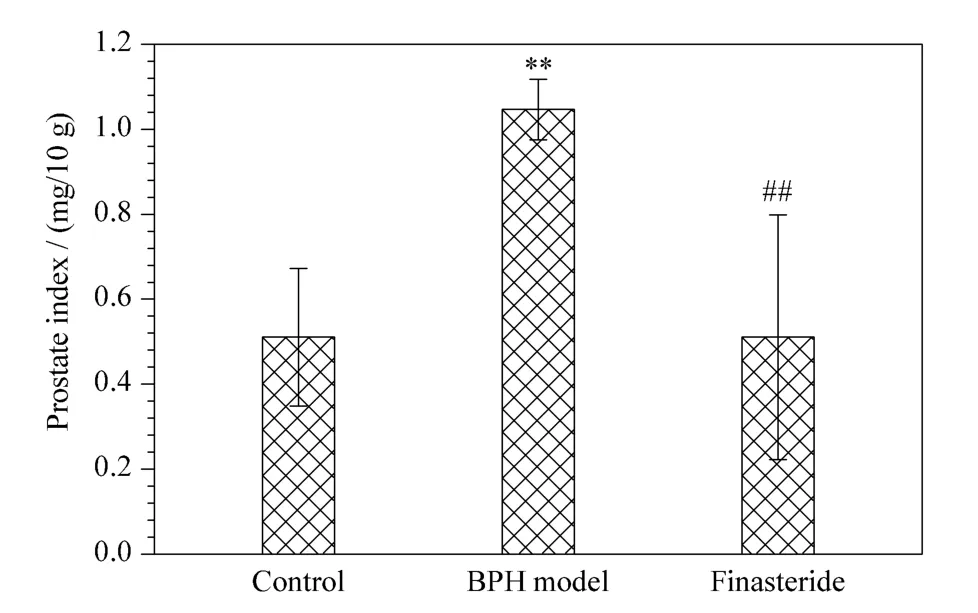
图1 3 组小鼠的前列腺指数Fig.1 Prostate indexes of three groups of mice
图1 为3 组小鼠的前列腺指数,与空白对照组相比较,丙酸睾酮组前列腺指数显著增大(P <0.01),表明模型建立成功;与模型组相比,非那雄胺组前列腺指数显著降低(P <0.01),表明非那雄胺治疗前列腺肥大效果显著。
2.2 血清代谢物谱差异分析
采用UPLC-QTOF-MS 进行血清样品的分离和数据采集,图2a、b 和c 分别为空白组、丙酸睾酮组和非那雄胺组小鼠血清样品的离子流基峰色谱图,可以观察到存在差异。
对数据进行了偏最小二乘-判别分析,图3a 和b 分别为空白组和模型组的得分图和载荷图。在得分图中,空白组和模型组获得了完全分离,其中95.8% 的样本符合模型判别(R2Y =0.958),模型的预测能力为91.3% (Q2=0.913),表明模型可靠。图3c(截距R2=0.316,Q2=-0.301)也显示出模型没有过拟合。与空白组小鼠相比,丙酸睾酮组小鼠的血清代谢物谱发生了明显变化,丙酸睾酮可能影响正常小鼠血清中代谢物,导致小鼠体内代谢紊乱。载荷图中,每个三角表示1 个化合物,离原点距离越远就表示这个化合物对空白组和模型组小鼠分类的贡献越大。结合变量权重重要性排序(VIP >1)及相关系数(Pcorr>0.58)值共找出了对空白组和丙酸睾酮组分离贡献最大的8 个变量,即潜在的生物标志物。
图4a 为空白组、丙酸睾酮组和非那雄胺组的得分图(R2Y =0.740,Q2=0.690),这3 组能够完全分离,其血清代谢物谱有明显的区别,且非那雄胺组向空白对照组接近,说明药物具有一定的治疗效果,但未能使前列腺肥大模型小鼠完全恢复到健康的代谢水平。图4b(截距R2=0.031,Q2=-0.304)显示出模型没有过拟合。
2.3 潜在生物标志物的鉴定分析

图2 (a)空白组、(b)BPH 模型组和(c)非那雄胺组小鼠血清样品的离子流基峰色谱图Fig.2 Ion base peak intensity (BPI)chromatograms of serum samples of (a)control group,(b)BPH model group and (c)finasteride group mice
利用UPLC-QTOF-MS 测得准确的相对分子质量,推测其可能的分子式。同位素匹配度越好,质量偏差越小的化合物为正确化合物的可能性越大[8]。再根据相对分子质量和二级质谱数据结合METLIN、NIST、HMDB 等数据库进行检索,对潜在的生物标志物进行分析,鉴定出1-十六烷酰基-SN-甘油基-3-磷酸胆碱(1-棕榈酰溶血磷脂酰胆碱,LysoPC(16∶0))、1-O-十六烷基-2-O-乙酰基-SN-甘油基-3-磷酸胆碱(血小板活化因子,PAF C-16)和(Z)-13-二十二烯酰胺(芥酸酰胺,erucamide)共3 个生物标志物。图5 反映了LysoPC(16∶0)、PAF C-16 与erucamide 在各组中的变化趋势:与空白组相比,丙酸睾酮组小鼠血清中前两种物质的含量均明显上升(P <0.001),经非那雄胺干预均有显著的下降(P <0.001);而芥酸酰胺在丙酸睾酮组小鼠血清中的含量明显下降,经非那雄胺干预后含量有显著的升高(P <0.01),但是并未恢复到空白对照组的水平,且与空白对照组水平也有显著的差异(P <0.01)。

图3 空白组和BPH 模型组的(a)得分图、(b)载荷图及(c)20 次置换检验的交叉验证结果Fig.3 (a)Score plots and (b)loading plots of control group and BPH model group and (c)the crossvalidation results with 20 times of permutation tests
2.4 BPH 小鼠血清代谢物谱反映的代谢机制
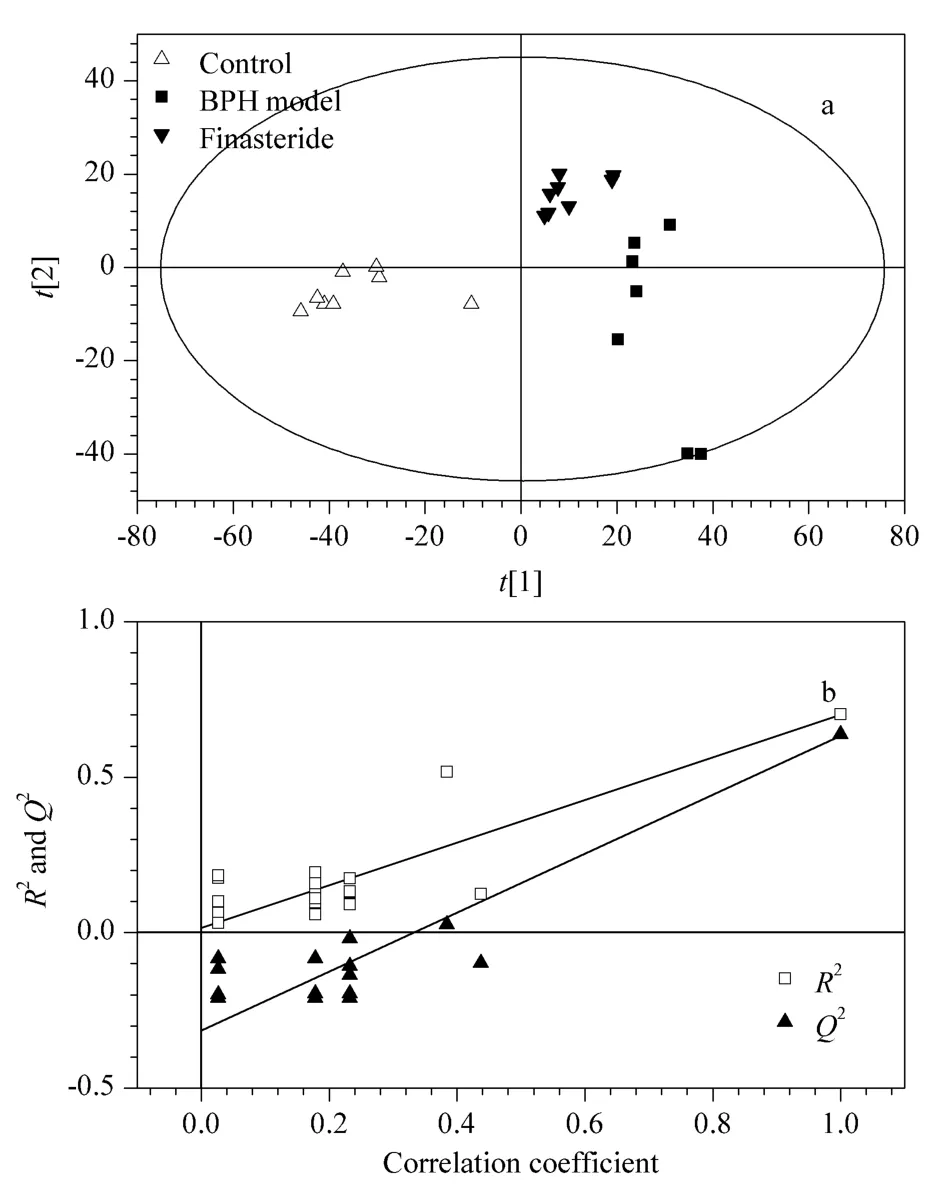
图4 空白组、BPH 模型组和非那雄胺组的(a)得分图和(b)20 次置换检验的交叉验证结果Fig.4 (a)Score plots of control group,BPH model group and finasteride group and (b)the cross-validation results with 20 times of permutation tests
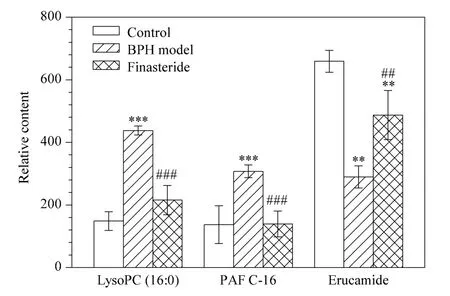
图5 3 个生物标志物在每组中的相对含量Fig.5 Relative contents of the three potential biomarkers in each group
在前列腺肥大模型小鼠血清中PAF C-16 与LysoPC (16∶0)含量显著升高。两者均与磷脂合成途径有关,且两者在脂质代谢中起信号传导的作用。首先血小板活化因子(PAF)可以促进肿瘤坏死因子的产生;调节白介素、金属蛋白酶组织抑制因子-1、基质金属蛋白酶-1 等的分泌加重炎症反应[9]。其次PAF 还可作用于花生四烯酸(AA),增加前列腺素(PGs)的释放,PGs 的增加会加重前列腺肥大。Murphy 等[10]曾发现,利用非甾体类抗炎药抑制催化AA 转化为PGs 的重要限速酶环氧化酶干扰PGs的合成,可以缓解BPH 合并前列腺炎患者的疼痛症状。并且PAF 受体与G 蛋白偶联后,磷酸酯酶C被激活,它作用于4,5-二磷酸磷脂酰肌醇,使其分解产生第二信使三磷酸肌醇和二酰基甘油,前者可诱导细胞Ca2+浓度的升高,后者可激活蛋白激酶C[11]。这与α1 肾上腺素受体介导的膀胱平滑肌收缩信号转导途径相同[12]。平滑肌的收缩会导致BPH 患者尿道压力的闭合性增强,引起尿流梗阻及膀胱刺激症状。近年来,对PAF 在动物疾病模型及人的内脏中的作用研究较多,均发现其在疾病个体中水平升高,起到负调节的作用[13-15]。
溶血磷脂酰胆碱(LPC)在前列腺癌和乳腺癌研究中均有报道[16-19]。在人体内,LPC 会在溶血磷脂酶D 的作用下转变成溶血磷脂酸(LPA)[20],LPA 是一种细胞膜脂类衍生物,它可以促进细胞增殖[21]。有研究发现LPC 可以通过巨噬细胞上的PAF 受体转移Ca2+,影响Ca2+在胞浆中的水平[22]。本实验观察到非那雄胺可以降低PAF C-16与LysoPC (16∶0)水平,提示其在体内调节BPH 过程中涉及磷脂代谢。众所周知,非那雄胺是一种5α-还原酶抑制剂,主要通过抑制前列腺内睾酮向双氢睾酮的转化来治疗BPH[23]。但蓝儒竹等[24]也曾发现非那雄胺可以通过调节血管内皮生长和凋亡因子来抑制BPH,说明其在人体内调节BPH 的方式是多样的。芥酸酰胺是脂肪酸酰胺,通常以受体介导的方式调节各种生理功能。Hamberger 等[25]在对腹泻的研究中从血浆中也发现了芥酸酰胺,其有调节水分平衡的作用。但芥酸酰胺确切的生物学功能尚未确定,且报道较少,与前列腺肥大疾病的关系仍需进一步探究。
BPH 的发病机制复杂,除了研究比较成熟的5α-还原酶和α1 肾上腺素受体外,磷酸二酯酶5、糖酵解酶、芳香化酶、生长因子、内皮素等也成为药物抗BPH 的潜在靶点[26-29]。这些发现有助于设计并筛选出选择性更高、毒性更小的新型抗BPH 药物,也是目前探索前列腺肥大治疗的一个重要方向。
3 结论
本实验运用UPLC-QTOF-MS 对前列腺肥大小鼠进行血清代谢组学研究,发现了3 个潜在的生物标志物,分别为1-棕榈酰溶血磷脂酰胆碱、1-O-十六烷基-2-O-乙酰基-SN-甘油基-3-磷酸胆碱和(Z)-13-二十二烯酰胺。其中涉及的PAF 受体有可能是药物抗BPH 的潜在靶点之一,有利于为前列腺肥大诊断及医学治疗开辟新途径。
[1] Shin I S,Lee M Y,Lim H S,et al. J Korean Soc Biol Chem,2012,55(2):205
[2] Wu N,Sun J,Yu P,et al. Int Neurourol J,2012,16(4):191
[3] Zhang X M,Zhang L H,Zhang Y K. Chinese Journal of Chromatography (张祥民,张丽华,张玉奎. 色谱),2012,30(3):222
[4] Wu H,Liu T,Ma C,et al. Anal Bioanal Chem,2011,401(2):635
[5] Saylor P J,Karoly E D,Smith M R. Clin Cancer Res,2012,18(13):3677
[6] Thysell E,Surowiec I,Hörnberg E,et al. PLoS One,2010,5(12):e14175
[7] Bijlsma S,Bobeldijk I,Verheij E R,et al. Anal Chem,2006,78(2):567
[8] Li L,Luo G A,Lu C J,et al. Journal of Modern Oncology(黎莉,罗国安,卢传坚,等. 现代肿瘤医学),2011,19(12):2361
[9] Jia D S,Hu W Y. Journal of Clinical Transfusion and Laboratory Medicine (贾道山,胡文英. 临床输血与检验),2003,5(4):312
[10] Murphy A B,Macejko A. Drugs,2009,69(1):71
[11] Yuan Q,Zhang X H,Qiao Y J. China Journal of Traditional Chinese Medicine and Pharmacy (袁奇,张小华,乔延江.中华中医药杂志),2011,26(7):1568
[12] Bartsch G,Rittmaster R S,Klocker H. Der Urologe Ausg A,2002,41(5):412
[13] Hai Q M,Shen D L,Liu Z L,et al. Henan Medical Research (海祺旻,沈德良,刘琮琳,等. 河南医学研究),2014,23(1):19
[14] Jiang L. Journal of Community Medicine (蒋黎. 社区医学杂志),2014(4):16
[15] Li Z W,Wang Z J,Xu X,et al. Journal of Clinical Emergency Call (李志伟,王著军,徐旭,等. 临床急诊杂志),2013(8):363
[16] Sakr M,Eid A,Shoukry M,et al. Bju Int,2008,101(3):2
[17] Geppetti P,Nassini R,Materazzi S,et al. Bju Int,2008,101(s3):2
[18] Ackerstaff E,Pflug B R,Nelson J B,et al. Cancer Res,2001,61(9):3599
[19] Glunde K,Jie C,Bhujwalla Z M. Cancer Res,2004,64(12):4270
[20] Mills G B,Moolenaar W H. Nat Rev Cancer,2003,3(8):582
[21] Zhao Z,Xiao Y,Elson P,et al. J Clin Oncol,2007,25(19):2696
[22] Kang A C,Huo Y,Qi L T. Chinese Journal of Arteriosclerosis (亢爱春,霍勇,齐丽彤. 中国动脉硬化杂志),2006,14(12):1083
[23] Liu J F,Deng M,Hou Y N. Medical Journal of National Defending Forces in North China (刘建芳,邓鸣,侯艳宁.华北国防医药),2006,18(4):286
[24] Lan R Z,Hu Z Q,Zhuang Q Y. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong (蓝儒竹,胡志全,庄乾元. 华中科技大学学报:医学版),2009,38(5):703
[25] Hamberger A,Stenhagen G. Neurochem Res,2003,28(2):177
[26] Xin Z X,Wang D W,Sheng C,et al. Progress in Modern Biomedicine (忻志祥,王大伟,盛畅,等. 现代生物医学进展),2012,12(18):3538
[27] Hieble J P. Drug Discov Today,2004,1(2):243
[28] Zhang J S,Liu J L,Liu N,et al. Beijing Medical Journal(张进生,柳建垒,刘宁,等. 北京医学),2014,36(4):292
[29] Liu Q B. Journal of Qiqihar Medical College (刘巧斌. 齐齐哈尔医学院学报),2013,33(22):3041
