基于七元瓜环多维配位聚合物的新型固相微萃取纤维的制备及对环境水样中多环芳烃的检测应用
2014-12-24颜丽芬周清娣
颜丽芬, 吕 研, 邵 琳, 周清娣, 董 南*
(1. 贵州大学化学与化工学院,贵州 贵阳550025;2. 悉尼大学化学院,澳大利亚新南威尔士州2006)
多环芳烃(PAHs)是一类广泛存在于环境中具有“致癌、致畸和致基因突变”三致特性的持久性有机污染物,已被世界各国列为优先控制的环境污染物[1,2]。环境中PAHs 的含量低,且存在大量干扰物质,传统色谱法对其直接测定很困难,因此需在测定前对样品进行预处理[3,4]。固相微萃取纤维(solid phase microextraction fiber,SPME fiber)技术是一种无需有机溶剂(或只需少量有机溶剂)的集样品萃取、富集和进样于一体的简便、快速且高效的样品制备方法,可方便地与气相色谱、高效液相色谱等技术联用,因此该技术在食品、药品、环境等分析中有广泛的应用[5-7]。涂层是固相微萃取的“心脏”,源于气相色谱固定液,后来发展到各种吸附材料。目前已商品化的涂层[8]有聚二甲基硅氧烷、聚丙烯酸酯、聚二甲基硅氧烷/二乙烯基苯、聚二甲基硅氧烷/聚乙二醇、碳分子筛/二乙烯基苯、二乙烯基苯/聚乙二醇/聚二甲基硅氧烷、碳分子筛/模板树脂等7 种。商品涂层种类有限,选择性较差,其推荐使用温度普遍偏低(200 ~280 ℃)、使用寿命短(一般约为40 ~100 次)且价格昂贵等,因而大大限制了它的应用。许多研究者致力于新型涂层材料的研究,如溶胶-凝胶类SPME 涂层[9,10]、活性炭纤维SPME 涂层[11]、限进介质SPME 涂层[12]及分子印迹SPME涂层等[13]。
瓜环是一种具有疏水性笼状内腔和两个亲水性端口结构特征的新型功能材料。瓜环端口的羰基氧原子具有阳离子键结合位点,能与亲水性物质、金属离子等相互作用,而其疏水性空腔可以根据其空腔大小,选择容纳尺寸、形状相匹配的客体分子[14]。近来在瓜环研究领域热点之一的瓜环配位聚合物则是利用金属离子或无机酸根离子与瓜环分子端口的羰基氧原子形成配位键,瓜环分子自组装形成的一维、二维,甚至是多维的具有孔道结构的超分子聚合物[15-17]。瓜环空腔的大小决定所得聚合物一维结构中纳米管道的孔洞大小,不同配位离子及配位环境决定聚合物三维空间空隙的大小。由于瓜环配位聚合物具有多维多孔道结构,比表面积大并且瓜环本身又具有良好的分子识别作用,因此其在样品前处理方面具有较好的潜在应用价值。目前这方面的研究工作不是太多[18,19],是瓜环配位聚合物应用领域的一个新的研究方向。

图1 以[CdCl4]2-诱导的Q[7]/Eu 多维配位聚合物的X 射线晶体结构Fig.1 X-ray crystal structures of the[CdCl4]2- induced Eu3 +cation coordination-based Q[7]-derived
本文以四氯化镉酸根离子([CdCl4]2-)诱导,镧系元素铕(Eu)配位七元瓜环(Q[7])自组装形成的多维配位聚合物[15]为涂层材料(结构见图1),Q[7]之间通过与两个Eu3+离子配位形成一维纳米管道结构,每个瓜环周围有3 个[CdCl4]2-离子,所形成的纳米管周围环绕着[CdCl4]2-离子,整体呈现蜂窝状结构。采用高温环氧树脂将之黏附在石英纤维基体表面,制备出新型固相微萃取纤维。利用该纤维顶空萃取加标花溪河水样品中的萘、苊、芴、菲、蒽、荧蒽、芘7 种多环芳烃物质,结合GC-FID方法进行了含量测定,结果表明该方法满足环境中痕量PAHs 的测定要求,证明以四氯化镉酸根离子诱导的Q[7]/Eu 多维配位聚合物在固相微萃取方面具有应用潜力。
1 实验部分
1.1 仪器、试剂与材料
DF-101S 集热式恒温加热磁力搅拌器(郑州长城工贸有限公司);JEOL JSM-6460LV 型扫描电镜(日本电子株式会社);PCT-1A 型热差天平(北京光学仪器厂);Agilent 4890 气相色谱仪(美国Agilent 公司);SE-54 毛细管柱(中国科学院兰州化学研究所);200 μm 石英纤维(河北永年光导纤维厂);5 μL 微量进样器(上海安亭科学仪器厂);固相微萃取器、PDMS 萃取头(美国Supelco 公司)。环氧树脂T-280A、环氧树脂T-280B(滁州惠盛电子材料有限公司);甲醇(色谱纯,天津市科密欧化学试剂有限公司);萘(分析纯,北京化工厂);苊、芴、菲、蒽、荧蒽、芘(均为分析纯,阿拉丁试剂(上海)有限公司);参照文献[15]制备以[CdCl4]2-诱导的Q[7]/Eu 多维配位聚合物;其他试剂均为分析纯。
1.2 实验步骤
1.2.1 SPME 装置的制备
石英纤维的处理:取一根长度约为10 cm、直径为200 μm 的石英纤维,其中2 cm 用作黏附高温环氧树脂涂层的载体,置于1 mol/L NaOH 溶液中浸泡约1 h,浸入深度约2 cm,对石英表面进行羟基化处理,然后用蒸馏水冲洗干净,再置于0.1 mol/L HCl 中浸泡30 min,浸入深度约为2 cm,然后用蒸馏水把酸洗尽,放入烘箱中烘干备用。
涂层的制备:将上述处理好的石英纤维均匀地涂覆上一层高温环氧树脂,然后将自制的四氯化镉酸根离子诱导的Q[7]/Eu 多维配位聚合物研磨成粉末均匀的黏附在其表面。
SPME 装置的制备:将5 μL 微量进样器针头及气密垫取下,截取适当长度制好涂层的石英纤维与推进器相连,套入微量进样器内芯再穿过气密垫,旋紧针头。在GC 进样口中,在较小氮气流下,先保持120 ℃干燥1 h,然后升至180 ℃继续干燥1 h,再升至250 ℃干燥30 min,置于室温干燥器中备用。
1.2.2 瓜环配位聚合物晶体的制备
取3 mL 6.0 mol/L 的HCl 加入到物质的量比为1∶8 的Q[7]和CdCl2的混合物中,在室温条件下搅拌使其充分溶解,再加入8 倍于Q[7]物质的量的Eu(NO3)3·6H2O 使其充分溶解,然后在室温条件下保存7 天即得淡黄色晶体。将该晶体在80 ℃烘干2 h,研磨成粉末,该粉末粒径均小于3 μm(电镜观察测定),比表面积为462.030 6 m2/g。
1.2.3 花溪河水样品预处理
在当地花溪湿地公园门口处对花溪河水进行采样,对采集到的河水样品先用分析滤纸过滤,取5 mL 滤液加入适量NaCl 配制成一定浓度的盐溶液,然后在最优条件下进行SPME 萃取。
1.3 实验条件
气相色谱柱采用SE-54 毛细管柱(30 m ×0.25 mm×0.25 μm);进样口温度250 ℃,检测器温度280 ℃;柱温采用程序升温:在60 ℃保持4 min,以30 ℃/min 升至120 ℃,再以4 ℃/min 升至250 ℃。
制备各物质质量浓度为10 mg/L 的混合标准溶液,再依次稀释成各质量浓度的系列混合标准溶液。取系列标准溶液0.5 mL、NaCl 溶液4.5 mL置于10.0 mL 的萃取瓶中,加入磁力搅拌子,用顶端带孔并配有聚四氟乙烯隔热垫的盖子密封,置于工作台上。
将萃取瓶置于数显集热式磁力搅拌器中,选定加热温度,搅拌速度为1 000 r/min。将SPME 萃取装置针管部分直接插入萃取瓶中,推出萃取头,萃取头居于溶液上方进行顶空萃取,经过一定时间的萃取后萃取完成,收回萃取头,拔出针管并将针管迅速插入GC 进样口,推出萃取头,热解吸一定时间后缩回萃取头并拔出。进行GC 分析。
2 结果与讨论
2.1 涂层的制备及表面形态显微结构
用高温环氧树脂将配位聚合物研磨成的粉末均匀地黏附在用酸、碱处理好的石英纤维表面形成稳定的涂层。该涂层在电镜扫描下呈现出疏松、均匀、多空的结构(见图2),厚度约为45 μm,这种结构可使涂层的比表面积显著增大,提高对分析物的萃取吸附量。
2.2 涂层热稳定性考察

图2 配位聚合物涂层的电镜图Fig.2 Electron micrographs of the cucurbit[7]uril/Eu coordination polymers induced by [CdCl4]2-anion coating
采用热重分析方法对聚合物涂层的热稳定性进行了考察,结果见图3。从图3 中可看出,在100 ℃时差示扫描量热(DSC)曲线有一吸收峰,对应热重分析(TG)曲线有14.13% 的重量失去,这可能是涂层吸附的结晶水失去。在100 ~400 ℃之间,配位聚合物几乎没有失去重量,表明该聚合物的热稳定性好,可满足GC 热解吸分析的要求。与普通Q[7]热重分析结果对比可看出,聚合物的热稳定性比普通七元瓜环的好。
2.3 SPME 萃取条件的优化
因SPME 分配中涉及三相之间的平衡,即溶液液相、萃取瓶内气相和萃取层相,且采用热解吸方法进行气相色谱检测,因此其萃取条件的优化综合考虑了萃取时间、盐离子浓度、萃取温度、解吸时间4个方面。试验中通过控制变量法寻找最优化条件,得到的最佳萃取条件为:解吸时间2 min;萃取温度75 ℃;萃取时间40 min;NaCl 质量浓度200 g/L,同样对Supelco 公司100 μm 的PDMS 商品进行了萃取条件的优化,最佳萃取条件为:解吸时间2 min;萃取温度65 ℃;萃取时间40 min;NaCl 质量浓度200 g/L。
2.4 聚合物萃取涂层和商品涂层的萃取性能比较
在各自的最优实验条件下,将自制聚合物涂层和Supelco 公司100 μm 的PDMS 商品涂层的萃取性能进行了比较,其结果如图4 所示,可以看出自制涂层对萘、苊、菲、荧蒽、芘的萃取效果比商品PDMS涂层的效果好或相当,而对线性结构的芴和蒽的萃取效果不如商品涂层。总的来说,自制涂层的萃取效果相当于商品PDMS 涂层,可用于多环芳烃类物质的萃取分析。

图3 配位聚合物的热重分析Fig.3 Thermal analysis of coordination polymer

图4 以四氯化镉酸根离子诱导的Q[7]/Eu 多维配位聚合物与商品PDMS 涂层萃取能力对比Fig.4 Extraction ability comparison of the cucurbit[7]uril/Eu coordination polymers induced by[CdCl4]2- anion coating and commercial PDMS coating
2.5 线性范围、精密度和检出限
在自制聚合物涂层的优化实验条件下,采用顶空萃取结合GC 外标法进行了定量分析,测定了7种PAHs 的含量。其线性范围、相关系数和检出限见表1。检出限根据公式LOD =3S0/S 计算(其中S0为10 次空白试剂所测的相对标准偏差,S 为分析校准曲线的斜率)。由表1 可见,该方法的线性范围为1 ~1 000 μg/L,相关系数在0.995 3 ~0.999 3之间,5 次平行测定的相对标准偏差(RSD)在3.6% ~8.6% 之间,检出限(LOD)为0.29 ~2.09 μg/L,表明该方法具有良好的线性关系和精密度。该配位聚合物涂层纤维重复使用50 次时,其测定结果的相对标准偏差不大于9%,对7 种多环芳烃的饱和吸附容量可达136.1 ~215.4 mg/g。
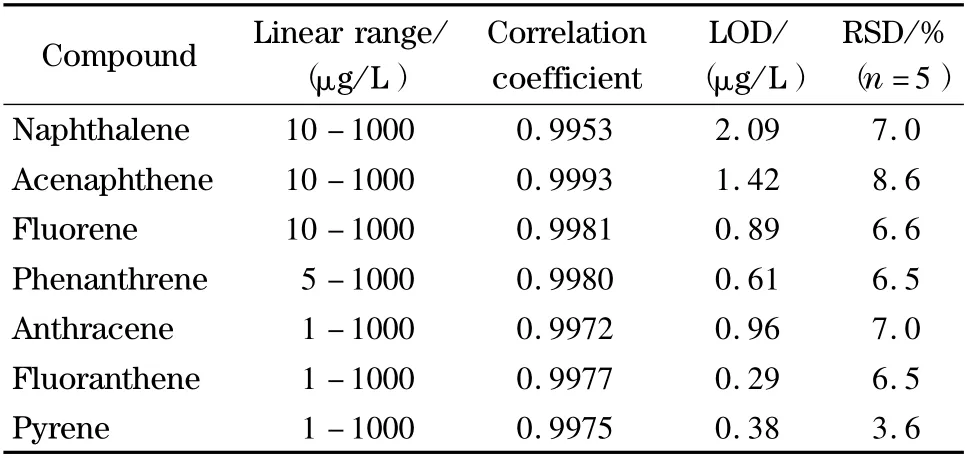
表1 自制涂层对7 种PAHs 的线性范围、相关系数、检出限和重现性Table 1 Linear ranges,correlation coefficients,limits of detection and precisions of the coating to the seven PAHs
2.6 环境水样中多环芳烃类化合物的测定分析

图5 花溪河水(a)空白样品及(b)加标水样中7 种PAHs 的气相色谱图Fig.5 GC chromatograms of the seven PAHs in(a)a blank sample and (b)spiked sample of Huaxi River water
在优化的实验条件下,以自制聚合物涂层作为萃取头,对当地花溪河水样品进行SPME/GC-FID分析测定,结果均未检测出这7 种PAHs 物质,如图5a 所示。在水样中加入混合标准溶液,制得质量浓度为50 μg/L 和500 μg/L 的加标样品,测定结果如表2 所示。质量浓度为50 μg/L 的加标样品回收率在97.2% ~109.0% 之间,RSD 在2.9% ~9.0% 之间;质量浓度为500 μg/L 的加标样品回收率在100.5% ~106.3% 之间,RSD 在2.8% ~9.8% 之间,表明该方法具有良好的准确度,满足水样中痕量PAHs 的分析测定要求。

表2 采用自制涂层对花溪河水两个水平的加标水样中7 种PAHs 的检测结果(n =5)Table 2 Results of the seven PAHs spiked in the Huaxi River water sample at two levels using the homemade coating (n =5)
3 结论
以四氯化镉酸根离子诱导的Q[7]/Eu 多维配位聚合物涂层制备的新型固相微萃取纤维具有良好的热稳定性,最高使用温度可高达380 ℃。纤维表面呈现出疏松、均匀、多孔的结构,可增大对分析物质的萃取吸附量。利用顶空固相微萃取结合GCFID 方法测定了水样中的7 种多环芳烃类物质,实验结果表明7 种PAHs 的检出限为2.09 ~0.29 μg/L,线性相关系数不小于0.995 3,回收率介于97.2% ~109.0% 之间,相对标准偏差(RSD,n =5)为2.8% ~9.8%。虽然该涂层对这7 种PAHs 的萃取检出限没有达到Lei 等[20,21]制备的涂层检出限ng/L 的级别,但作为一种新型固相微萃取涂层,其优良的热稳定性、良好的方法重复性和准确度以及与商品PDMS 相当的萃取效果,证明该聚合物具有固相微萃取方面的应用潜力。
[1] Liu Y,Beckingham B,Ruegner H,et al. Environ Sci Technol,2013,47(2):701
[2] Wang R W,Liu G J,Zhang J M,et al. Energy Fuels,2010,24(11):6061
[3] Zhang Y,Zhang X S,Yang P,et al. Chinese Journal of Analytical Chemistry (张渝,张新申,杨坪,等. 分析化学),2011,39(6):799
[4] Ding C M,Jin Y L,Lin S B. Chinese Journal of Analytical Chemistry (丁昌明,金银龙,林少彬. 分析化学),2012,40(3):397
[5] Jiang S X,Feng J J. Chinese Journal of Chromatography(蒋生祥,冯娟娟. 色谱),2012,30(3):219
[6] Jelen H H,Zioykowska A,Kaczmarek A. J Agric Food Chem,2010,58(24):12585
[7] Liu Y,Tang Y F,Song J F,et al. Chinese Journal of Chromatography (刘永,唐英斐,宋金凤,等. 色谱),2014,32(2):139
[8] Liu W M. [PhD Dissertation]. Dalian:Dalian Institute of Chemical Physics,Chinese Academy of Sciences (刘文民.[博士论文]. 大连:中国科学院大连化学物理研究所),2006:18
[9] Hu Y L,Fu Y L,Li G K. Anal Chim Acta,2006,567:211
[10] Zhang W Y,Sun Y,Wu C Y,et al. Anal Chem,2009,81:2912
[11] Yao G Y,Guan W N,Xu F,et al. Chinese Journal of Chromatography (姚桂燕,观文娜,许峰,等. 色谱),2008,26(5):590
[12] Mullett W M,Pawliszyn J. Anal Chem,2002,74:1081
[13] Zhang K G,Hu Y L,Hu Y F,et al. Chinese Journal of Chromatography (张凯歌,胡玉玲,胡玉斐,等. 色谱),2012,30(12):1220
[14] He X,Li G,Chen H. Inorg Chem Commun,2002,5(9):633
[15] Liang L L,Ni X L,Zhao Y,et al. Inorg Chem,2013,52:1909
[16] Ni X L,Xiao X,Cong H,et al. Chem Soc Rev,2013,42:9480
[17] Liang L L,Zhao Y,Zhang Y Q,et al. CrystEngComm,2013,15:3943
[18] Zhao Y,Liang L L,Chen K,et al. Dalton Trans,2014,43:929
[19] Ji N N,Cheng X J,Zhao Y,et al. Inorg Chem,2014,53(1):21
[20] Lei F F,Huang J Y,Zang X N. Chromatographia,2011,74:99
[21] Gholivand M B,Abolghasemi M M,Fattahpour P. Chromatographia,2011,74:807
