滨海沙地主要优势树种的凋落物分解及其与初始养分含量的关系
2014-12-24尤龙辉叶功富陈增鸿罗美娟游水生
尤龙辉,叶功富,陈增鸿,罗美娟,高 伟,游水生
(1.福建省林业科学研究院,福建福州350012;2.福建农林大学林学院福建 福州350001)
凋落物在森林生态系统中占有重要地位,是生态系统养分循环的基础.Chapin et al[1]研究表明,大多数生态系统中植物所吸收的养分,90%以上的氮和磷、60%以上的矿质元素均来自于植被归还给土壤的养分再循环.可见,凋落物分解影响着生态系统中的养分循环速率,从而决定着土壤养分的有效性[2].此外,凋落物分解所释放的CO2作为碳素收支的重要组分[1-2],影响着陆地生态系统的碳循环[2-4].近年来,国内外学者针对森林凋落物的分解及养分释放进行了大量研究[5-10].Xuluc-Tolosa et al[7]研究了墨西哥坎佩切次生雨林4个优势树种凋落物的分解动态及养分释放特征,结果表明,各优势种凋落物分解速率差异显著,分解速率与凋落物C/N显著负相关;王瑾等[9]对我国暖温带地区主要阔叶树种凋落叶分解过程中主要元素的释放节律进行了比较研究,结果表明,各树种各养分元素除C、K显著单调下降,其他元素含量变化规律性不明显.在南亚热带滨海沙地中,针对凋落物的研究也有诸多报道.谭芳林[11]、叶功富等[12]研究了木麻黄凋落物的分解及养分释放特征,结果表明,木麻黄凋落物分解周期较长,养分归还能力较差.林宇[13]研究了滨海沙地9年生厚荚相思(Acacia crassicarpa)和木麻黄(Casuarina equisetifolia)人工林凋落物的碳归还规律,结果表明,厚荚相思碳年归还量略高于木麻黄.沿海主要造林树种凋落物分解规律的研究对实现滨海沙地生态系统管理具有重要意义,以往的研究局限于对人工造林树种凋落物分解规律的探索,而对当地天然林乡土优势树种凋落物的分解规律研究较少,乡土树种可以有效改善人工纯林树种结构单一,生态系统脆弱,更新改造困难等问题[14].本文研究滨海沙地主要优势树种的凋落物分解及其与初始养分的关系,以期对改善滨海生态系统土壤状况和立地条件,以及为海岸带防护林树种选择提供参考.
1 研究区概况
试验样地位于福建省东山县赤山国有防护林场(23°40'N、117°18'E),气候属于亚热带海洋性季风气候,年平均气温为20.8℃,极端最高和最低气温分别为36.6℃和1.5℃,全年无霜期达330 d以上,年均降水量1103.8 mm,年均蒸发量为1156 mm,干湿季节明显,11月至翌年2月份为旱季,5-9月份为雨季.主要自然灾害为台风和干旱,台风年均5.2次,干旱年均3.2次.土壤以风积沙土为主,持水保肥性能差.土壤 pH 值为 4.0-5.0,全氮 0.34 g·kg-1,全钾 11.42 g·kg-1,全磷 0.13 g·kg-1,速效钾 19.58 mg·kg-1,有效磷 0.26 mg·kg-1,有机质 10.00 g·kg-1.
2 材料与方法
2.1 试验材料
分别选择木麻黄人工纯林、木麻黄—潺槁木姜子(Litsea glutinosa)阔叶混交林、湿地松(Pinus elliottii)—簕竹(Bambusa blumeana)—潺槁木姜子混交林及天然次生林4种林分类型中的9种主要优势树种为研究对象.
2.2 研究方法
2.2.1 样方的选择和调查 于2009年10月份,在4种林分类型中分别设置20 m×60 m样地,调查林分因子,见表1.
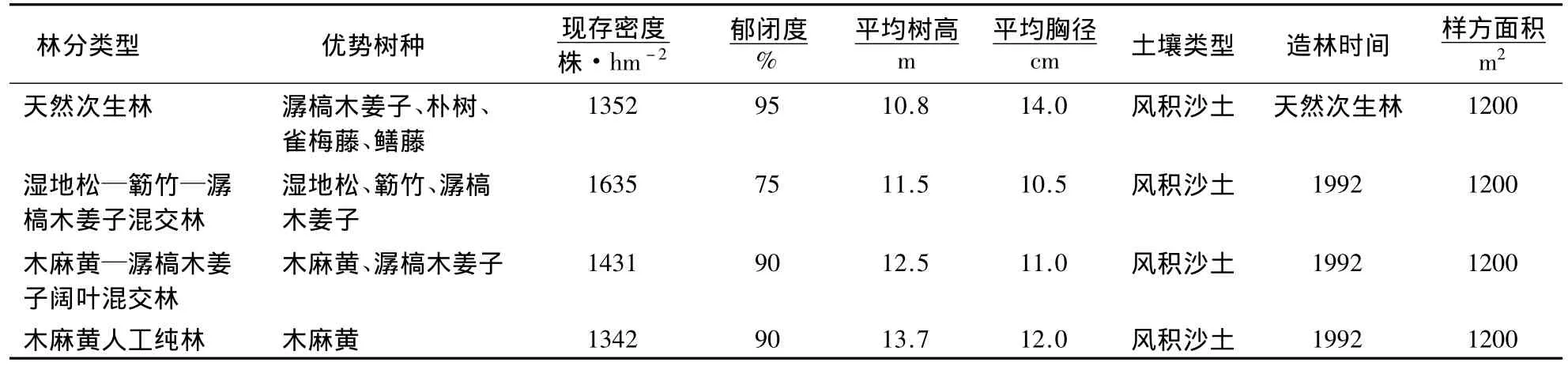
表1 各样地林分概况Table 1 Basic status of sampled plots tested in the experiment
2.2.2 试验设计 在不同林分类型的样方内各布设10个规格为1 m×1 m×20 cm的凋落物收集框,离地50 cm水平放置.自2010年1月-2010年12月,每2个月底收集1次凋落物,测定各树种各自凋落物(主要为凋落叶,占80%以上)的干重.
在4种林分类型中共收集到9种主要优势树种种,分别为:潺槁木姜子、湿地松、木麻黄、黄连木(Pistacia chinensis)、鳝藤(Anodendron affine)、雀梅藤(Sageretia thea)、榕树(Ficus microcarpa)、簕竹(Bambusa blumeana)和朴树(Celtis sinensis).将各优势种凋落物60℃烘干后称取10 g装入尼龙网袋中,每个优势种共36袋,随机置于木麻黄林地表面.试验从2010年1月开始,历时1年,每60 d最后1 d按植物种类各收集3袋,清除尼龙网带附着杂物后,烘干称重,计算凋落物失重率,再把凋落物粉碎过筛,贮存备用.
2.2.3 养分分析 碳、氮含量采用德国Elementar Vario Max CNS自动分析仪测定,磷采用钼蓝比色法(UV2802PC紫外分光光度计)测定.
2.2.4 数据处理 采用Olson指数衰减模型拟合凋落物的年分解动态:
Olson模型为:Y=1-e-kt,式中:Y为凋落物年失重率(%),t为凋落物分解年限(a),k为凋落物分解指数.
利用Excel 2003软件对凋落物失重率及Olson模型分解指数的计算;利用SPSS 17.0对凋落物失重率与时间(月)进行回归分析,对凋落物初始C、N、P含量及C/N、C/P、N/P与分解指数k进行相关分析和回归分析.
3 结果与分析
3.1 各优势种凋落物失重率及其Olson指数衰减模型
3.1.1 凋落物失重率的时间动态 经过1年的分解,各树种凋落物的分解特征各异(表2).其中,潺槁木姜子凋落物的分解速率随时间推移呈现下降的趋势,前4个月,分解速率较快,平均月失重率8.05%-11.9%,6月-12月份,分解速率较缓慢,平均月失重率仅2.60%-3.85%;分解1年后,总失重率达到64.40%.朴树凋落物的分解速率随时间推移呈先平缓上升后急剧下降的趋势,前8个月,分解速率较高,平均月失重率6.20%-9.30%,10月-12月份,分解速率急剧下降,平均月失重率仅1.60%-2.20%;分解1年后,总失重率达到71.40%.榕树凋落物分解速率随时间推移也呈现向上升后下降的趋势,其中6月-8月份,分解速率较快,平均月失重率7.75%-7.80%,其它月份平均月失重率保持在3.70%-5.35%,分解1年后,总失重率达到69.30%.木麻黄凋落物分解速率在前4个月较快,平均月失重率5.65%-6.20%,6月-12月份则趋于平缓,平均月失重率为1.50%-4.90%,分解1年后,总失重率达到48.80%.簕竹分解速率较快的月份分别为2月、6月和12月份,平均月失重率为6.90%-8.00%,其他月份则相对缓慢,平均月失重率为4.30%-5.80%;分解1年后,总失重率达到74.60%.湿地松凋落物分解速率也呈现逐渐下降的趋势,前4个月,分解速率较快,平均月失重率为7.75%-7.95%,6月-12月份,分解平缓,平均月失重率为1.05%-3.30%;分解1年后,总失重率达到46.00%.黄连木凋落物分解速率的变化趋势与簕竹一致,在2月、6月和12月份,分解较快,平均月失重率为7.40%-11.25%,其他月份分解较慢,平均月失重率为2.15%-5.90%;分解1年后,总失重率达到76.80%.鳝藤在2月份分解最快,月失重率达到17.10%,10月份最慢,月失重率为0.75%,其他月份相对平缓,平均月失重率为4.00%-7.00%;分解1年后,总失重率达到84.00%.雀梅藤在2月份,分解速率也达到最大值,为13.20%,6月-8月份分解速率也相对较快,平均月失重率为8.10%-8.70%,其他月份平缓,平均月失重率为3.00%-4.00%;分解1年后,总失重率达到81.40%.
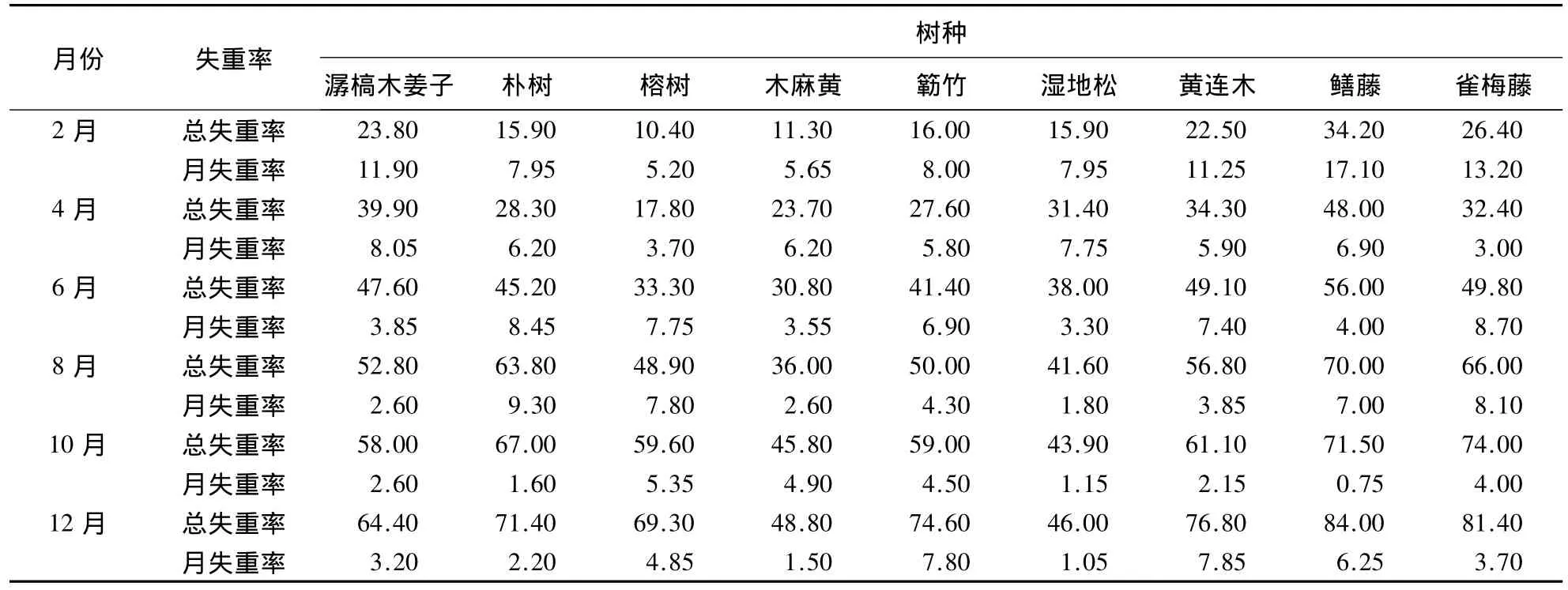
表2 各优势种凋落物失重率Table 2 Dry mass losses rates in the major dominant tree species %
3.1.2 Olson指数衰减模型及半衰期估测 凋落物的年度分解动态可用Olson指数衰减模型来拟合,同时,也可用它来估算凋落物的半衰期t0.5(凋落物分解50%时所需年限)和t0.05(凋落物分解95%时所需年限).对9个树种凋落物的半衰期及年变化估测结果显示(表3),除了木麻黄和湿地松t0.5>1年外,其他树种均小于1年,黄连木、鳝藤和雀梅藤甚至小于0.5年,就可完成50%的分解.9个树种t0.05最大的仍然是木木黄和湿地松,分别为 4.4750 和 4.8617 年;鳝藤和雀梅藤 t0.05最小,分别为 1.6347 和 1.7810 年;其他树种t0.05均为2.0000-3.0000年.Olson模型预测分解50%所需时间比各树种实际分解50%所需时间高出约-24%-15%,其中潺槁木姜子、榕树、簕竹和雀梅藤偏出较高,分别达到15%、-12%、-24%和-18%;朴树、黄连木和鳝藤偏出较低,分别为-5%、-5%和-9%;木麻黄偏出最小,达到4%.由于本研究中凋落物的分解试验只进行了1年时间,因此,尚无法判断用Olson模型估算各树种凋落物分解95%时所需年限是否符合实际情况,这有待进一步的试验验证.总体上用Olson模型来预算树种凋落物失重率的半衰期和年变化规律基本符合实际情况.
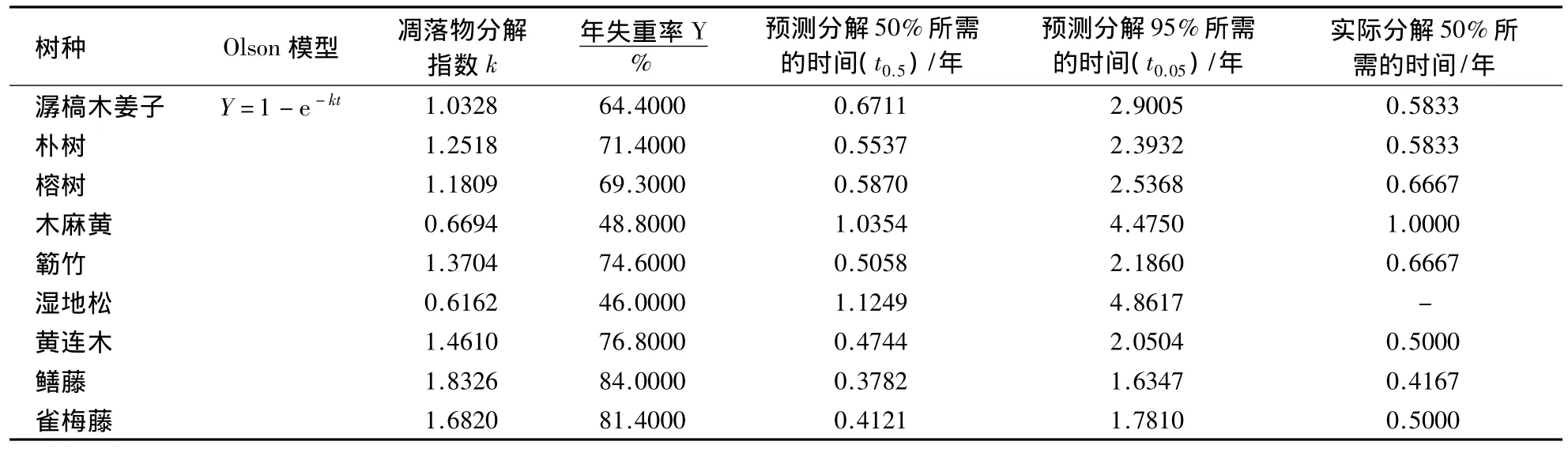
表3 凋落物失重率年变化的Olson模型和半衰期估测1)Table 3 Olson exponential decay model and estimation of litter's half-life
3.2 各优势种凋落物初始养分含量及其与分解指数k的相关性
3.2.1 凋落物初始C、N、P含量及C/N、C/P和N/P 从表4中可以看出,凋落物初始N含量的大小依次为鳝藤、簕竹、潺槁木姜子、朴树、雀梅藤、黄连木、木麻黄、榕树、湿地松;初始C含量的大小依次为湿地松、木麻黄、潺槁木姜子、黄连木、雀梅藤、榕树、鳝藤、簕竹、朴树;初始P含量的大小依次为鳝藤、朴树、黄连木、潺槁木姜子、榕树、雀梅藤、簕竹、湿地松、木麻黄;C/N大小依次为湿地松、榕树、木麻黄、黄连木、雀梅藤、潺槁木姜子、簕竹、朴树、鳝藤;C/P大小依次为木麻黄、湿地松、簕竹、雀梅藤、榕树、潺槁木姜子、黄连木、朴树、鳝藤;N/P的大小依次为簕竹、鳝藤、朴树、榕树、木麻黄、潺槁木姜子、湿地松、雀梅藤、黄连木.
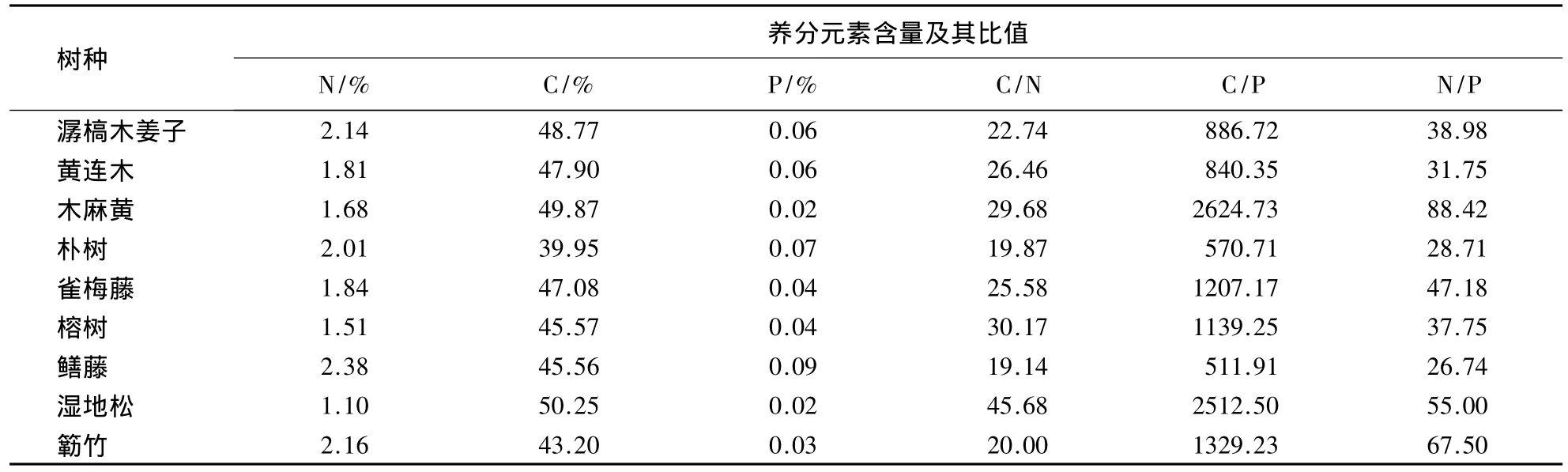
表4 各树种凋落物养分元素的初始含量Table 4 The initial content of litter nutrients of major dominant tree species
3.2.2 凋落物C、N、P含量及C/N、C/P、N/P与分解指数 k的相关性 将各树种凋落物初始C、N、P、C/N、C/P和N/P与相应Olson模型分解指数k进行相关分析(表5),结果表明,各树种N、P、C/N、C/P与分解指数有显著相关性(P<0.05),与C和N/P则没有显著相关性(P>0.05).对各树种凋落物初始C、N、P、C/N、C/P和N/P与相应Olson模型分解指数k进行回归分析(表5),结果表明,N、P、C/N、C/P与分解指数k拟合后可决系数较高(均大于0.5000);C和N/P与分解指数k拟合后可决系数较低(均小于0.5000).
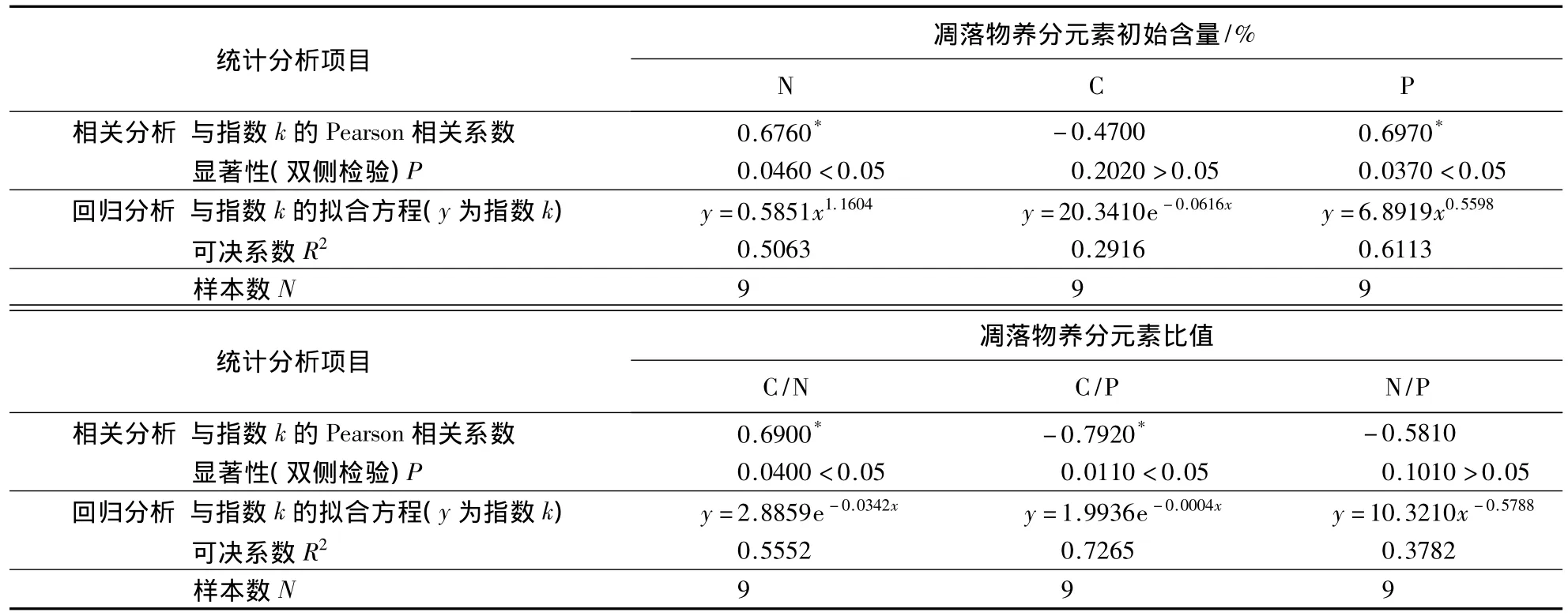
表5 凋落物初始养分含量与凋落物分解速率的关系1)Table 5 The relationship between litter initial nutrients content and litter decompose rates
4 结论与讨论
在小区域尺度上,凋落物的质量是影响凋落物分解速率的主要因素之一.凋落物的质量包括物理性质和化学性质.其中物理性质包括叶片厚薄、软硬、是否具蜡质、角质层或较厚的绒毛等[6].Pérez-Harguindeguy et al[15]对52种植物的研究表明,凋落叶分解速率与其抗张强度呈显著的负相关.凋落物的分解速率不能忽视凋落物本身物理性质的影响[15].凋落物化学性质对其分解的影响,主要取决于凋落物能否有效地为分解微生物群落提供能源和养分物质.包括凋落物的N、P、角质、木质素、纤维素含量等[2-3].凋落物在分解初期,微生物必须从外部获取N源以满足自身分解的需要,N素含量贫乏,凋落物分解较慢[16].近年来,随着N沉降的增加,N对凋落物分解的影响相对弱化,而P则成为更重要的限制因素,不少研究指出,凋落物的 C/P 比及 P 含量是影响凋落物分解的重要指标[2,8,17].此外,Koerselman et al[18]研究表明,植物N/P比也会对凋落物分解过程中的化学计量学过程产生影响,当植物N/P>16时,系统受到P的限制,当N/P<14时,系统受到N的限制,当N/P在14-16范围内,系统受到N、P的共同限制或者两种元素均不缺乏.
本研究中,9个树种的凋落物经过为期1年的分解后,潺槁木姜子等阔叶树种的凋落物干重剩余率较小,分解程度较大,而湿地松针叶树种和以小枝凋落物为主的木麻黄干重剩余率较大,分解程度较低.这是因为湿地松和木麻黄凋落物中初始N、P含量均较小,而C含量较高,C/N、C/P比较高,不能满足微生物群落的养分需求,微生物活性受到抑制,进而影响凋落物的分解效率.此外,湿地松和木麻黄的叶呈针状,与地表接触面积小,且叶质厚硬,叶表面酸不溶性物质及角质含量高,抑制真菌菌丝的入侵,进而影响凋落物的分解速率.本研究各树种凋落物初始N/P>16,根据Koerselman et al[18]的研究结论,P含量是9个优势种凋落物分解的主要限制因子,P含量越低,分解速率越慢.本研究中,木麻黄和湿地松的P含量最低,分解速率最慢,与前面的结论相一致.
研究表明,凋落物的分解过程具有明显的时间模式,整个周期会分成分解速率较快和较慢2个阶段[19-22].Garcia-Pausas et al[23]研究发现陆生森林凋落物会在第1年损失干质量30%-70%,随后的4-5年仅损失20%-30%,凋落物失重率与时间呈指数关系.在分解速率较快的初期阶段(即1-4月份),一方面,由于空气温湿度逐渐上升,刚经历冬眠的土壤动物开始活跃觅食,土壤微生物活性也大幅度上升,凋落物被土壤动物和土壤微生物大量分解;另一方面,分解初期的凋落物,水溶性物质和易分解的碳水化合物含量较高,易被降解淋溶.随着时间的推移,凋落物中半纤维素、纤维素和木质素等难分解物质的比重逐渐上升(占45%-51%),凋落物分解受到抑制,分解速率显著下降[24-26].本研究中,9个优势种凋落物的分解速率随着时间的推移,总体上也呈现先加快后下降的趋势,其中1月-4月份分解速率较快,5月-12月份分解速率相对平缓.
用Olson指数衰减模型对失重率实验结果进行拟合效果较好,根据模型可得凋落物分解95%所需时间为1.6-4.9年,与张德强等[27]对南亚热带季风区常见树种凋落物分解95%所需时间(2-8年)一致.有研究表明,我国暖温带常见树种凋落物分解95%所需时间为8-17年,说明温度因子无论对微生物的数量、酶活性,还是对凋落物的分解作用,均起着主导作用[5].
大量研究表明,在区域或全球尺度上,凋落物初始底物质量是影响分解速率的重要因素,分解初期的干重损失与凋落物N、P浓度及C/N、C/P等显著相关[26,28].本研究中,9个树种凋落物在1年的分解过程中凋落物分解指数k与初始N、P含量和C/N、C/P比显著相关(P<0.05).与C含量和N/P比相关性不显著(P >0.05).这与 Aerts[26]和 Berg et al[28]的研究结果一致.对凋落物的分解指数 k 与初始 C、N、P 含量和C/N、C/P、N/P进行回归分析也显示分解指数k与初始N、P含量和C/N、C/P的拟合效果较好.
[1]CHAPIN F S,MATSON P A,MOONEY H A.Principles of Terrestrial Ecosystem Ecology[M].New York:Springer-Verlag,2002.
[2]BERG B,MCCLAUGHERTY C.Plant Litter:Decomposition,Humus Formation,Carbon Sequestration[M].New York:Springer-Verlag,2003.
[3]BERTRAND I,CHABBERT B,KUREK B,et al.Can the biochemical features and histology of wheat residue explain their decomposition in soil?[J]Plant and Soil,2006,281(2):291-307.
[4]BEARE M H,PARMELEE R W,HENDRIX P F,et al.Microbial and faunal interactions and effects on litter nitrogen and on decomposition in agroecosystems[J].Ecological Monographs,1992,62(4):569-591.
[5]郭剑芬,杨玉盛,陈光水,等.森林凋落物分解研究进展[J].林业科学,2006,42(4):93-100.
[6]李志安,邹碧,丁永祯,等.森林凋落物分解重要影响因子及其研究进展[J].生态学杂志,2004,23(6):77-83.
[7]XULCU-TOLOSA F J,VESTER H F M,RAMYREZ-MARCIAL N,et al.Leaf litter decomposition of tree species in three successional phases of tropical dry secondary forest in Campeche,Mexico[J].Forest Ecology and Management,2003,174(2):401-412.
[8]XU X N,HIRATA E.Decomposition patterns of leaf litter of seven common species in a subtropical forest:N and P dynamics[J].Plant and Soil,2005,273(2):279-289.
[9]王瑾,黄建辉.暖温带地区主要树种叶片凋落物分解过程中主要元素释放的比较[J].植物生态学报,2001,25(3):375-380.
[10]赵月彩.万木林主要群落凋落物分解和养分释放研究[D].福建师范大学,2009.
[11]谭芳林.木麻黄防护林生态系统凋落物及养分释放研究[J].林业科学,2003(1):21-26.
[12]叶功富,张清海,卢昌义,等.滨海沙地木麻黄林生态系统的凋落物及其热值研究[J].应用与环境生物学报,2007,13(1):23-28.
[13]林宇.滨海沙地厚荚相思和木麻黄人工林凋落物碳归还规律[J].宁夏农林科技,2013,54(5):35-38.
[14]罗应华,孙冬婧,林建勇,等.马尾松人工林近自然化改造对植物自然更新及物种多样性的影响[J].生态学报,2013,33(19):6154-6162.
[15]PEREZ-HARGUINDEGUY N,DIAZ S,COMELISSEN J H C,et al.Chemistry and toughness predict leaf litter decomposition rates over a wide spectrum of functional types and taxa in central Argentina[J].Plant and Soil,2000,218(1):21-30.
[16]TAYLOR B R,PARSONS W F J,PEARKINSON D.Decomposition of Populus tremuloides leaf litter accelerated by addition of Alnus crispa litter[J].Canadian Journal of Forest Research,1989,19(6):674-679.
[17]VITOUSEK P M.Nutrient Cycling and Limitation:Hawaii as a Model System[M].Princeton:Princeton University Press,2004.
[18]KOERSELMAN W,MEULEMAN A F M.The vegetation N∶P ratio:a new tool to detect the nature of nutrient limitation[J].The Journal of Applied Ecology,1996,33(6):1441-1450.
[19]胡肄慧,陈灵芝,陈清朗,等.几种树木枯叶分解速率的试验研究[J].植物生态学与地植物学学报,1987,11(2):124-132.
[20]许新建,陈金耀,余新妥.武夷山六种杉木伴生树种落叶养分归还的研究[J].福建林学院学报,1995,15(3):213-217.
[21]EDMONDS R L,THOMAS T B.Decomposition and nutrient release from green needles of western hemlock and Pacific silver fir in an old-growth temperate rain forests,Olympic National Park Washington[J].Canadian Journal of Botany,1995,25(9):1049-1057.
[22]邱尔发,陈卓梅,郑郁善,等.麻竹山地笋用林凋落物发生、分解及养分归还动态[J].应用生态学报,2005,16(5):811-814.
[23]GARCIA-PAUSAS J,CASALS P,ROMANYA J.Litter decomposition and faunal activity in Mediterranean forest soils:effects of N content and the moss layer[J].Soil Biology and Biochemistry,2004,36(6):989-997.
[24]代静玉,秦淑平,周江敏.水杉凋落物分解过程中溶解性有机质的分组组成变化[J].生态环境,2004,13(2):207-210.
[25]TAYLOR B R,PARKINSON D,PARSONS W F J.Nitrogen and lignin content as predictor of litter decay rates:a microcosm test[J].Ecology,1989,70(1):97-104.
[26]AERTS R.Climate,leaf chemistry and leaf litter decomposition in terrestrial ecosystems:a triangular relationship[J].Oikos,1997,79(3):439-449.
[27]张德强,叶万辉,余清发,等.鼎湖山演替系列中代表性森林凋落物研究[J].生态学报,2000,20(6):938-944.
[28]BERG B.Litter decomposition and organic matter turnover in northern forest soils[J].Forest Ecology and Management,2000,133(1):13-22.
