HMBi对肉牛肉品质、血清生化指标和肌肉组织H-FABP基因mRNA表达水平的影响
2014-12-24奚雨萌林丽娟王建球韩兆玉
唐 波,王 群,奚雨萌,林丽娟,穆 甜,王建球,韩兆玉
(1.南京农业大学动物科技学院,江苏南京210095;2.连云港亨得利畜牧养殖有限公司,江苏连云港222300)
随着人民生活水平的提高,消费者对牛肉品质的要求越来越高.影响牛肉品质的关键因素是肌内脂肪含量,表现为大理石花纹的含量及分布.肌内脂肪含量影响着肉质的嫩度、风味和多汁性;在世界各国,肌内脂肪含量也是划分牛肉等级的重要指标.在分子生物学飞速发展的今天,越来越多的研究表明,心脏型脂肪酸结合蛋白(heart fat acid binding protein,H-FABP)基因对肌内脂肪含量的影响显著[1-2],在调控肌内脂肪沉积方面发挥着重要作用.
蛋氨酸是肉牛生长的第一限制性氨基酸[3].研究表明,添加瘤胃保护性蛋氨酸或蛋氨酸羟基类似物(HMB)可以促进肉牛生长,增加肉牛氮沉积[4-6].2-羟基-4-甲硫基-丁酸异丙醇酯[2-hydroxy-4-(methylthio)butanoic acid isopropyl ester,HMBi]是一种蛋氨酸添加剂,在反刍动物体内先被瘤胃壁吸收,之后分解为蛋氨酸羟基类似物,然后经转氨基反应生成蛋氨酸[7].目前,HMBi在反刍动物上的研究主要集中于奶牛上[8-9],在肉牛上的应用则尚未见报道.有研究表明,HMBi能够提高奶牛的乳脂率[10-11],由此提示HMBi可能与机体脂肪的沉积和利用有关,但其具体的作用机理目前尚不清楚,因此有必要进行进一步研究.本试验在肉牛的日粮精料中添加HMBi,研究其对肉牛胴体品质、血液生化指标、肌内脂肪含量以及H-FABP基因mRNA表达量的影响,探讨HMBi对肉牛脂肪沉积的作用效果和作用机理,旨在为HMBi在肉牛生产中的应用提供理论依据.
1 材料与方法
1.1 肉牛分组
选取16头平均年龄4-5岁、体重相近的徐州黄牛进行配对,随机分为试验组和对照组,每组8头.供试牛由江苏连云港亨得利肉牛场提供.
1.2 肉牛饲养管理
供试16头牛全部舍饲散养,饲喂精料和粗饲料.基础精料配方及营养水平见表1.试验组分别在每头肉牛的精料中添加8 g·d-1HMBi,对照组的精料不添加HMBi;试验组和对照组牛饲喂的粗饲料相同.试验开始的前1周为预饲期,预饲期结束后开始试验,周期2个月.试验期每天于上午8:00和下午16:00饲喂日粮,牛自由采食和饮水.供试HMBi的商品名为美斯特(Metasmart),含HMBi≥57%,由安迪苏生命科学制品(上海)有限公司提供.

表1 基础精料配方及营养水平(风干基础)Table 1 Ingredient and expected nutrient composition of basis diets(air-dry basis)
1.3 肉牛屠宰与采样
试验结束后,肉牛运送至安徽瀚森荷金来肉牛集团有限公司,禁食、充分休息后统一屠宰.每头牛经宰杀、放血,去头、蹄、内脏,剥皮,劈半,冲洗后测定各项指标.
屠宰后现场采集肉牛右半胴体的臀中肌和背最长肌(8-12胸椎),取200 g左右于-20℃冷冻保存,用于测定肌内脂肪(即粗脂肪)含量;另取一部分样品放在冻存管中,于-80℃液氮中保存用于测定总RNA含量.
1.4 肉牛胴体品质的测定
屠宰后的胴体在标准排酸车间吊挂排酸4 d后统一进行分割.排酸结束后,测定右半胴体12肋骨处背最长肌的肌肉色、脂肪色和大理石花纹等级等指标;同时,采集右半胴体12肋骨处背最长肌和臀中肌各500 g,用于测定剪切力和蒸煮损失.
1.4.1 肌肉色和脂肪色 采用便携式色差仪测定.屠宰后的胴体经吊挂冷却排酸后分割取样,每个样品切取一新鲜面,放置30 min后用便携式色差仪测定色泽,设置3个平行,取平均值.
1.4.2 大理石花纹等级 参照美国牛肉分级标准,以标准板为依据,分为丰富、适量、适中、少、较少、微量和几乎没有7个级别,分别记为7-1分.
1.4.3 剪切力 将肉块切成2 cm左右的厚度,放入80℃水浴中加热30 min后取出,在空气中冷却至室温.用直径为1.27 cm的圆柱形取样器避开结缔组织,顺着肌纤维方向取下肉样5个,采用C-LM3B型数显式肌肉嫩度仪(品牌:TENOVL)测定剪切力,每个样品重复2次.
1.4.4 蒸煮损失 将肉样切成3 cm×3 cm×1.5 cm左右大小的肉块,制样时应避开结缔组织,称重后装袋.将肉块放入80℃水浴中加热30 min后取出,在空气中冷却至室温.用吸水纸吸干表面水分后称重.蒸煮损失/%=(加热前肉重-加热后肉重)/加热前肉重×100.
1.5 肉牛血清生化指标的测定
试验开始前和结束后,肉牛于晨饲前由颈静脉抽血约10 mL,放置至析出血清后,于3000 r·min-1离心10 min,收集血清于小离心管,于-20℃冷冻保存.
血清测定指标包括葡萄糖、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆固醇、尿素氮的浓度以及脂肪酶活性,均由南京军区总医院全自动生化分析仪测定.
1.6 肉牛肌内脂肪含量的测定
采用索氏抽提法测定.称取2 g左右肉样用定量滤纸包好,称重后放入索氏抽提器中,以乙醚为抽提剂,于75℃水浴条件下抽提12 h后取出滤纸包,烘干后在干燥器中冷却至常温,称重.
肌内脂肪含量/%=(抽提前纸包重-抽提后纸包重)/肉样重×100.
1.7 肉牛肌肉组织H-FABP基因mRNA表达水平的测定
1.7.1 引物设计 根据NCBI登录号AC_000159的H-FABP设计引物F:5-'GTG CGG GAA ATG GTT GA -3',R:5'-AGC CCA CTG GCA GAA GA -3',产物长度129 bp,退火温度56 ℃;F:5-'TCC AGC CTT CCT TCC TGG GCA T -3',R:5'-GGA CAG CAC CGT GTT GGC GTA GA -3',产物长度116 bp,退火温度59℃.引物由北京鼎国昌盛生物技术有限公司合成.
1.7.2 组织总RNA的提取、反转录 用Total RNA KitⅠ试剂盒(Omega公司)提取肌肉组织总RNA.用二乙基焦磷酸酰胺(DEPC)溶解RNA,紫外分光光度计测定总RNA的浓度和纯度(D260nm/D280nm=1.8-2.0),2%琼脂糖凝胶电泳检测总RNA的质量.用随机引物对总RNA进行反转录,反应体系25 μL,含2 μg 总 RNA、1 μg 随机引物、200 U MMLV 反转录酶、20 U Rnasin 抑制剂、5 μL 5 ×RT Buffer[含250 mmol·L-1Tris-HCl(pH 8.3)、50 mmol·L-1MgCl2、250 mmol·L-1KCl、50 mmol·L-1DTT、2.5 mmol·L-1Spermidine]、0.4 mmol·L-1dNTP.反应程序:50℃延伸1 h,而后于70℃变性10 min,迅速在冰上冷却得反转录产物.反转录产物储存在-20℃.
1.7.3 H-FABP基因mRNA表达水平的测定 H-FABP mRNA表达水平采用实时荧光定量仪(7300 Real Time PCR 仪器)评估.总反应体系 20 μL:10 μL SYBR Premix Ex Taq、10 pmol·L-1上下游引物各 0.4 μL,2 μL cDNA、0.4 μL ROX Reference Dye、6.8 μL ddH2O.反应条件如下:95 ℃预变性 30 s;PCR 循环,变性95℃ 5 s,延伸60℃ 31 s,共40个循环;然后72℃延伸7 min.反应结束后进行融解曲线分析.
1.8 数据分析
数据由Excel软件初步处理后用SPSS 18.0软件进行显著性统计分析,采用独立性t检验,结果以平均值±标准差表示.
2 结果与分析
2.1 HMBi对肉牛胴体品质的影响
色泽是肉品质的重要指标之一.其中,L*值表示亮度,数值越小表明肉的颜色越暗;a*值是颜色空间中指示绿色色调向红色色调的过渡,其值越小表明色调范围越偏向绿色色调;而b*值越小表明含有越多的蓝色成分而偏蓝色色调.由表2可知:试验组肉牛肌肉色的L*、a*值略低于对照组,而b*值略高于对照组,但差异均不显著(P>0.05);脂肪色的结果与肌肉色相同,均是试验组的L*、a*值略低于对照组,而b*值略高于对照组(P>0.05).在大理石花纹等级方面,试验组肉牛高于对照组(P=0.153).在剪切力和蒸煮损失方面,试验组肉牛背最长肌的剪切力小于对照组(P>0.05),而蒸煮损失则大于对照组(P>0.05);试验组臀中肌的剪切力和蒸煮损失则变化不明显(P>0.05).可见,添加HMBi有提高肉牛大理石花纹等级的趋势,对剪切力、肌肉色、脂肪色和蒸煮损失无明显影响.
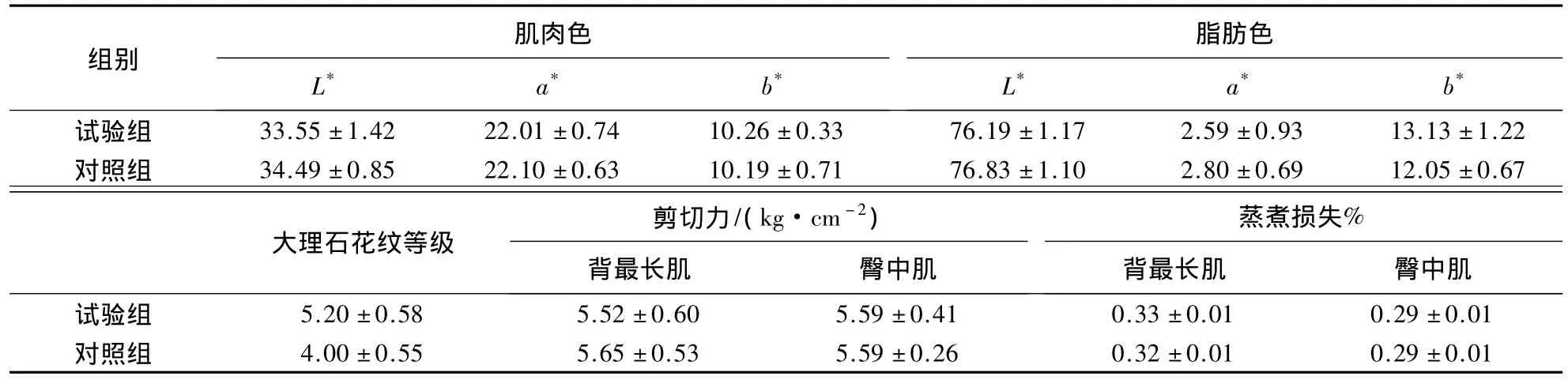
表2 HMBi对肉牛胴体品质的影响1)Table 2 Effects of HMBi on carcass quality of beef cattle
2.2 HMBi对肉牛血清生化指标的影响
由表3可知:试验组和对照组肉牛的尿素氮浓度在试验后均比试验前发生了极显著的下降,试验组尿素氮浓度在试验前高于对照组(P>0.05),但在试验后低于对照组(P>0.05),表明HMBi对日粮氮的利用效率无显著影响;试验组的葡萄糖浓度在试验前和试验后均高于对照组(P>0.05);试验组的总胆固醇浓度在试验后呈下降趋势,但差异不显著(P>0.05);在甘油三酯浓度方面,在试验前,试验组与对照组的差异不显著(P>0.05),但试验后极显著低于对照组(P<0.01),表明HMBi能显著降低胆固醇浓度;试验组的高密度脂蛋白胆固醇浓度在试验前略低于对照组(P>0.05),而试验后却略高于对照组(P>0.05);在低密度脂蛋白胆固醇浓度方面,试验后较试验前试验组和对照组均有下降趋势,但差异不显著(P>0.05);试验组脂肪酶活性在试验前略高于对照组(P>0.05),在试验后低于对照组(P>0.05).可见,HMBi可以降低肉牛血清甘油三酯水平.

表3 HMBi对肉牛血清生化指标的影响1)Table 3 Effects of HMBi on serum biochemical indices of cattle
2.3 HMBi对肉牛肌内脂肪含量的影响
由表4可知,试验组肉牛背最长肌和臀中肌的肌内脂肪含量均高于对照组,但差异均不显著(P >0.05).
2.4 HMBi对肉牛肌肉组织 H-FABP基因mRNA表达水平的影响
由表5可知,试验组肉牛背最长肌和臀中肌肌肉组织H-FABP基因mRNA的表达量均高于对照组,但差异均不显著(P >0.05).可见,HMBi对肉牛肌肉组织H-FABP基因mRNA的表达水平无显著影响.

表4 肉牛肌肉不同部位的肌内脂肪含量1)Table 4 Intramuscular fat content changes in muscles of different parts of beef cattle %

表5 肉牛肌肉组织H-FABP基因mRNA的表达量1)Table 5 Changes of muscle H-FABP mRNA expression in beef cattle
3 讨论
3.1 HMBi对肉牛胴体品质的影响
肉色是肉质外观评定的重要指标,也是消费者对肉质进行评价的主要依据,直接影响消费者的购买欲[12].肉色主要取决于肌肉中的色素物质,如果放血充分,则肌红蛋白的含量及其化学状态是肉色的主要决定因素[13].牛脂肪的颜色主要与其年龄、性别、品种和饲养条件有关[14].研究表明,饲料中的营养配方能显著影响肉牛脂肪的颜色[15].本试验中,试验组肉牛背最长肌、臀中肌的肌肉色和脂肪色均与对照组的差异不明显,表明在日粮中添加HMBi对牛肉肌肉色和脂肪色的影响不明显,不会对消费者的购买欲产生负面影响.肌内脂肪含量是影响牛肉品质的关键因素,当肌内脂肪沉积到一定数量时即形成大理石花纹[16].本试验中,与对照组相比,试验组肉牛背最长肌的大理石花纹等级有提高的趋势,但没有达到显著水平.剪切力是反映肉质嫩度的重要指标,研究表明,随着大理石花纹等级的提高,牛肉嫩度显著上升[17-18].本试验中,试验组肉牛背最长肌的剪切力低于对照组,与文献[17-18]的研究结果基本一致.在蒸煮损失方面,试验组与对照组的差异不明显,表明日粮中添加HMBi对肉牛牛肉蒸煮损失无影响.
3.2 HMBi对肉牛血清生化指标的影响
尿素氮浓度的高低可以作为动物体内蛋白质代谢和日粮氨基酸平衡状况较为准确的反映指标,其浓度与其体内氮沉积呈密切相关性[19].本试验中,在日粮中添加HMBi对肉牛血清尿素氮浓度的影响不明显.McCollum et al[6]在绵羊日粮中添加液体蛋氨酸羟基类似物,发现绵羊对氮的吸收能力增强;Oke et al[20]在绵羊日粮中添加过瘤胃蛋氨酸,随着添加水平的提高,绵羊机体的氮沉积水平提高,此结果与本试验的结果有所不同,可能是添加量的差异所致.本试验中,试验组肉牛血清葡萄糖浓度在试验前后均略高于对照组,但差异不显著,表明在日粮中添加HMBi对肉牛机体的糖代谢影响不明显,这与郗伟斌等[21]的“在干奶期奶牛日粮中添加HMBi对奶牛的血糖浓度影响较小”的试验结果相一致.本试验中,试验组肉牛总胆固醇浓度在试验后略有降低,但甘油三酯浓度在试验后却显著低于对照组.甘油三酯是脂肪代谢的产物,是反映脂肪消化吸收状态的直接指标,其值越高,表明机体脂肪的利用率低[22].本试验结果表明,在日粮中添加HMBi有利于肉牛机体脂肪的沉积作用.肌内脂肪与大理石花纹的形成密切相关,当肌内脂肪沉积达到一定比例且分布均匀时才能形成大理石花纹,这也正好解释了试验组肉牛背最长肌大理石花纹的等级高于对照组的原因.本试验中,高密度脂蛋白胆固醇、低密度脂蛋白胆固醇浓度和脂肪酶活性在试验前后均无明显变化,表明在日粮中添加HMBi对其影响不明显,其原因有待进一步研究.
3.3 HMBi对肉牛肌内脂肪含量的影响
本试验中,试验组肉牛背最长肌和臀中肌的肌内脂肪含量高于对照组,表明在日粮中添加HMBi对肉牛机体肌内脂肪的形成有促进作用.一般认为,机体皮下脂肪的形成速率高于肌内脂肪[23].从本试验结果可以看出,HMBi降低了试验组肉牛血清甘油三酯的浓度,促进了肉牛机体的脂肪沉积,在此基础上,为肉牛肌内脂肪的形成提供了条件,进而促进了大理石花纹的形成.有关HMBi影响肉牛肌内脂肪形成的研究报道较少,对其在肉牛上促进脂肪沉积的作用仍有待更多的试验数据证明.
3.4 HMBi对肉牛肌肉组织H-FABP基因mRNA表达水平的影响
FABP基因家族参与细胞中脂肪酸的摄取,协助将脂肪酸转运到进行β-氧化的场所以及甘油三脂和磷脂合成的部位[24],对机体脂质代谢具有重要的调节作用.H-FABP基因广泛分布于机体各组织中,在肌肉组织中的浓度与组织中脂肪酸的代谢强度密切相关[25].国内外较多的研究表明,H-FABP基因与肌内脂肪含量有显著关系[26-27].Gerbens et al[2]研究表明,H-FABP基因mRNA的表达水平与肌内脂肪含量呈明显的相关性.郝称莉等[28]研究表明,H-FABP基因的表达量与湖羊肌肉组织肌内脂肪含量呈正相关.本试验中,试验组肉牛背最长肌和臀中肌肌肉组织H-FABP基因mRNA的表达量与对照组间无显著差异,表明在日粮中添加HMBi对肉牛肌肉组织H-FABP基因mRNA的表达水平无明显作用,这与文献[2,28]的研究结果不一致.目前对肉牛肌肉组织H-FABP基因的研究报道较少,需要更多的试验数据来支持和表明其对肌内脂肪的作用.
4 结论
在日粮中添加8 g·d-1HMBi有提高肉牛大理石花纹等级的趋势,对肌肉色、脂肪色、剪切力和蒸煮损失无明显影响;可以极显著降低血清甘油三酯浓度;对背最长肌和臀中肌肌肉组织中的脂肪含量和H-FABP基因mRNA的表达量无显著影响.
[1]仇雪梅,李宁,吴常信,等.影响动物肉质性状主要候选基因的研究进展[J].遗传,2002,24(5):571-574.
[2]GERBENS F,VERBURG F J,VAN MOERKERK H T,et al.Associations of heart and adipocyte fatty acid-binding protein gene expression with intramuscular fat content in pigs[J].Animal Science,2001,79(4):347 -354.
[3]WILKERSON V A,KLOPFENSTEIN T J,BRITTON R A,et al.Metabolizable protein and amino acid requirements in growing cattle[J].Animal Science,1993,71(10):2777 -2784.
[4]ARCHIBEQUE S L,BURNS J C,HUNTINGTON G B.Nitrogen metabolism of beef steers fed endophyte-free tall fescue hay:effects of ruminally protected methionine supplementation[J].Animal Science,2002,80(5):1344 -1351.
[5]CAMPBELL C G,TITGEMEYER E C,JEAN G S.Efficiency of D-vs L-methionine utilization by growing steers[J].Journal of Animal Science,1996,74(10):2482 -2487.
[6]MCCOLLUM M Q,VASQUEZ-ANON M,DIBNER J J,et al.Absorption of 2-hydroxy-4-(methylthio)butanoic acid by isolated sheep ruminal and omasal epithelia[J].Animal Science,2000,78(4):1978 -1083.
[7]GRAULET B,RICHARD C,ROBERT J C.The isopropyl ester of methionine hydroxy analogue is absorbed through the rumen wall of the cow[J].Animal Feed Science,2004,13(Suppl 1):269 -272.
[8]PIEPENBRINK M S,MARR A L,WALDRON M R,et al.Feeding 2-hydroxy-4-(methylthio)-butanoic acid to periparturient dairy cows improves milk production but not hepatic metabolism[J].Dairy Science,2004,87(4):1971 -1084.
[9]LUNDQUIST R G,LINN J G,OTTERBY D E.Influence of dietary energy and protein on yield and composition of milk from cows fed methionine hydroxy analog[J].Dairy Science,1983,66(3):475 -491.
[10]WANG C,LIU H Y,WANG Y M,et al.Effects of dietary supplementation of methionine and lysine on milk production and nitrogen utilization in dairy cows[J].Dairy Science,2010,93(8):366 -370.
[11]ST-PIERRE N R,SYLVESTER J T.Effects of 2 hydroxy-4(methylthio)butanoic acid(HMB)and its isopropyl ester on milk production and composition by Holstein cows[J].Journal of Dairy Science,2005,88(7):2487 -2497.
[12]LIU Q,LANARI M C,SCHAEFER D M.A review of dietary vitamin E supplementation for improvement of beef quality[J].Journal of Animal Science,1995,73(10):3131 -3140.
[13]RENERRE M.Review:Factors involved in the discoloration of beef meat[J].International Journal of Food Science and Technology,1990,25(6):613 -630.
[14]DUNNE P G,MONAHAN F J,O'MARA F P,et al.Color of bovine subcutaneous adipose tissue:A review of contributory factors,associations with carcass and meat quality and its potential utility in authentication of dietary history[J].Meat Science,2009,81(1):28 -45.
[15]KNIGHT T W,DEATH A F,LAMBERT M G,et al.The rate of reduction in carotenoid concentration in fat of steers fed a low carotenoid ration,and the role of increasing carcass fatness[J].Australian Journal of Agricultural Research,2001,52(10):1023-1032.
[16]万发春,张幸开,张丽萍,等.牛肉品质评定的主要指标[J].中国畜牧兽医,2004,31(12):17-19.
[17]MOON S S,YANG H S,PARK G B,et al.The relationship of physiological maturity and marbling judged according to Korean grading system to meat quality traits of Hanwoo beef females[J].Meat Science,2006,74(3):516 -521.
[18]KIM C J,LEE E S.Effects of quality grade on the chemical,physical and sensory characteristics of Hanwoo(Korean native cattle)beef[J].Meat Science,2003,63(3):397 -405.
[19]严昌国,金泽林,金太花,等.外源生长激素在延边黄牛上的试验研究(Ⅲ)——对血液生理生化指标的影响[J].中国畜牧杂志,2005,41(3):6 -9.
[20]OKE B O,LOERCH S C,DEETZ L E.Effects of rumen-protected methionine and lysine on ruminant performance and nutrient metabolism[J].Journal of Animal Science,1986,62(4):1101 -1112.
[21]郗伟斌,夏科,张永根,等,补充2-羟基-4-甲硫基-丁酸异丙酯对奶牛生产性能及血液生化指标的影响[J].动物营养学报,2010,22(2):372 -379.
[22]KNOWLES T A,SOUTHERN L L,BIDNER T D,et al.Effect of dietary fiber or fat in low-crude protein,crystalline amino acid-supplemented diets for finishing pigs[J].Journal of Animal Science,1998,76(11):2818 -2832.
[23]周岩伟.促脂肪沉积剂对育肥牛的生产性能和肉品质影响的研究[D].乌鲁木齐:新疆农业大学,2006.
[24]VEERKAMP J H,MAATMAN R G H J.Cytoplasmic fatty acid binding proteins:their structure and genes[J].Progress in Lipid Research,1995,34(1):17 -52.
[25]HAUNERLAND N H.Fatty acid binding proteins in locust and mammalian muscle.Comparison of structure,function,and regulation[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1994,109(2 -3):199 -208.
[26]GERBENS F,HARDERS F L,GROENEN M A,et al.A dimorphic microsatellite in the porcine H-FABP gene at chromosome 6[J].Animal Genetics,1998,29:398 -413.
[27]梅书棋,彭先文,李勇,等.心脏型脂肪酸结合蛋白基因多态性在湖北白猪中的初步研究[J].华中农业大学学报,2004,23(2):227 -229.
[28]郝称莉,李齐发,乔永,等.湖羊肌肉组织H-FABP和PPARγ基因表达水平与肌内脂肪含量的相关研究[J].中国农业科学,2008,41(11):3776 -3783.
