黄芪超微粉对三黄鸡小肠绒毛形态结构、肠内容物消化酶活性和盲肠菌群的影响
2014-12-24邓必贤邓文琼马玉芳黄一帆
邓必贤,邓文琼,李 健,马玉芳,黄一帆
(福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建福州350002)
小肠是动物机体营养吸收的主要场所,动物机体的生长发育与肠道健康状态息息相关,生长发育良好的畜禽其肠道绒毛发育良好,隐窝深度浅,消化酶活性高,肠道有益菌数量多[1-3].黄芪是豆科植物蒙古黄芪[Astragalus memberanaceus(Fisch)Bge.var.mongholicus(Beg.)Hsiao]或膜夹黄芪[A.membranaceus(Fisch.)Bunge]的干燥根,为兽医临床最常用的中药之一.传统中兽医理论认为,黄芪能够补益正气,升举脾阳,维持脾气健运,促进动物对水谷精微的吸收[4].肉鸡的消化道较短,对中药有效成分的吸收不够充分,这使得包括黄芪在内的各种中药在肉鸡养殖中的应用受到限制.超微粉能有效解决这一瓶颈,超微粉是指将颗粒粉碎至微米甚至纳米级的粉末,已有研究表明,粉碎后的植物细胞壁被破坏,溶出度增加[5-6],生物利用度提高[7-8].因此,将黄芪制成超微粉增强其在动物机体内的吸收具有重要意义.本试验在与生产性能相符的基础上,从三黄鸡小肠绒毛形态结构、十二指肠内容物消化酶活性和盲肠菌群入手,研究黄芪超微粉对三黄鸡肠道消化吸收的影响,旨在为与饲料的配合应用提供科学依据.
1 材料与方法
1.1 材料
三黄鸡由莆田广东温氏家禽有限公司提供.黄芪为植物蒙古黄芪干燥根,购自福州宜又佳大药房,由南京龙立天目超微粉体技术有限公司加工,经南京化工大学检测粒度为14.74 μm;粗粉自行加工,过40目筛.饲料采用玉米—豆粕型饲粮,基础日粮组成及营养成分见表1.
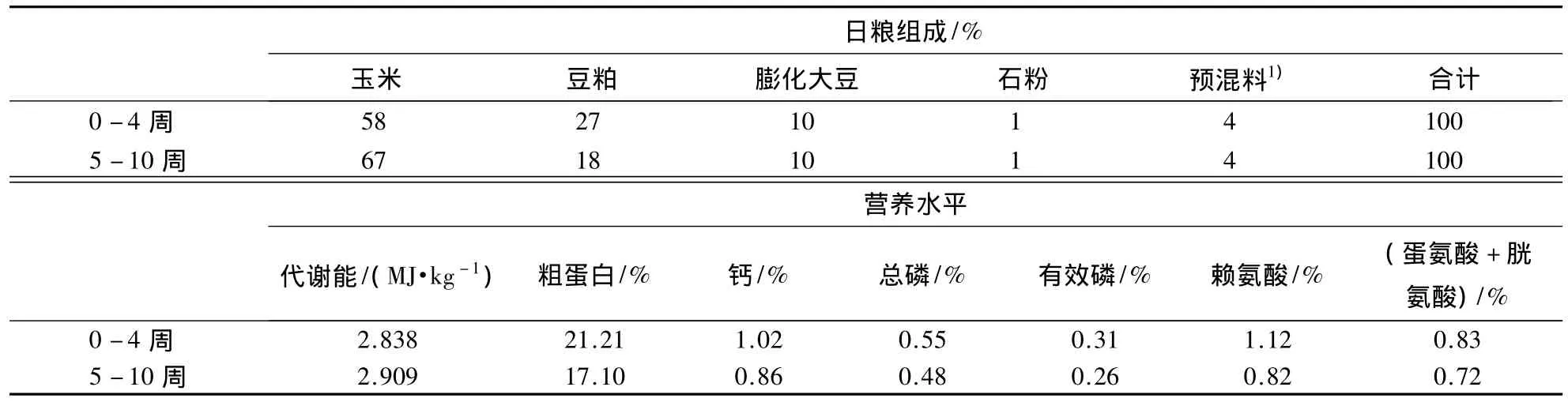
表1 基础日粮组成及营养成分Table 1 Ingredients and composition of the base diets
仪器有TU-1810PC紫外可见分光光度计(北京普析通用仪器有限责任公司)、AllegraTM X-22R-Centrifuge冷冻离心机(美国Beckman Coulter公司)、Centrifuge 5418离心机(德国Eppendorf公司)、SHP-350生化培养箱(上海精宏实验设备有限公司)、Motic Digital-LabⅡ拍照系统和2T-12N生物组织脱水机(湖北孝感亚光医用电子技术有限公司).
试剂:4%多聚甲醛自行配制,麦康凯培养基和MRS培养基均购自广东环凯微生物科技有限公司,淀粉酶试剂盒、脂肪酶试剂盒和胰蛋白酶试剂盒均购自南京建成生物工程研究所.
1.2 试验设计与分组
225羽1日龄三黄公雏按照体重相近的原则,随机分为5个处理组,每处理组3个重复,每重复15羽.试验Ⅰ组为对照组,饲喂基础日粮;试验Ⅱ、Ⅲ和Ⅳ组为黄芪超微粉组,分别在基础日粮中添加0.50%、0.75%和1.00%黄芪超微粉;试验Ⅴ组为黄芪粗粉组,在基础日粮中添加1.00%黄芪粗粉.试验期70 d,分为两个阶段,1-28 d为第1阶段,29-70 d为第2阶段.
1.3 饲养管理
采用封闭式悬空笼子饲养,进鸡苗之前,所有笼子和鸡舍进行全方位的打扫、清理和消毒.2周以上的无雏间歇期,采用红外灯保温,试验开始时,第1周室内温度保持在35℃左右,以后每周降低2-3℃,达到室温后恒温.所有鸡只自由采食,饮水,按肉鸡常规管理及正常程序免疫.
1.4 指标测定
1.4.1 小肠绒毛形态结构 试验第28和70天时,各处理组每个重复随机抽取体质健康、体重中等的3只肉鸡进行屠宰解剖,剪取十二指肠、空肠和回肠中段约2 cm长.肠段用生理盐水清洗干净后,吸水纸吸干肠道水分,放入4%多聚甲醛固定24 h,之后流水冲洗24 h,样品进行脱水、透明、浸蜡、石蜡包埋、修片、连续切片、HE染色后,烘干过夜,树胶封固.每个样本选取2张绒毛伸展情况良好的组织切片,每张切片选取3根绒毛,通过软件检测绒毛长度和隐窝深度,取平均值,并计算绒毛长度与隐窝深度的比值(绒毛长度/隐窝深度).
1.4.2 十二指肠内容物消化酶活性 试验第28和70天时,各处理组每个重复随机抽取肉鸡3只进行屠宰解剖,迅速采集新鲜十二指肠内容物,按不同比例稀释,在冰水浴条件下机械匀浆,于4℃、2500 r·min-1离心10 min,取上清液,检测内容物淀粉酶、脂肪酶和胰蛋白酶的活性,按照试剂盒操作要求检测.
1.4.3 盲肠菌群 试验第28和70天时,各处理组每个重复随机抽取肉鸡3只进行屠宰解剖,剪取两段盲肠,装入无菌自封袋,于无菌超净台中操作.测定方法:无菌称取1 g食糜,盛入带有小玻璃珠的瓶子,加入99 mL无菌生理盐水(10-2倍),混匀.吸取1 mL菌液至下一灭菌试管中,加入9 mL无菌生理盐水逐级10 倍稀释,取 10-3、10-4和 10-5用于大肠杆菌接种平板,接种量为 100 μL;取 10-5、10-6和 10-7用于乳酸杆菌接种平板,接种量为100 μL.接种后的培养皿用灭菌弯曲玻璃棒小心摊匀,每个样品3个平行,接种完后倒置放置,全程均为无菌操作[9].
大肠杆菌培养皿在37℃人工培养箱中培养24 h后选取粉红色或红色,表面光滑、突起,边缘整齐不透明,质地软、粘,直径1.0-3.0 mm的菌落进行计数;乳酸杆菌培养皿在干燥厌氧玻璃器中,置37℃人工气候箱中培养48 h,如无结果时间可延长至72 h,选取乳白色,稍偏黄,表面光滑、凸起,边缘整齐不透明,质地软,直径0.6-2.7 mm的菌落进行计数.每克盲肠内容物菌落数=lg(菌落数×稀释倍数×每次稀释取样毫升数)/(接种用样品毫升数×样品克数).
1.5 数据分析
采用SPSS 13.0统计软件的单因素方差分析,并用LSD法进行多重比较,结果用平均数±标准差表示.
2 结果与分析
2.1 三黄鸡肠道绒毛形态结构的变化
黄芪超微粉对三黄鸡肠道绒毛形态结构的影响见表2.由表2可知:试验第28天时,各处理组间绒毛长度和隐窝深度的差异不显著(P>0.05);与Ⅰ组相比,Ⅱ和Ⅲ组十二指肠绒毛长度/隐窝深度分别提高8.56%(P <0.05)和 8.39%(P <0.05),各处理组空肠和回肠绒毛长度/隐窝深度的差异不显著(P >0.05).试验第70天时,与Ⅰ组相比,Ⅲ组十二指肠绒毛长度提高14.11%(P<0.05),Ⅱ和Ⅲ组十二指肠绒毛长度/隐窝深度分别提高12.38%(P <0.05)和25.53%(P <0.01);Ⅱ组回肠绒毛长度/隐窝深度较Ⅰ和Ⅴ组分别提高 10.91%(P <0.05)和12.73%(P <0.05).
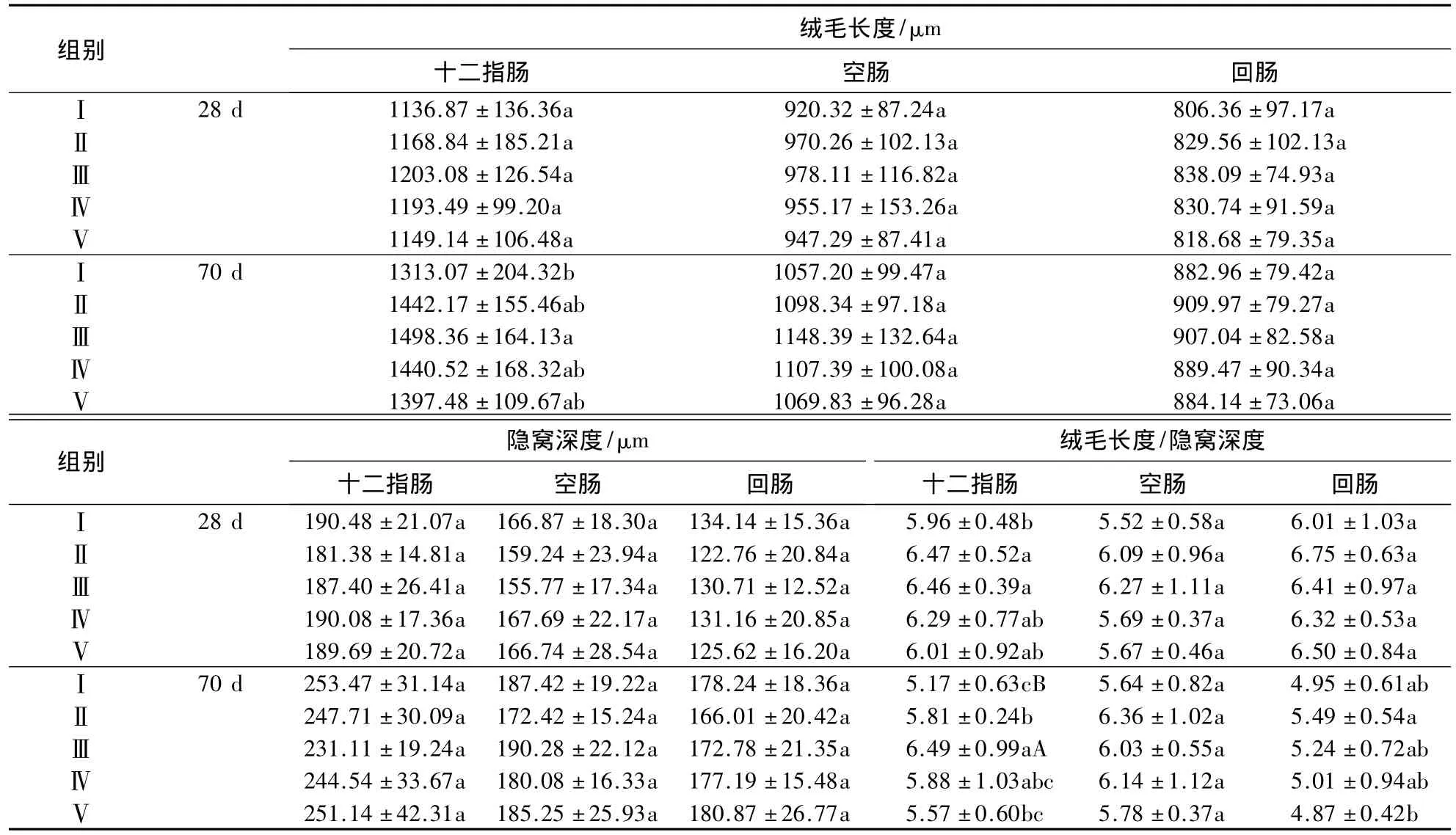
表2 黄芪超微粉对三黄鸡肠道绒毛形态结构的影响1)Table 2 Effects of Astragalus ultramicro powder on the morphological structure of intestinal villi in three yellow broilers
从图1可以看出:试验第70天时,Ⅱ、Ⅲ和Ⅳ组十二指肠绒毛长度与Ⅰ和Ⅴ组相比,绒毛较细长、浓密、整齐.
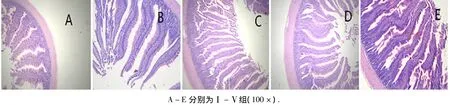
图1 试验第70天时十二指肠绒毛组织切片Fig.1 Tissue section of different treatments in duodenum villus on 70th day
2.2 三黄鸡十二指肠内容物消化酶活性的变化
黄芪超微粉对三黄鸡十二指肠内容物消化酶活性的影响见表3.由表3可知,试验第28天时,黄芪超微粉组淀粉酶的活性都有升高的趋势.其中,Ⅲ组淀粉酶活性较Ⅰ和Ⅴ组分别提高9.59%(P<0.05)和8.01%(P<0.05);Ⅲ组脂肪酶活性较Ⅰ组提高10.65%(P<0.05);Ⅱ组胰蛋白酶活性较Ⅰ和Ⅴ组分别提高 27.03%(P <0.01)和14.91%(P <0.05).试验第 70 天时,与Ⅰ组相比,Ⅲ组淀粉酶活性提高 13.86%(P <0.05);Ⅱ和Ⅲ组脂肪酶活性分别提高 11.81%(P <0.05)和12.76%(P <0.05);Ⅱ组胰蛋白酶活性提高 9.18%(P <0.05).
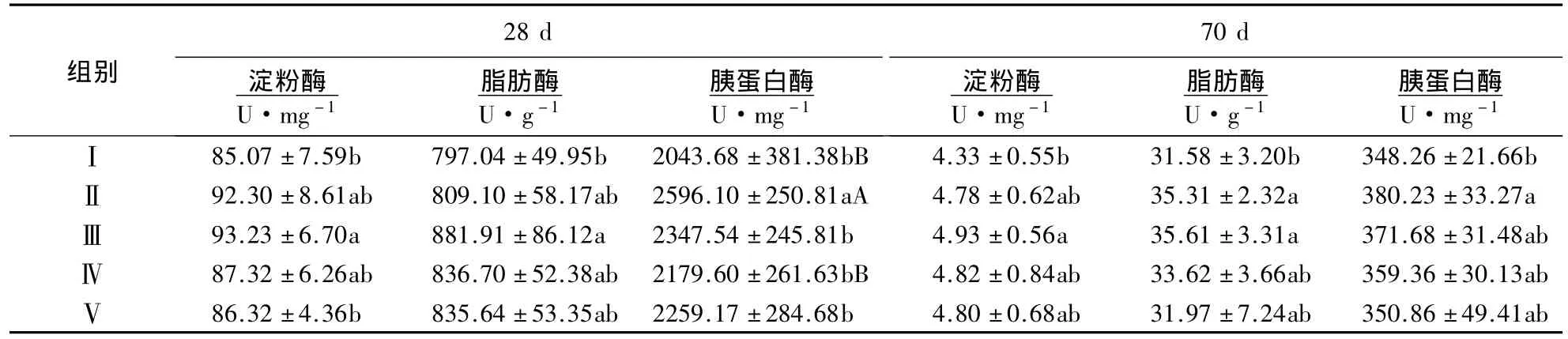
表3 黄芪超微粉对三黄鸡十二指肠消化酶活性的影响1)Table 3 Effects of Astragalus ultramicro powder on the duodenal digestive enzyme activity in broilers
2.3 三黄鸡盲肠菌群的变化
黄芪超微粉对三黄鸡盲肠菌群的影响见表4.由表4可知:试验第28天时,与Ⅰ组相比,Ⅱ、Ⅲ和Ⅳ组大肠杆菌数量分别降低1.06%(P >0.05)、4.10%(P <0.05)和0.66%(P >0.05),乳酸杆菌数量分别增加4.14%(P >0.05)、8.65%(P <0.05)和4.75%(P >0.05),与Ⅴ组的差异不显著(P >0.05);试验第 70 天时,与Ⅰ组相比,Ⅱ、Ⅲ和Ⅳ组大肠杆菌数量分别降低 6.89%(P >0.05)、9.18%(P <0.05)和 4.32%(P >0.05),乳酸杆菌数量分别增加 4.20%(P >0.05)、6.71%(P <0.05)和 3.36%(P >0.05),与Ⅴ组的差异不显著(P >0.05).
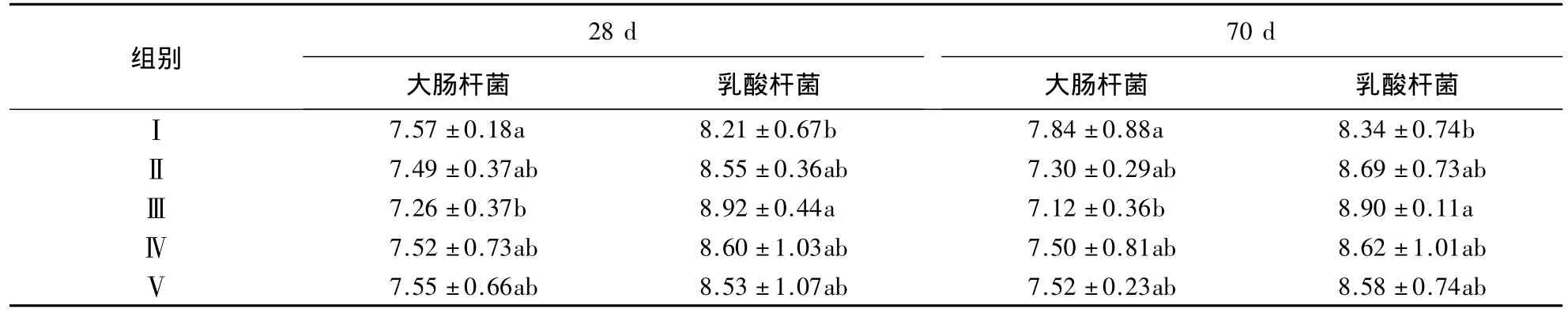
表4 黄芪超微粉对三黄鸡盲肠菌群的影响1)Table 4 Effects of Astragalus ultramicro powder on cecum microflora in broilers (lg CFU·g-1)
3 讨论
3.1 黄芪超微粉对三黄鸡肠道绒毛形态结构的影响
小肠粘膜的表面覆盖着指状的绒毛,在绒毛的底部有一些呈简单管状的隐窝,隐窝的上皮与绒毛的上皮互相连接,隐窝底部的细胞不断进行有丝分裂,而绒毛顶端的一些细胞不断脱落到肠腔中.因此,肠粘膜上皮细胞不断进行更新,隐窝底部不断产生新细胞,而衰老的细胞不断从绒毛顶端脱落,绒毛长度、隐窝深度及绒毛长度/隐窝深度都会直接影响小肠吸收营养物质的能力.Caspary[10]研究表明,绒毛长度变长、隐窝变浅、绒毛长度/隐窝深度增大时,绒毛吸收能力变强,反之则减弱.徐子涵等[11]研究表明,不同剂型乳酸菌在提高雏鸡日增重的同时,对小肠肠道粘膜的组织形态有一定的改善,可以增加小肠绒毛长度,降低隐窝深度.本试验结果表明,黄芪超微粉均能提高三黄鸡十二指肠、空肠和回肠的绒毛长度,降低隐窝深度,提高绒毛长度/隐窝深度,这与文献[12-13]的研究结果一致.主要原因是,黄芪含有多种化学成分、微量元素以及氨基酸等营养物质,经超微粉碎后,有效物质无需经过层层细胞膜(细胞壁)就能迅速溶出被机体吸收利用,促进肠道绒毛的生长发育.
3.2 黄芪超微粉对三黄鸡十二指肠内容物消化酶活性的影响
肠道消化酶活性对禽类营养物质的吸收及健康状况有着重要作用.其中,胰蛋白酶在蛋白质的水解过程中起重要作用,家禽饲料氨基酸的消化取决于胰蛋白酶[14];脂肪酶能够分解饲料中的脂肪为甘油、脂肪酸、甘油单酯或二酯供机体吸收利用;淀粉酶能够水解淀粉,在机体淀粉消化吸收中起着重要作用.本试验结果表明,饲料中添加黄芪超微粉能提高十二指肠消化酶的活性,这与王志祥等[15]的“黄芪活性成分提取物能不同程度地提高肉鸡十二指肠食糜α-淀粉酶、脂肪酶和总蛋白水解酶活性”的研究结果一致.研究表明,黄芪多糖能有效促使小肠绒毛变长、增粗,排列紧密,增大小肠粘膜面积,与食糜接触面积增大,促进小肠的消化与吸收[16].本试验中的黄芪多糖为黄芪的有效成分之一,这可能与其发挥功效有关;其次,黄芪经超微粉碎后,粒径更细微、均匀,可以很好地溶解、分散在胃肠液中,附着力增大,与肠道内消化酶的接触面积更大,从而增加了其吸收利用的时间与空间,进一步提高酶的活性.其具体作用机制有待进一步研究.
3.3 黄芪超微粉对三黄鸡盲肠菌群的影响
禽类的消化道中栖息着多种有益菌、有害菌和中性菌,它们作为一个体系存在,在正常情况下相互作用、相互制约.菌群结构相对稳定,维持着肠道微生态区系的平衡,对动物的消化吸收、免疫和健康起着重要作用[17].高杨等[18]研究表明,饲料中添加适量的黄芪多糖能降低蛋鸡盲肠大肠杆菌的数量,增加乳酸杆菌和双歧杆菌的数量.李树鹏等[19]研究表明,黄芪多糖能减少雏鸡肠道大肠杆菌的数量,增加乳酸杆菌和双歧杆菌的数量,还能使回肠和盲肠的绒毛变长、变粗,紧密排列.
本试验结果显示,饲料中添加黄芪超微粉能在不同程度上增加三黄鸡盲肠乳酸杆菌的数量,降低大肠杆菌的数量,表明黄芪能有效促进肠道有益微生物的增殖,并对有害菌有抑制作用.其原因可能是,黄芪经超微粉碎后,多种有效成分能更多地释放出来,绒毛长度的增加也更有利于有益菌对营养物质的利用,从而增加有益菌的数量,而微生态区系的细菌数量是稳定的,通过竞争排斥、占位等,抑制了有害菌的生长,阻止致病菌与肠道粘膜表面受体结合;另一方面,乳酸杆菌产生的挥发性脂肪酸等,能降低肠道pH,进一步阻止大肠杆菌的定植和繁殖.
4 结论
本试验结果表明,日粮中添加黄芪超微粉能改善三黄鸡小肠绒毛形态结构,不同程度提高绒毛长度/隐窝深度,提高十二指肠内容物消化酶活性,并且增加盲肠乳酸杆菌数量,抑制大肠杆菌数量,对肠道的消化吸收环境具有改善作用,其适宜的添加量为0.75%.
[1]胡永娜,王之盛,李爱科.固态发酵菜籽粕对肉仔鸡生长性能、免疫功能及消化酶的影响[J].动物营养学报,2012,24(7):1293-1301.
[2]王俊峰,陈雁南,温超,等.合成素对肉鸡生长性能、免疫器官指数、血清免疫指标及肠道菌群的影响[J].动物营养学报,2010,22(1):163 -168.
[3]钟金凤,徐美解,邱伟海,等.辣椒素对湘黄雏鸡生长性能、血液指标和消化酶活性影响的研究[J].家畜生态学报,2009,30(6):61 -65.
[4]江忠远.脾胃虚寒型胃痛证治心得[J].湖北中医杂志,2000,22(10):30-31.
[5]黄一帆,李富文,马玉芳,等.超微粉碎对黄连解毒汤中黄芩苷溶出的影响[J].福建农林大学学报:自然科学版,2004,33(2):215-218.
[6]黄一帆,马玉芳,李富文,等.超微粉碎对黄连解毒散中栀子苷和小檗碱溶出的影响[J].福建农林大学学报:自然科学版,2006,35(4):394 -397.
[7]马玉芳,林雪玲,俞道进,等.黄连解毒散超微粉有效成分小檗碱在家兔体内的药代动力学研究[J].中国农业科学,2008,41(3):875 -879.
[8]马玉芳,刘洪娜,俞道进,等.穿心莲超微粉有效成分在家兔体内的药动学研究[J].畜牧兽医学报,2009,40(6):904-909.
[9]辛娜,刁其玉,张乃锋,等.芽胞杆菌制剂对蛋鸡生产性能、血清指标及盲肠微生物的影响[J].中国畜牧兽医,2011,38(10):5-8.
[10]CASPARY W F.Physiology and pathophysiology of intestinal[J].American Journal of Clinical Nutrition,1992,55:299 -308.
[11]徐子涵,许丽.不同剂型乳酸菌对雏鸡生长性能和小肠粘膜形态的影响[J].动物营养学报,2011,23(10):1812-1818.
[12]陶浩,魏炳栋,陈群.黄芪多糖对1-14日龄肉仔鸡小肠形态结构的影响[J].东北农业大学学报,2012,43(3):52-57.
[13]张勇,李冰,朱宇旌,等.黄芪多糖对肉鸡生长性能和小肠粘膜形态的影响[J].沈阳农业大学学报,2009,40(4):453-457.
[14]张天国,SIDOEUN B,袁建敏,等.2种棉籽蛋白粉代谢能和氨基酸消化率的评定[J].饲料研究,2008(6):6-8.
[15]王志祥,吕美,苏雅琴,等.黄芪活性成分提取物对肉仔鸡生长、代谢及消化酶活性的影响[J].河南农业大学学报,2006,40(3):280 -283.
[16]周保华.小檗碱改善肉鸡盲肠微生态、生长代谢及免疫力的研究[D].扬州:扬州大学:2006.
[17]VINCENTER B.Vaccination for app is even useful when mortality is low[J].Livestock Science,2007,109:174 -178.
[18]高杨,王洪芳,陈辉,等.饲料添加黄芪多糖对蛋鸡免疫功能及肠道菌群的影响[J].动物营养学报,2011,23(3):447-451.
[19]李树鹏,赵献军.黄芪多糖、益生菌合生元对雏鸡生长和免疫的作用[J].中国农学通报,2005,21(6):51-54.
