白茶黄酮醇类物质的HPLC测定及水解工艺优化
2014-12-24何丽梅郑德勇叶乃兴叶小辉杨江帆
何丽梅,郑德勇,叶乃兴,3,叶小辉,赵 峰,杨江帆,3
(1.福建农林大学园艺学院;2.福建农林大学材料工程学院;3.福建农林大学茶叶科技与经济研究所;4.福建农林大学食品科学学院,福建福州350002)
白茶是我国特有的茶叶品类,含有丰富的儿茶素类、黄酮类和黄酮醇类等有益于人体健康的物质.茶叶中的黄酮醇类物质具有抗氧化、保护肝脏及清除自由基等功效[1-3],对茶叶的色泽和滋味等品质因子有一定的影响[4],特别是杨梅素、槲皮素和山奈酚等是茶叶色泽的主要呈色物质.茶叶中黄酮醇类物质多以糖苷的形态存在,黄酮醇苷存在形式的多样性增加了其定性和定量研究的难度[5-6],一般须经水解成苷元后才能采用高效液相色谱(high performance liquid chromatography,HPLC)法测定.由于不同种类茶叶含有的黄酮醇苷的糖基可能不同,相对应的适合其水解的条件也可能存在差异[7-8].关于银杏叶黄酮醇类物质水解条件的研究较多,如前人[9-14]对银杏叶中黄酮醇苷的水解条件进行了优化分析研究,优化了黄酮醇类物质水解及检测的工艺.
为了探究茶叶中黄酮醇类物质含量及其变化规律等,一些学者对茶叶中黄酮醇苷水解条件的影响因子进行了相关研究.如卢邦俊等[15]、朱博等[16]采用HPLC方法对绿茶、红茶、黄茶、普洱茶和乌龙茶中的黄酮醇类物质进行了分离检测,获得了最优的黄酮醇类物质水解条件,并建立了黄酮醇类物质的检测方法.本试验采用正交试验法优化样品制备中的水解条件,并对HPLC检测法的标准曲线、精密度和加标回收率等进行分析,首次建立白茶中黄酮醇类物质的优化检测方法.
1 材料与方法
1.1 材料
白茶(白毫银针)由福建品品香茶业有限公司提供.茶叶采用粉碎机粉碎,取过40目筛的粉末为试样.
标准品芦丁(95%)、杨梅素(≥98%)、槲皮素(98.13%)和山奈酚(98.84%)购自四川成都曼斯特科技有限公司.乙腈和甲醇为HPLC级溶剂,其他试剂均为分析纯,试验用水为纯水.
1.2 白茶浸提液的制备
称取0.2 g(精确到0.0001 g)茶叶试样于10 mL离心管中,加入5 mL经预热(70℃)的70%甲醇溶液(含2 g·L-1抗坏血酸),充分拌匀润湿后置于70℃水浴锅中浸提10 min(每隔5 min搅拌一次),浸提后冷却至室温,置于TGL-16高速冷冻离心机(美国赛默飞世尔科技公司)中离心10 min(7000 r·min-1,4℃),将上清液转移至10 mL容量瓶中;残渣再加入5 mL经预热(70℃)的70%甲醇溶液(含2 g·L-1抗坏血酸)提取一次.重复如上操作,合并提取液后用蒸馏水定容至10 mL,摇匀后备用.
1.3 白茶黄酮醇类物质的HPLC测定
1.3.1 HPLC检测条件 采用HPLC法测定白茶中黄酮醇类物质的含量.供试Agilent1200高效液相色谱仪带二极阵列管检测器,Zorbax Eclipse XDB-C18色谱柱(5 μm,4.6 mm×250 mm).流动相A和流动相B的配制参照 GB/T 8313-2008[17]的方法,梯度洗脱程序:0-10 min,100%A、0%B;10-25 min,68%A、32%B;25-35 min,68%A、32%B;35-45 min,100%A、0%B.流动相流速为1 mL·min-1,柱温为 35℃,检测波长为354(芦丁)和372 nm(杨梅素、槲皮素和山奈酚),进样量为10 μL,采用保留时间定性和外标法定量.
1.3.2 标准品标准曲线的建立 杨梅素、槲皮素和山奈酚用甲醇溶解并定容,芦丁用70%甲醇溶解并定容,配制黄酮醇类物质的储备液和工作标准溶液.根据预先测定的白茶中各检测对象的含量,各取一定体积的上述4种工作标准溶液,用分析纯甲醇定容至一定体积配制成系列浓度混合标准溶液,混匀后经0.22 μmL膜过滤,采用HPLC法建立标准品的标准曲线.
1.3.3 HPLC检测方法精密度和加标回收率的测定 采用HPLC法测定混合标准溶液中杨梅素、槲皮素、山奈酚和芦丁的色谱图峰面积,根据标准曲线计算各组分含量,连续进样3次,计算HPLC检测方法的精密度.将上述混合标准溶液加入到已知黄酮醇类物质含量的白茶浸提液中,采用HPLC法测定样品中各组分含量,连续进样3次,计算HPLC检测方法的加标回收率.
1.4 白茶黄酮醇苷的水解
1.4.1 黄酮醇苷的水解过程 移取5 mL白茶浸提液到10 mL定量试管中,加入5 mL盐酸后在指定温度下进行水解操作,水解结束后立即将试管放入冰水浴中冷却至25℃,再用70%甲醇溶液(含2 g·L-1抗坏血酸)定容至10 mL.取上清液经0.22 μm膜过滤后备用.
1.4.2 黄酮醇苷水解方法的优化设计 前期研究表明,盐酸浓度、水解温度和水解时间是影响样品制备精密度和加标回收率的主要因素,采用正交试验方案L9(34)设置水解工艺条件(表1),并以杨梅素、槲皮素和山奈酚的含量及其总和为指标进行优化试验.
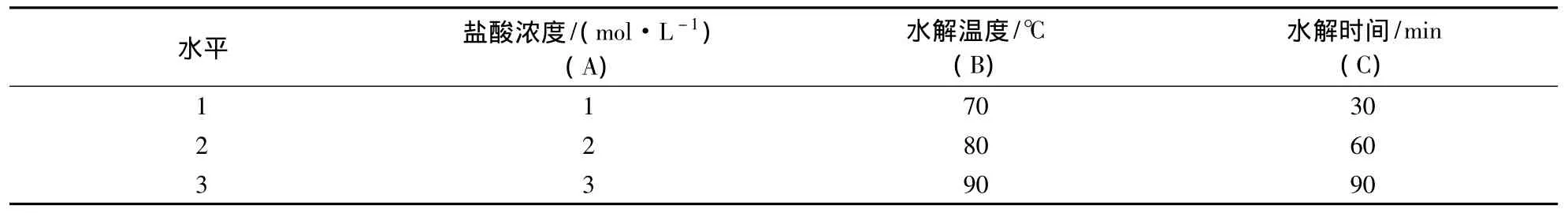
表1 因素水平表Table 1 Factors and levels
1.4.3 水解方法精密度和加标回收率的测定 移取5 mL白茶浸提液,加入0.1 mL混合标准溶液,在优化工艺条件下进行水解操作,采用HPLC法测定各组分含量;另取5 mL白茶浸提液,直接在优化工艺条件下水解,而后用70%甲醇溶液(含2 g·L-1抗坏血酸)定容至10 mL,经0.22 μm膜过滤,采用HPLC法测定水解液中各组分含量,作为对照组;根据测定结果计算水解方法的精密度和加标回收率[16];计算芦丁的水解转化率,芦丁的水解转化率/%=(槲皮素增加量/槲皮素分子质量)/(芦丁添加量/芦丁分子质量)×100.
1.5 数据分析
采用Microsoft Excel 2003和DPS数据处理软件对试验数据进行处理分析.
2 结果与分析
2.1 HPLC法建立测定黄酮醇类物质的标准曲线
采用HPLC法测定杨梅素、槲皮素、山奈酚和芦丁的单标溶液和系列混合标准溶液中各标准品的色谱图峰面积,采用保留时间法定性,并以对应的色谱峰面积为自变量,被测溶液含量为因变量,经线性规划得到标准曲线方程(表2).
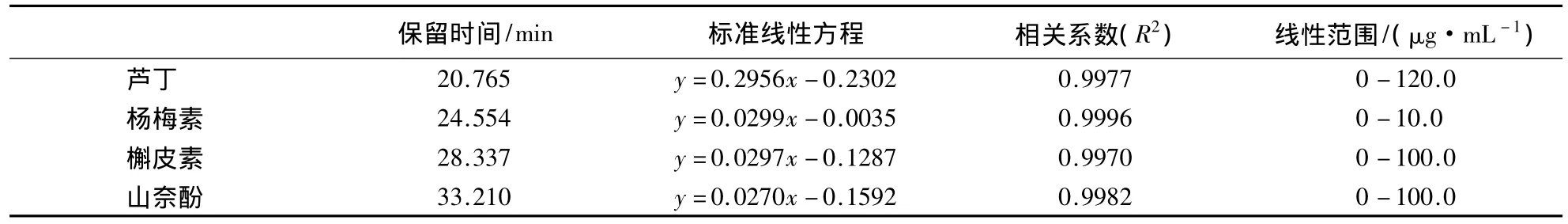
表2 芦丁和3种黄酮醇类物质的标准曲线方程Table 2 Standard curve of rutin and three flavonols
由表2可知,HPLC法所测定的4种物质保留时间间隔较大,分离度好.建立的标准曲线相关系数均接近1,表明方程拟合度高,可在相应的线性范围内进行定量分析.
2.2 黄酮醇类物质HPLC检测方法的精密度和加标回收率
测定并计算黄酮醇类物质HPLC检测方法的精密度和加标回收率(表3、4).
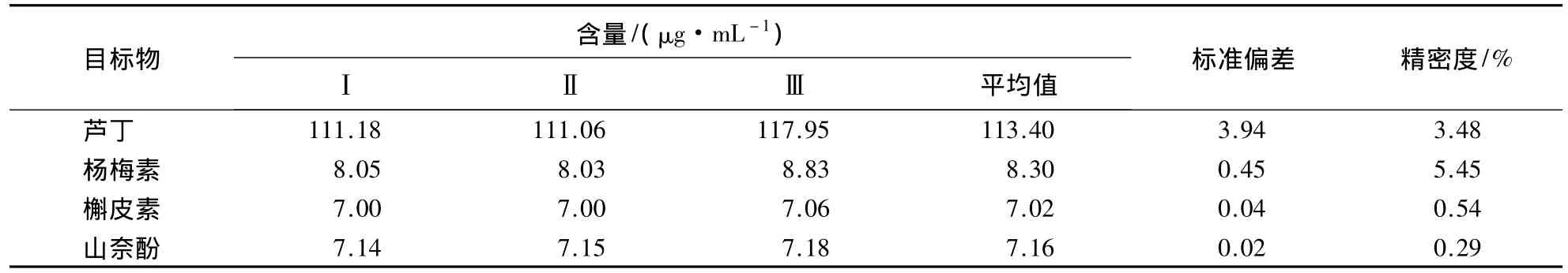
表3 HPLC法测定芦丁和3种黄酮醇类物质的精密度Table 3 Determination precision of three flavonols and rutin by HPLC
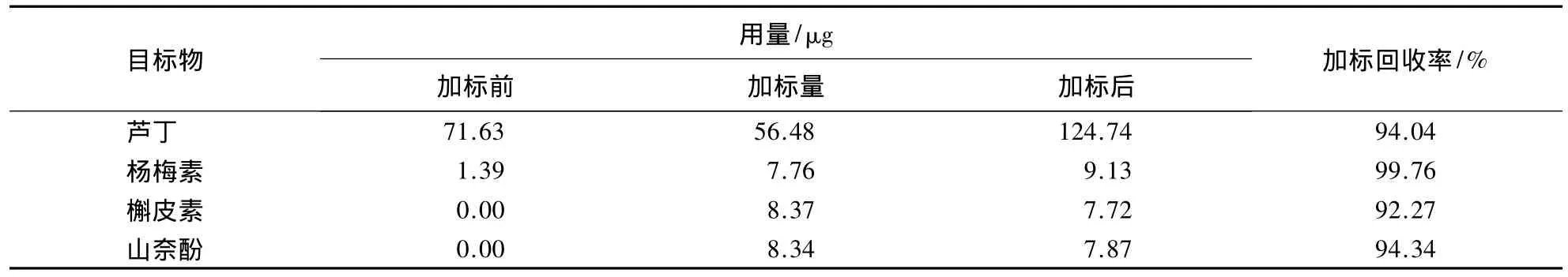
表4 HPLC法测定芦丁和3种黄酮醇类物质的加标回收率Table 4 The standard addition recovery rate of three flavonols and rutin by HPLC
由表3可知,芦丁、杨梅素、槲皮素和山奈酚的精密度分别为3.48%、5.45%、0.54%和0.29%,表明HPLC检测方法的精密度相对较高.
由表4可知,芦丁、杨梅素、槲皮素和山奈酚的加标回收率分别为94.04%、99.76%、92.27%和94.34%,表明HPLC检测方法的加标回收率均相对较高,均达到90%以上.
从HPLC检测方法的精密度、加标回收率和标准曲线可以看出,建立的标准曲线具有良好的线性相关系数,且方法的精密度较高,加标回收率也较高,可认为该方法能对芦丁、杨梅素、槲皮素和山奈酚进行较好的定性、定量分析.
2.3 黄酮醇类物质及其苷类的水解方法
采用L9(34)正交试验设计方案,以水解后白茶提取液中黄酮醇类物质的含量为分析指标,研究黄酮醇苷水解的主要影响因素,结果如表5所示.
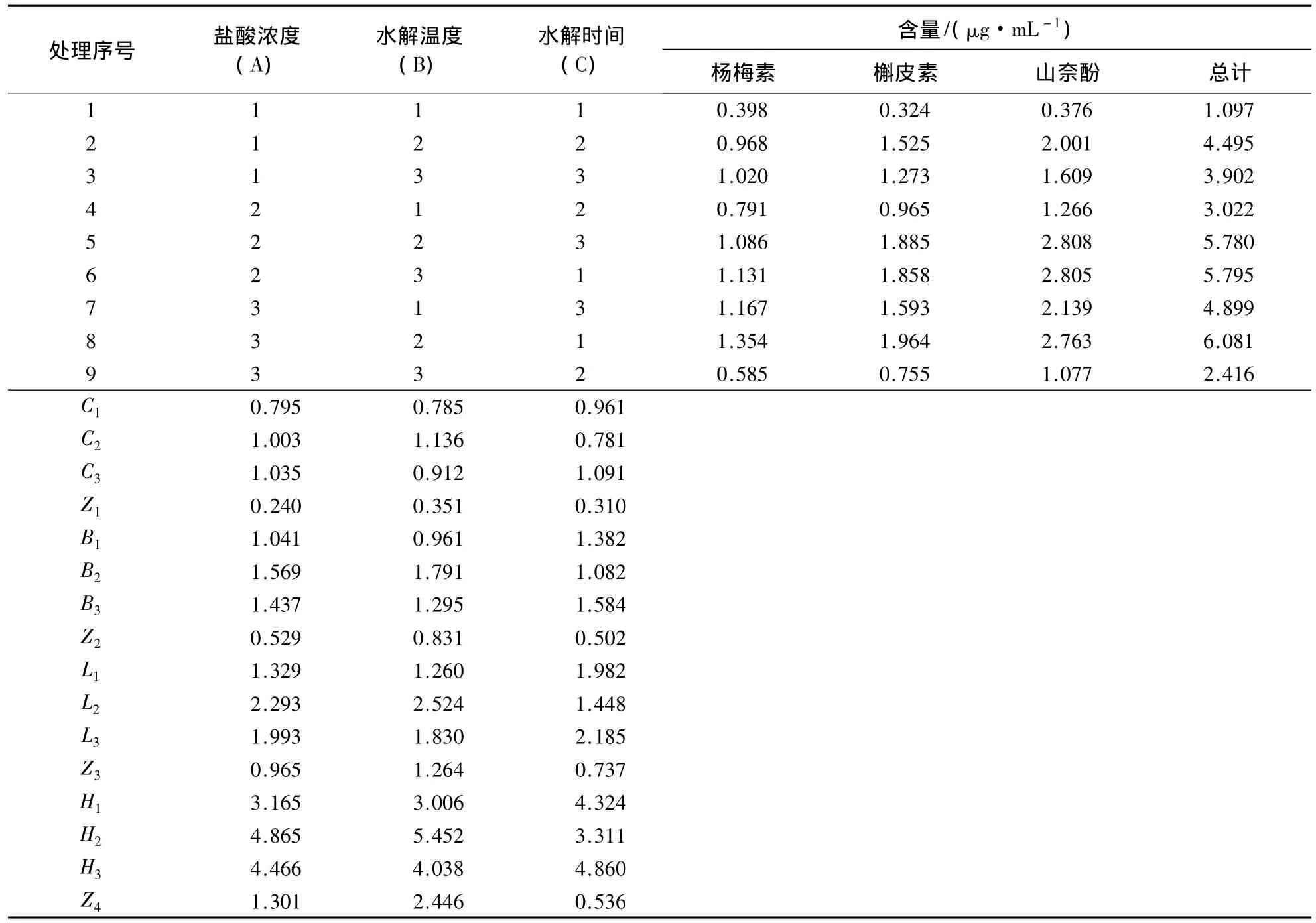
表5 白茶水解工艺优化方案与试验结果1)Table 5 The plan and results of white tea hydrolysis process optimization
由表5可知:若以杨梅素、槲皮素和山奈酚及3种黄酮醇类物质总量为指标,则8号处理有利于杨梅素苷和槲皮素苷的水解,5号处理有利于山奈酚苷的水解;A3B2C1(8号处理)是有利于3种黄酮醇苷总量水解的最优条件.若以极差为指标,杨梅素苷水解的影响因子从大到小依次为水解温度、水解时间和盐酸浓度;槲皮素苷和山奈酚苷水解的影响因子从大到小依次为水解温度、盐酸浓度和水解时间;3种黄酮醇苷总量水解的最优条件为A2B2C3,即盐酸浓度2 mol·L-1,水解温度80℃,水解时间90 min.
2.4 水解方法验证试验的精密度和加标回收率及最优水解方法的确定
因参考不同指标所得的较优水解条件不同,因此对上述两种水解方法进行验证试验.精密度和加标回收率是评价水解方法可行性的重要指标,对上述两种水解方法的精密度和加标回收率进行测定,结果如表6、7 所示.
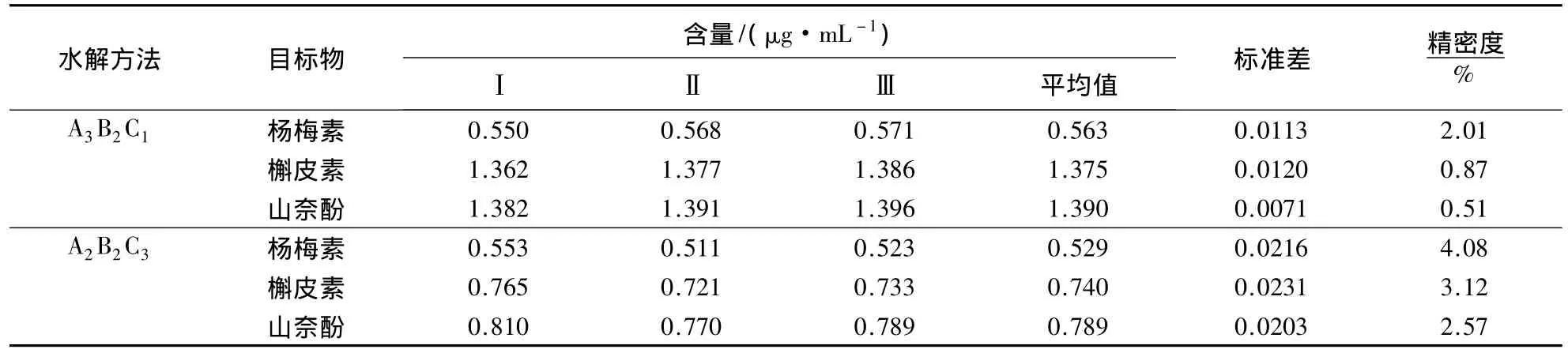
表6 HPLC法测定3种黄酮醇类物质的精密度Table 6 Determination precision of three flavonols by HPLC
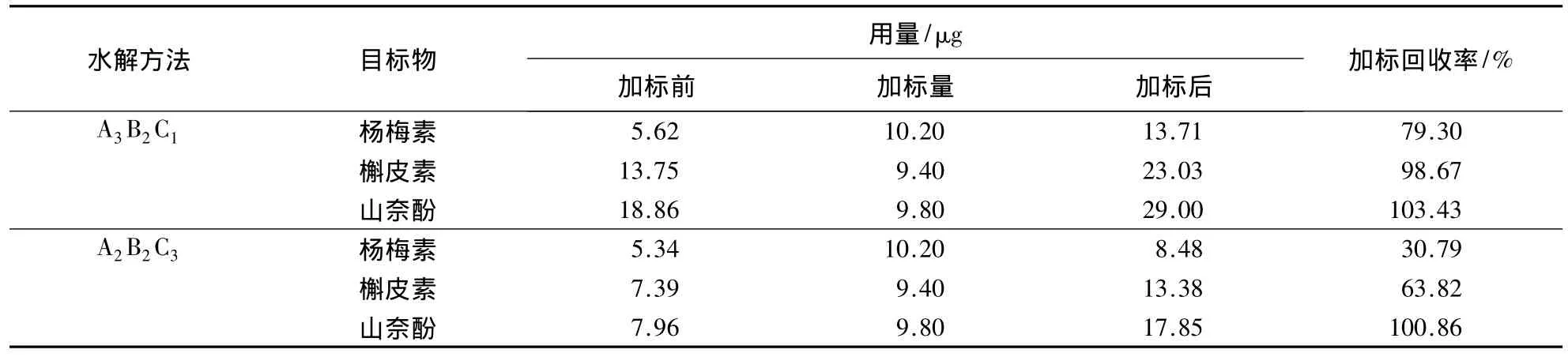
表7 HPLC法测定3种黄酮醇类物质的加标回收率Table 7 The standard addition recovery rate of three flavonols by HPLC
由表6可知,水解方法A3B2C1中杨梅素、槲皮素和山奈酚的精密度均较高,分别为2.01%、0.87%和0.51%,而水解方法A2B2C3中杨梅素、槲皮素和山奈酚的精密度则较A3B2C1低,表明水解方法A3B2C1的精密度较高,有利于黄酮醇苷的水解.
由表7可知,水解方法A3B2C1中杨梅素、槲皮素和山奈酚的加标回收率分别为79.30%、98.67%和103.43%,而水解方法 A2B2C3中杨梅素、槲皮素和山奈酚的加标回收率分别为30.79%、63.82%和100.86%.且从加标回收率可知,在水解过程中山奈酚最稳定,杨梅素易被分解,水解时间越长则杨梅素越容易被分解.水解方法A3B2C1中芦丁的水解转化率为94.32%,水解方法A2B2C3中芦丁的水解转化率为79.33%.从黄酮醇类物质的稳定性及加标回收率的高低等可以看出,水解方法A3B2C1更有利于白茶中黄酮醇类物质的检测.
综合上述分析可以得出:A3B2C1(8号处理)为白茶黄酮醇类物质的最佳水解条件,即盐酸浓度3 mol·L-1,水解温度80℃,水解时间30 min,可使白茶提取液中黄酮醇苷总量的水解趋于最大化,且该水解方法用于测定白茶中黄酮醇类物质的含量是可行的.
3 讨论
本研究首次对白茶黄酮醇类物质的测定方法进行优化试验的结果表明,白茶中槲皮素苷水解的影响因子从大到小依次为水解温度、盐酸浓度和水解时间;而绿茶中槲皮素苷水解的影响因子从大到小依次为水解温度、水解时间和盐酸浓度[16].在最佳水解条件,即盐酸浓度3 mol·L-1、水解温度80℃和水解时间30 min下,白茶黄酮醇苷类物质的水解可以实现最大化;而绿茶水解时间为2.0-2.5 h,黄茶水解时间为2.5 h,红茶、普洱茶和乌龙茶的水解时间为1.5 h[16-17].白茶黄酮醇类物质的水解时间相对较短,适合于日常分析,且在实际操作中可提高测定效率.白茶黄酮醇类物质最优测定方法的精密度和加标回收率相对较高,芦丁的水解转化率达到94.32%,大于绿茶的芦丁水解转化率(82.74%)[16].白茶最优水解方法测定的杨梅素含量占总黄酮醇类物质的22.27%,而卢邦俊等[15]研究表明,红茶、黄茶、黑茶、绿茶和武夷岩茶中杨梅素含量占总黄酮醇类物质的百分比均不超过20%,甚至在一些红茶中未检测出杨梅素.从白茶的杨梅素加标回收率(79.30%)和绿茶的杨梅素加标回收率(70.41%)[16]可知,白茶和绿茶的杨梅素在水解过程中均相对不稳定,而白茶的水解时间较绿茶短,且白茶浸提液用含2 g·L-1抗坏血酸的70%甲醇溶液提取,可在一定程度上提高黄酮醇类物质的抗氧化性,使白茶中杨梅素被水解的程度较绿茶低,但如何在水解过程中提高杨梅素的稳定性还有待于进一步研究.
[1]KYLE J A,MORRICE P C,MCNEILL G,et al.Effects of infusion time and addition of milk on content and absorption of polyphenols from black tea[J].J Agric Food Chem,2007,55(12):4889-4894.
[2]SINGAB A N,YOUSSEF D T,NOAMAN E,et al.Hepato protective effect of flavonol glycosides rich fraction from egyptian vicia calcarata desf,against CCI4-induced liver damage in rats[J].Arch Pharm Res,2005,28:791-798.
[3]陈小萍,张卫明,史劲松,等.茶树花黄酮的提取及对羟自由基的清除效果[J].南京师大学报:自然科学版,2007,30(2):93-97.
[4]李家华,赵明,胡艳萍,等.普洱茶发酵过程中黄酮醇类物质含量变化的研究[J].西南大学学报:自然科学版,2012,34(2):59-64.
[5]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2003:16.
[6]戴前颖,夏涛,高丽萍,等.绿茶汤呈色物质研究进展[J].安徽农业大学学报,2011,38(6):887-891.
[7]MERKEN H M,BEECHER G B.Liquid chromatographic method for the separation and quantification of prominent flavonoid aglycones[J].Journal of Chromatography A,2000,897:177-184.
[8]HERTOG M G L,HOLLMAN P C H,VENEMA D P.Optimization of aquantitative HPLC determination of potentially anticarcinogenic flavonoids in vegetables and fruits[J].J Agric Food Chem,1992,40:1591-1598.
[9]杜安全,王先荣,周正华,等.银杏叶总黄酮苷的HPLC法分析水解条件[J].安徽医药,2001,5(3):164-165.
[10]陈钧,猪股宏,新井邦夫.定量分析银杏黄酮苷的水解反应条件[J].分析化学研究简报,2001,29(4):450-452.
[11]杨明生,刘建庄,黄娟娟,等.银杏黄酮水解条件的探讨[J].光谱实验室,2004,21(5):852-855.
[12]高丽娟,刘普,张伟,等.高纯银杏黄酮水解条件研究[J].鞍山科技大学学报,2004,27(4):245-247.
[13]钟尉方,王岳鸿,于莲.银杏黄酮醇苷水解条件的正交实验研究[J].黑龙江医药科学,2006,29(5):34-35.
[14]赖宇红,童惠贞,冼彦芳,等.银杏黄酮测定时水解条件的研究[J].中国药科大学学报,2007,38(6):569-571.
[15]卢邦俊,范必威,甄云鹏,等.高效液相色谱法测定中国茶中的黄酮醇[J].天然产物研究与开发,2006(18):160-164.
[16]朱博,夏涛,高丽萍,等.绿茶茶汤中黄酮醇及其苷类的测定方法以及对茶汤色度的影响[J].食品与发酵工业,2009,35(2):146-150.
[17]中华人民共和国国家质量监督检验检疫总局.GB/T 8313-2008茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008.
