食品成分对脲酶活性的影响
2014-12-16赵国群张宁宁
赵国群,张宁宁
(1.河北省发酵工程技术研究中心,河北石家庄050018;2.河北科技大学生物科学与工程学院,河北石家庄050018)
食品的重金属污染是最受关注的食品安全问题之一。从食品安全方面考虑的重金属污染,目前最引人关注的是铅、汞、铬、镉,以及类金属砷等有显著生物毒性的重金属[1]。传统的重金属检测方法主要有原子吸收光谱法、原子荧光光谱法、原子发射光谱法和阳极溶出伏安法等[2]。这些检测方法虽然灵敏度比较高,但是检测仪器昂贵,检测步骤繁琐,耗时长,检测成本较高,难以满足市售食品的现场抽查、食品生产企业自查的要求[3-4]。研究简单、快速和低成本的重金属快速检测方法,对于监控食品的重金属污染具有重要意义。
近年来,国内外学者对环境及食品中重金属的快速检测技术进行了许多研究,其中酶抑制法检测重金属是最受关注的方法之一。酶抑制法测定重金属的基本原理是:重金属离子与酶活性中心的某些部位如巯基结合,酶活性中心的结构及性质发生改变,导致酶活力下降,从而使底物-酶系统产生变化,例如使显色剂的颜色、溶液的吸光度、pH和电导率等发生改变,直接用肉眼或通过电信号、光信号检测这些变化,即可判断样品中是否存在重金属[5-6]。由于脲酶对重金属离子高度的选择性和敏感性,而且廉价易得[7-9],因此,在酶抑制法检测重金属的研究中使用最多。虽然酶抑制法检测重金属的研究已经有了较大的进展,但是仅限于环境样品,很少涉及食品样品的检测,这是因为食品种类繁多,成分复杂,可干扰酶法检测效果的因素很多[5]。造成这种现象的原因之一是有关食品成分与脲酶酶活之间关系的研究极少。本文采用模拟的方法,研究了糖、蛋白质、有机酸色素等食品成分对脲酶酶活的影响,以期为酶法检测食品中重金属的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
葡萄糖、果糖、柠檬酸:天津市河东区红岩试剂厂;蔗糖:天津市百世化工有限公司;可溶性淀粉:张家口市茶坊化学试剂厂;安赛蜜(食品级):山东明辉食品有限公司;酪蛋白(食品级)、甘氨酸、L-半胱氨酸、谷氨酸、酒石酸、氯化钠、山梨酸钾(食品级)、苯甲酸钠、亚硝酸钠:天津博迪化工有限公司;明胶(食品级):上海市化学试剂公司工厂;乳酸、无水乙酸、乙酸钠、酒石酸钾钠:天津永大化学试剂有限公司;磷酸:天津市恒兴化学试剂制造有限公司;柠檬酸三钠:天津市标准科技有限公司;色素(食品级):苋菜红、赤藓红、胭脂红、柠檬黄、日落黄、甜蜜素(食品级):天津市光复精细化工研究所;儿茶酚:天津市大茂化学试剂厂。如没有特别指出,上述食品成分材料均为分析纯。
Jack bean urease脲酶:美国Sigma公司,酶活力为 15000 U/mg;尿素、苯酚、亚硝基铁氰化钠、次氯酸钠、硫酸铵、磷酸二氢钠、磷酸氢二钠等常规试剂均为国产分析纯。
1.2 仪器与设备
CS501超级恒温水浴锅:上海博讯实业有限公司;SP-752分光光度计:上海光谱仪器有限公司。
1.3 方法
1.3.1 主要试剂的配制
1)脲酶溶液的配制:精确称取脲酶0.001 g,溶于磷酸盐缓冲溶液(pH7.0)中,并定容至250 mL,置于4℃冰箱保存备用。
2)酚显色剂:称取苯酚5.00 g,亚硝基铁氰化钠(含2分子结晶水)0.025 g,溶于去离子水中并定容至500 mL。
3)碱性次氯酸钠溶液:称取氢氧化钠2.50 g,溶于去离子水中,加入安替福明4 mL,在棕色容量瓶定容至500 mL。
4)3%尿素溶液:精确称取尿素3.00 g,溶于去离子水,定容至100 mL,置于4℃冰箱保存备用。
1.3.2 脲酶酶活力测定
脲酶酶活力测定原理:脲酶催化尿素水解产生2分子氨和1分子二氧化碳[10];氨在碱性条件下与苯酚及次氯酸钠反应,生成蓝色的靛酚,并在671 nm下有吸收峰。在一定范围内,靛酚呈色深浅与氨含量成正比[11-12]。
取3%尿素2 mL溶液于试管中,分别加入1 mL所配制的食品成分溶液、1 mL去离子水和1 mL脲酶溶液,摇匀后于30℃水浴下反应20 min。反应结束后加入5 mL酚显色剂,摇匀,再加入5 mL碱性次氯酸钠溶液,充分摇匀后于30℃水浴下显色30 min。显色结束后于671 nm下测定吸光度,计算脲酶酶活。脲酶酶活力单位定义为:在pH7.0,30℃下,每分钟催化产生0.01 μmoL NH3的酶量为一个活力单位。
1.3.3 脲酶酶活抑制率的计算
脲酶酶活抑制率=(去离子水酶活-食品成分酶活)/去离子水酶活×100%
2 结果与讨论
2.1 糖类及甜味剂对脲酶活性的影响
糖及甜味剂是广泛应用于果汁、果酱、蜜饯类、饮料、果冻、糕点等各类食品中,是食品中最常见的成分之一。用去离子水分别配制5%葡萄糖、5%果糖、5%蔗糖、0.5%可溶性淀粉、0.065%甜蜜素和0.03%安赛蜜溶液,然后与脲酶溶液混合,以去离子水为对照,测定脲酶酶活,试验结果见图1。
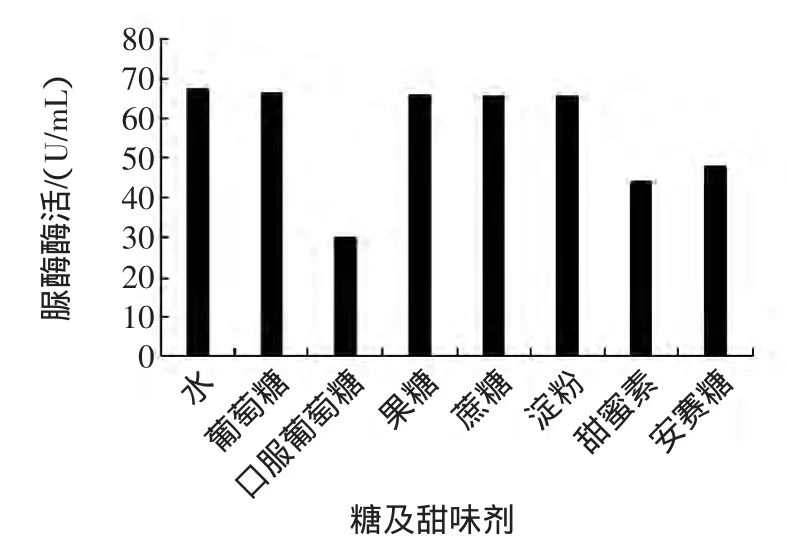
图1 糖类及甜味剂对脲酶活性的影响Fig.1 Effect of sugars and sweeteners on urease activity
从图1可以看出,如预料的那样,葡萄糖、果糖、蔗糖和淀粉均对脲酶没有表现出抑制作用。然而,人工甜味剂甜蜜素和安赛蜜却对脲酶有明显的抑制作用,二者的酶活抑制率分别为34.6%和29.0%。为了降低生产成本,甜蜜素等甜味剂在果汁饮料、碳酸饮料和冷饮中广泛添加。如果采用脲酶抑制法测定其中的重金属,如果不采取其他措施,就会造成假阳性,引起误判。从图1中还发现,与分析纯的葡萄糖不同,食品级的口服葡萄糖对脲酶酶活表现出了非常显著的抑制作用,其酶活抑制率达55.4%。造成这种现象的原因应是其纯度较低,含有较高的金属离子所致,这也从另一个侧面说明脲酶对金属离子的高敏感性。
2.2 蛋白质及氨基酸对脲酶活性的影响
蛋白质及氨基酸也是食品中最常见的成分之一,尤其是乳粉、豆制品、肉制品,其中含有丰富的蛋白质及氨基酸。用去离子水分别配制0.5%酪蛋白、2%明胶、0.2%谷氨酸、0.01%甘氨酸、0.01%L-半胱氨酸溶液,与脲酶溶液混合,以去离子水为对照,测定脲酶酶活,试验结果见图2。
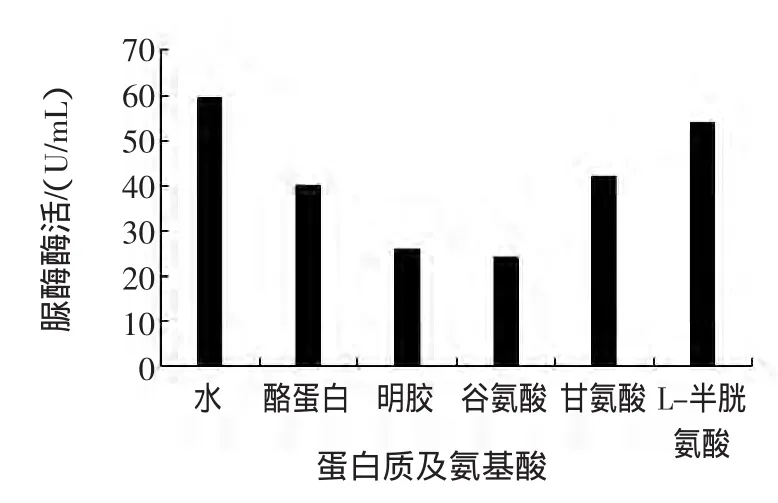
图2 蛋白质及氨基酸对脲酶活性的影响Fig.2 Effect of proteins and amino acids on urease activity
酪蛋白是乳粉中的主要蛋白质之一[13];明胶常用于果冻等食品。从图2中发现,这两种蛋白质对脲酶具有显著的抑制作用,其酶活抑制率分别为32.5%和56.2%。根据脲酶酶活性中心的结构及性质进行分析,纯酪蛋白、明胶应不会对脲酶有抑制作用。根据2.1中分析纯葡萄糖与食品级口服葡萄糖的试验结果,可以推断造成这种现象的实际原因应是:试验中所使用的样品是食品级的,其中杂质如无机盐较多,这些杂质造成了对脲酶的抑制。谷氨酸、甘氨酸和L-半胱氨酸均表现出抑制作用。脲酶酶活的最适pH为7.0,而谷氨酸、甘氨酸、L-半胱氨酸溶液均呈微酸性,反应体系的微酸性是造成所试氨基酸显示抑制作用的原因之一。
2.3 有机酸及其盐对脲酶活性的影响
果汁、果醋、果酒中含有柠檬酸、苹果酸、酒石酸、草酸、琥珀酸及醋酸等有机酸;酸奶及其饮料含有的有机酸主要是乳酸;在可乐类饮料中,使用的主要是磷酸。用去离子水分别配制0.02%酒石酸、0.03%苹果酸、0.15%柠檬酸、0.3%乙酸、0.2%乳酸、0.1%磷酸及其这些有机酸的钠盐溶液,与脲酶溶液混合,以去离子水为对照,测定脲酶酶活,试验结果见图3和图4。
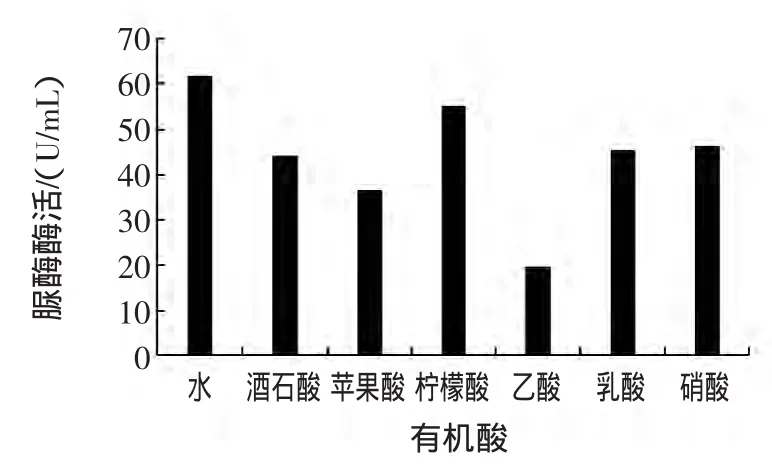
图3 有机酸对脲酶活性的影响Fig.3 Effect of organic acids on urease activity
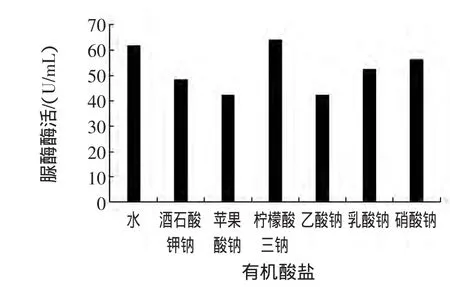
图4 有机酸盐对脲酶活性的影响Fig.4 Effect of organic acid salts on urease activity
从图3可以发现,酒石酸、苹果酸、柠檬酸、乙酸、乳酸和磷酸均表现出对脲酶的抑制作用,其抑制程度因有机酸的种类和浓度而异。乙酸的抑制作用最大可能与使用的浓度最大有关。将图3与图4进行比较,发现柠檬酸三钠对脲酶没有抑制作用,苹果酸钠、乙酸钠、乳酸钠和磷酸钠与相应的酸相比,对脲酶的抑制作用均减小。例如,乳酸的酶活抑制率为26.9%,而乳酸钠的酶活抑制率为15.3%。这个试验结果表明,有机酸对脲酶的抑制作用主要是由于有机酸的低pH所引起的。因此,在采用脲酶法检测食品中重金属时,首先将食品样品溶液的pH调为脲酶的最适pH,可减少有机酸的干扰,提高检测的准确度。
2.4 色素对脲酶活性的影响
天然色素成本高,而且其化学性质不稳定,容易褪色,相比之下,合成色素色彩鲜艳,着色力好,易溶于水,而且价格也便宜,所以人工合成色素在食品中被广泛应用[14]。用去离子水分别配制0.005%赤藓红、0. 0025%胭脂红、0.01%柠檬黄、0.01%日落黄和0.024%苋菜红溶液,与脲酶溶液混合,以去离子水为对照,测定脲酶酶活,试验结果见图5。
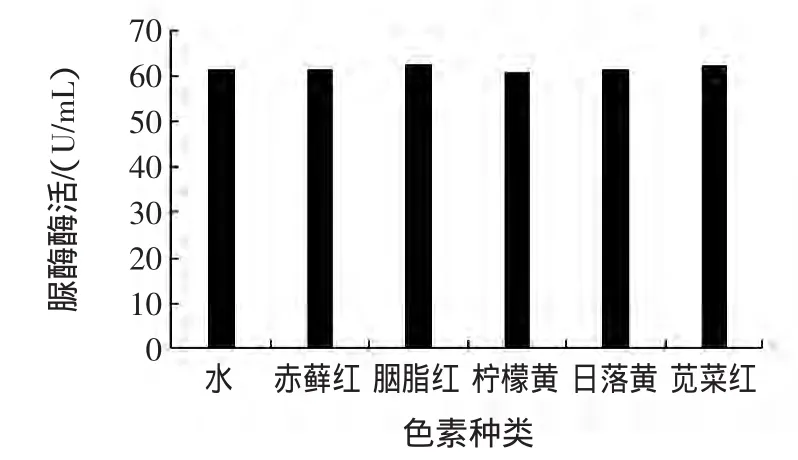
图5 色素对脲酶活性的影响Fig.5 Effect of pigments on urease activity
如图5所示,5种人工合成色素均对脲酶既没有抑制作用,也没有激活作用。这个结果表明,在采用脲酶法检测食品中重金属时,可不考虑人工合成色素的影响。
2.5 其它食品成分对脲酶活性的影响
由于食品中成分复杂多样,本试验选取了几种食品中常见的其它成分,研究了它们对脲酶活性的影响。图6是0.02%氯化钠、0.03%儿茶酚、0.1%山梨酸钾、0.1%苯甲酸钠和0.015%亚硝酸钠溶液对脲酶酶活的影响,见图6。
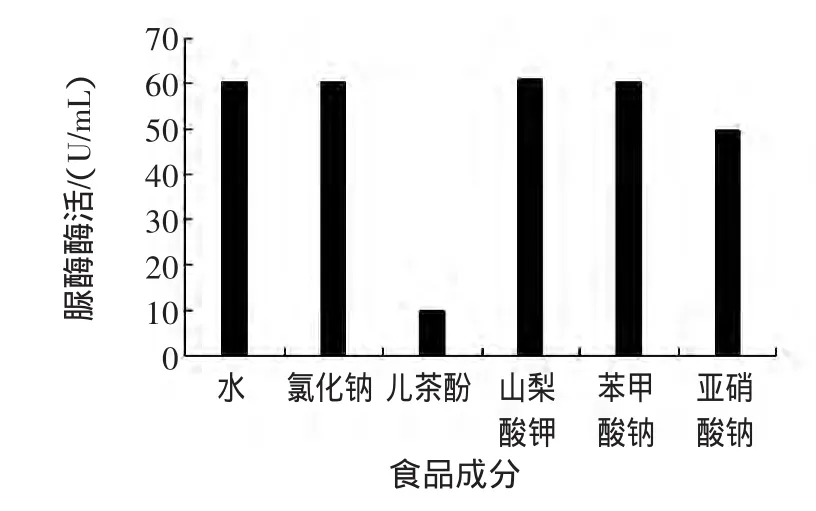
图6 其它食品成分对脲酶活性的影响Fig.6 Effect of other food components on urease activity
氯化钠存在于许多食品中。在本试验条件下,0.02%氯化钠对脲酶酶活没有影响。然而,在某些食品如咸菜中含有很高浓度的食盐,高浓度的氯化钠是否对脲酶酶活有影响还有待进一步研究。山梨酸钾和苯甲酸钠是两种食品中常用的防腐剂,其最高允许用量均为0.1%。如图6所示,二者也对脲酶酶活没有影响。亚硝酸钠是肉制品的常用发色剂[15]。亚硝酸钠对脲酶酶活有明显的抑制作用,其酶活抑制率为18%。茶叶中含有大量的茶多酚[16-17],许多水果如苹果、桃、李、葡萄等都含有一定量的多酚物质。这些多酚物质基本上可分为简单酚类、酚酸类和黄酮类化合物等。其中,简单酚类物质含量较少,主要包括儿茶酚、对苯二酚和间苯二酚等[18]。从图6中可以发现,儿茶酚对脲酶具有强烈的抑制作用,其酶活抑制率达到83.6%,这与黄光佛的研究结果一致[19]。邱业先[20]等也发现茶多酚对脲酶具有较强的抑制作用。脲酶是一种含镍酶,它有129个半胱氨酰基,47个巯基,其中有4~8个巯基对酶的活性具有重要意义,而酚类物质主要作用于对脲酶活性具有重要意义的巯基[21]。鉴于此结果,脲酶抑制法恐很难用于检测茶饮料中的重金属。
3 结论
本试验采用模拟的方法,研究糖、蛋白质、有机酸、色素等食品成分对脲酶酶活的影响。研究结果表明:
1)葡萄糖、果糖、蔗糖、淀粉对脲酶没有抑制作用,而甜蜜素和安赛蜜却对脲酶有明显的抑制作用。
2)谷氨酸、甘氨酸和L-半胱氨酸表现出抑制作用。酪蛋白和明胶也具有显著的抑制作用,但其实际原因应是二者含有的较多杂质如无机盐所致。
3)酒石酸、苹果酸、柠檬酸、乙酸、乳酸和磷酸均表现出对脲酶的抑制作用,其抑制程度因有机酸的种类和浓度而异。有机酸对脲酶的抑制作用主要是由于有机酸的低pH所引起的。这些有机酸生成相应的盐后,它们对脲酶的抑制作用显著降低。
4)赤藓红、胭脂红、柠檬黄、日落黄和苋菜红对脲酶活性没有影响。
5)氯化钠、山梨酸钾和苯甲酸钠对脲酶活性没有影响,而儿茶酚和亚硝酸钠对脲酶有明显的抑制作用,尤其是0.03%儿茶酚,其酶活抑制率达到83.6%。
综上所述,一些食品成分对脲酶有抑制作用。如果采用脲酶抑制法测定其中的重金属,就容易造成假阳性,使得检测结果不准确。那么如何克服这一难题呢?每个食品生产企业的产品,尽管由于各种原辅料来源不同,其食品成分会有波动,但是每个产品都有其质量标准(国家标准或企业标准),因此其成分还是基本稳定的。如果对一个食品企业的产品建立一个数据库,确定其正常的脲酶酶活范围。如果发现某个食品样品的脲酶酶活超标,就意味着其重金属超标。这时再采用其他仪器复查,就能及时发现重金属污染事件。因此,作为重金属的快检方法,脲酶抑制法仍是可行的。根据本试验结果,脲酶抑制法最适合于检测生活饮用水、矿泉水和纯净水中的重金属。通过测定前溶液pH调整值,脲酶抑制法还可以用于检测碳酸饮料中的重金属。本试验仅研究了单一食品成分单一浓度对脲酶活性的影响,混合食品成分及其浓度对脲酶活性的影响还有待研究。此外,更多的食品成分如增稠剂、乳化剂等也有待研究。
[1] 王明强.重金属污染对食品安全的影响及其对策[J].中国调味品,2009,34(11):32-37
[2] 翟慧泉,金星龙,岳俊杰,等.重金属快速检测方法的研究进展[J].湖北农业科学,2010,49(8):1995-1998
[3] 王菊芳,李志勇.重金属残留的快速检测[J].生物技术,2006,16(2):95-97
[4] 李兴涛,李霞,赵艺欣.免疫测定法检测重金属技术的进展[J].生物技术通讯,2009,20(2):299-302
[5] 谢俊平,卢新.酶抑制法快速检测食品中重金属研究进展[J].食品研究与开发,2010,31(8):220-223
[6] 陆贻通,沈国清,华银锋.污染环境重金属酶抑制法快速检测技术研究进展[J].安全与环境学报,2005,5(2):68-71
[7] Prakash O,Talat M,Hasan S H,et al.Enzymatic detection of mercuric ions in ground-water from vegetable wastes by immobilizing pumpkin(Cucumis melo)urease in calcium alginate beads[J].Bioresour Technol,2008,99(10):4524-4528
[8] Krawczyk T K,Moszczyńska M,Trojanowicz M.Inhibitive determination of mercury and other metal ions by potentiometric urea biosensor[J].Biosens Bioelectron,2000,15(11):681-691
[9]华银锋,陆贻通.脲酶抑制法检测环境样品中重金属离子研究[J].上海环境科学,2003,22(12):939-942
[10]徐晨东,易蕴玉,全文海.利用苯酚-次氯酸盐反应测定铵离子方法的探讨[J].无锡轻工大学学报,1998,17(1):34-38
[11]Krajewska B,Zaborska W.The effect of phosphate buffer in the range of pH 5.80-8.07 on jack bean urease activity[J].J Mol Catal B-Enzym,1999,6(1):75-81
[12]张桂,赵国群,姜娟娟.酶法检测食品中镉离子的研究[J].食品研究与开发,2011,32(4):127-129
[13]杨永新,王加启,卜登攀,等.不同体细胞数牛乳中乳蛋白的比较蛋白质组学研究[J].中国农业科学,2011,44(12):2545-2552
[14]张婉,王覃,杜宁,等.超高效液相色谱法同时测定饮料中5种人工合成色素[J].食品科学,2011,32(4):177-180
[15]李贺,徐幸莲,周光宏.影响低温肉制品褪色因素研究进展[J].食品科学,2011,32(9):307-311
[16]蒋丽,王雪梅,全学军,等.不同提取方法对茶多酚理化性质的影响[J].食品科学,2010,31(14):136-139
[17]侯冬岩,回瑞华,关崇新,等.绿茶及其茶饮料中茶多酚的光谱分析[J].食品科学,2002,2(12):109-111
[18]张泽生,史珅,张颖,等.苹果多酚的研究进展[J].食品研究与开发,2011,32(5):174-178
[19]黄光佛.几种化合物对土壤脲酶活性的影响[J].湖北大学学报:自然科学版,1990,12(2):113-116
[20]邱业先,汪金莲,陈尚,等.茶多酚抑制红壤稻田脲酶及其对水稻生长的影响[J].土壤学报,2003,40(5):460-464
[21]郑福丽,李彬,李晓云,等.脲酶抑制剂的作用机理与效应[J].吉林农业科学 2006,31(6):25-28
