花生红衣中单宁的提取
2014-12-16贾欣欣汪澄梁雨荷段旭宁
贾欣欣,汪澄,梁雨荷,段旭宁
(北京城市学院生物医药学部,北京100094)
花生是一种高营养的食品,含有蛋白质25%~36%,脂肪 40%,还有丰富的 VB2,VA,VD和 VE,还有钙和铁等,是100多种食品的重要原料[1]。花生红衣是花生产品的副产物,我国每年都能产生约600 t,除了少量用于制药外,其余都用作饲料[2]。有资料报道花生红衣中含有大量的单宁,具有抗氧化和阻碍蛋白质糖化反应的作用[3]。
单宁是指植物体内产生的,能使生皮成革的复杂多酚,即鞣质。它能使生物碱、明胶及其他蛋白质沉淀。单宁广泛存在于植物体的叶、壳、果肉及树皮中,不同原料中的单宁,在化学结构上有很大差异,性质也不完全相同,但它们都是多酚类衍生物,因而具有较强的生理活性和一系列独特的化学性质,可广泛用于医药、食品、皮革及印染工业[4]。对于植物单宁已有大量基础和应用研究工作,目前国内外主要从含有单宁的天然植物及植物虫癭五倍子中采用水或其它溶剂提取[5]。
有关于花生红衣中单宁的提取工艺尚未见报道。本文利用正交试验方法对花生红衣中单宁的提取工艺进行了探讨,为花生红衣中单宁的应用提供理论依据,同时为花生的综合利用开辟一条新途径。
1 材料与方法
1.1 材料
洗净、晾干的花生红衣。
1.2 试剂与仪器
1.2.1 仪器
雷兹PHSJ-4F型PH计:上海仪电科学仪器股份有限公司;sp-2000UV型分光光度计:尤尼柯上海仪器有限公司;50 mL容量瓶;DZKW-4恒温水浴锅:上海恬恒仪器有限公司;SHB-Ⅲ循环水式真空抽滤泵:上海卫凯仪器设备有限公司。
1.2.2 试剂
1%FeCl3溶液、0.05%碳酸钠溶液、甲醇、乙醇、丙酮、单宁标准溶液、磷酸、无水碳酸钠、F-D试剂,均为国产分析纯。
1.3 实验方法
花生红衣中的单宁物质,极易溶于有机溶剂,利用其在有机溶剂中的高度溶解性,使用浸提抽滤等提取方法,将单宁溶出。
提取工艺流程如下:
花生红衣→研碎→浸提→过滤→滤液→浓缩→离心→定量
1.3.1 工艺操作过程
将洗净、烘干的花生红衣于研钵中研碎,称取适量研碎的花生红衣,加入提取液,水浴加热;布氏漏斗抽滤,收集滤液,将滤渣加入相同量的提取液,第二次提取抽滤,将2次滤液合并,加热浓缩温度低于80℃,将浓缩后的滤液以 3000 r/min的转速离心10 min,取上清液。稀释后加FeCl3溶液,在340 nm处测得吸光度,根据单宁的标准曲线计算单宁的提取量。
1.3.2 单因素实验
分别选取提取剂、料液比、提取温度、提取时间4个影响因素进行单因素实验。
1.3.3 正交试验
为了验证各单因素间的相互作用效果,选用料液比、提取时间、提取温度3个因素进行三因素三水平正交试验。
2 结果与讨论
2.1 最佳波长的选择
使用标准单宁配制浓度为0.5 mg/ml的单宁标准溶液,量取0.8 mL于50 mL容量瓶中,加入0.5 mL FeCl3(1%)加水定容至50 mL,测定不同波长下的吸光度。以吸光度为纵坐标,波长为横坐标作图,确定单宁标准溶液的最佳波长。
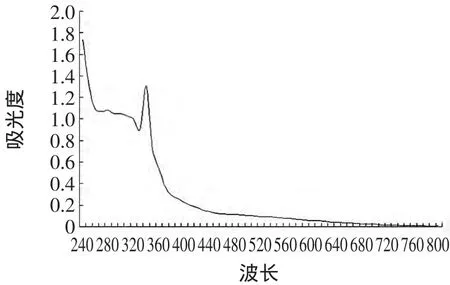
图1 单宁标准溶液的吸收光谱图Fig.1 Absorption spectra of standard tannin solution
2.2 单宁工作曲线的绘制
使用标准单宁配制浓度为0.5 mg/mL的单宁标准溶液,分别量取单宁标准溶液 0.2、0.4、0.6、0.8、1.0 mL,各加入0.5 mL FeCl3(1%)溶液加水定容至50 mL,充分混匀,在340 nm波长处测定吸光度。以单宁溶液浓度为横坐标,吸光度为纵坐标作图,得到单宁标准曲线。
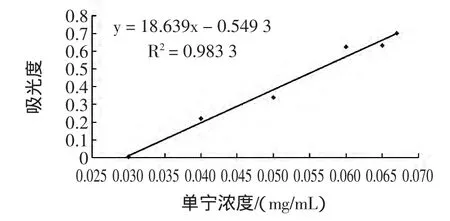
图2 单宁的工作曲线Fig.2 The working curve of tannin
2.3 提取试剂对单宁提取率的影响
分别选用水、甲醇、乙醇、丙酮作为提取剂,对花生红衣的单宁进行提取。结果见表1。

表1 不同溶剂对单宁提取量的影响Table 1 Different solvents on the extraction of tannin influence
从表1可以看出,乙醇作为提取剂,单宁含量较高。
2.4 料液比对单宁提取率的影响
以乙醇作为提取剂,设置不同的料液比,提取花生红衣中的单宁,结果见表2。
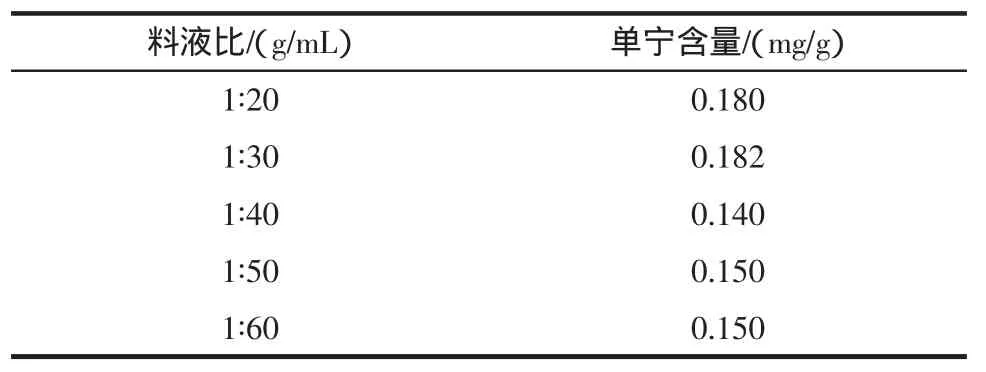
表2 不同料液比对单宁提取量的影响Table 2 Different ratio of liquid and material on the extraction of tannin influence
由表2看出,料液比在1∶30 g/mL时提取量最高。故选择料液比为1∶30 g/mL。
2.5 温度对单宁提取率的影响
选择乙醇作为提取剂,在料液比为1∶30 g/mL的条件下,在适宜的温度范围内,设置不同的温度提督,分别进行提取,结果如表3。
由表3可知,温度在40℃时,提取液中单宁含量最高。因此,选择提取温度为40℃。
2.6 提取时间对单宁提取率的影响
实验设定不同的回流时间,提取工艺如1.3.1。结果见表4。
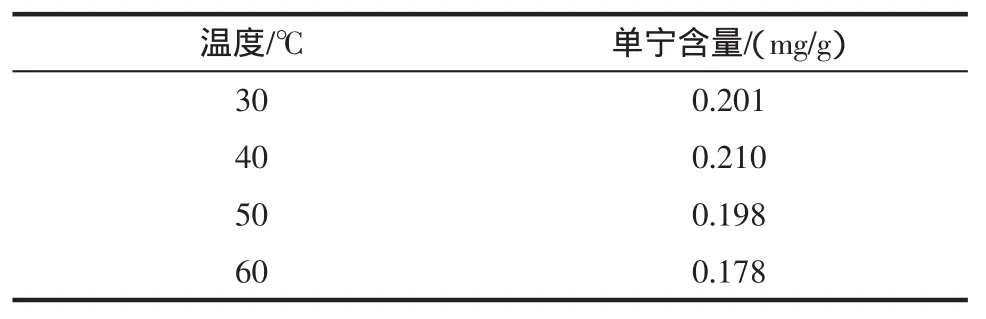
表3 提取温度对单宁提取量的影响Table 3 Different temperature on the extraction of tannin influence
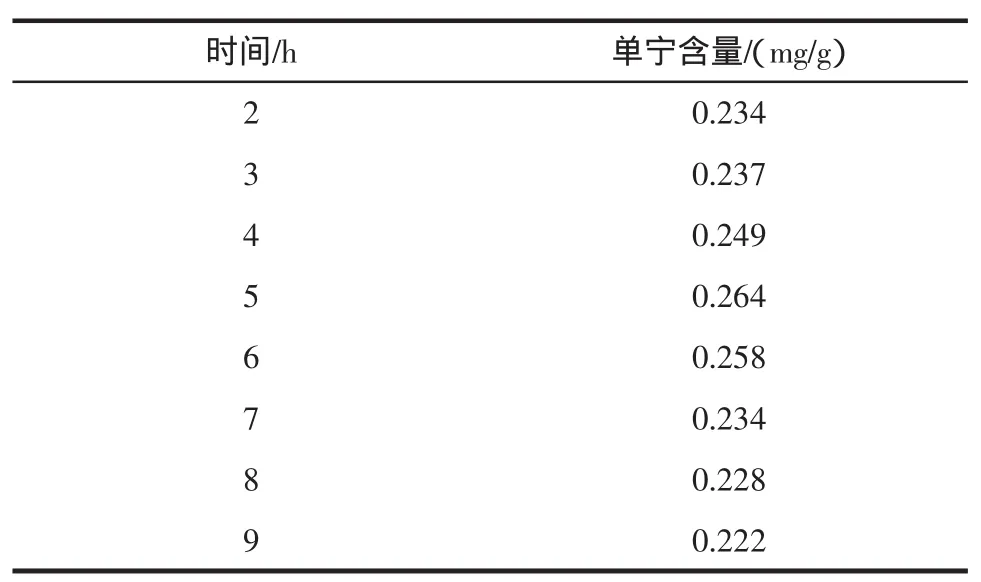
表4 提取时间对单宁提取量的影响Table 4 Different extraction time on the extraction of tannin influence
从表4可知,虽浸提时间的增加,单宁含量增加,5 h后增加不大,随后逐渐降低,说明5 h已将单宁浸提出。长时间浸提使单宁含量下降,是由于单宁复合物在该条件下发生变化。所以根据提取基物的不同可选择经济合理的时间。
2.7 正交试验
选取对单宁得率影响较大的料液比、提取时间、提取温度进行三因素三水平正交试验。结果及极差分析见表5和表6。
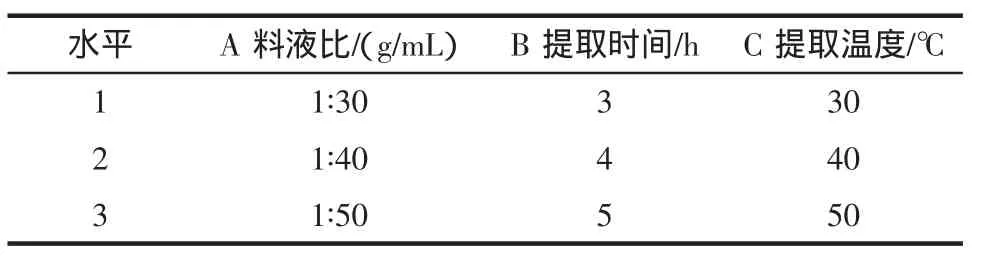
表5 因素与水平表Table 5 Factors and levels
由表5和表6可知,所定的3个因子通过方差分析:
FA=44.5 FB=2.82 FC=0.18
F0.10(2.2)=9.00F0.05(2.2)=19.0F0.01(2.2)=99.0
因素的显著性检验:
F0.01(2.2)>FA>F0.05(2.2);FB<F0.1;FC<F0.1
得出:A显著,B、C不显著。即料液比对产品的得率影响最大,其它因素影响相对较小。花生红衣中最佳提取工艺条件为:料液比1∶30,提取时间5 h,提取温度50℃。

表6 L9(33)正交试验结果Table 6 L9(33)multi-factors orthogonal test
2.8 最佳提取工艺验证试验
为了验证最佳工艺条件需进行验证试验,即在最佳工艺条件下提取3批花生红衣中单宁,单宁含量分别为 0.330、0.331、0.332 mg/g,平均值为 0.331 mg/g,(RSD=0.30%),表明该优化条件稳定有效。
3 结论
本试验研究了提取剂、提取温度、料液比、提取时间等因素对从花生红衣中提取单宁的影响,确定最佳工艺条件为采用无水乙醇作为提取剂,保持50℃的恒温回流,时间为5 h,料液比为1∶30 g/mL的提取结果最佳。该提取方案工艺稳定有效,为进一步合理开发花生红衣中的单宁提供参考数据。
[1] 白永连,邱峰,谢银堂.花生红衣中红色素提取工艺的优化研究[J].贵州农业科学,2009,37(6):190-192
[2] 霍婷,杨惠玲,薛文通,等.花生红衣色素的研究进展[J].食品工业科技,2008,29(11):289-295
[3] 亦森.花生皮生理活性[J].粮食与油脂,2001(4):44-45
[4] 赵立.香蕉皮单宁的提取及抑菌活性研究[J].江苏农业科学,2009(6):369-371
[5] 王川,李光辉.葡萄籽中单宁的提取研究[J].食品研究与开发,2006,27(10):25-27
