细菌脲酶蛋白结构与催化机制
2020-12-21贺越赵圣国张晓音郑楠王加启
贺越 赵圣国 张晓音,2 郑楠 王加启
(1. 中国农业科学院北京畜牧兽医研究所 动物营养学国家重点实验室,北京 100193;2. 华中农业大学动物科学技术学院,武汉 430070)
脲酶(Urease,EC 3.5.1.5)是一种活性中心含有镍离子的金属酶[1],由许多植物、真菌、细菌和一些无脊椎动物合成[2]。脲酶催化尿素分解产生氨和氨基甲酸酯,后者进一步自发地分解产生氨和碳酸氢盐[3]。动物、植物和微生物能利用脲酶催化产生的氨作为养分,促进自身的代谢生长[4]。例如,在反刍动物生产中,瘤胃微生物利用氨合成微生物蛋白,供给机体利用,同时帮助降低蛋白质饲料成本[5]。但是,脲酶也存在诸多不利的影响。反刍动物瘤胃中的微生物脲酶活性过高会使体内产氨速度大于氨的利用速度,极易引起氨中毒[6-7]。人体内一些致病菌能利用分泌的脲酶对机体产生毒害作用,如人胃中的幽门螺杆菌(Helicobacter pylori)脲酶分解尿素产生氨,致使胃中pH升高,促进幽门螺杆菌的生长繁殖,进而引发与胃肠相关的癌症[8]。由此可见,脲酶所具备的独特生物学功能,对动物养殖、人类健康等方面都具有深远的影响。
不同细菌的脲酶基因簇在组成成分上存在一定的差异,但大部分都由结构基因和辅助基因组成,少部分还包含调节基因。由脲酶基因簇编码的脲酶蛋白也分成结构蛋白和辅助蛋白。细菌脲酶结构蛋白包含活性中心,而没有金属离子与活性中心作用的脲酶结构蛋白处于失活的状态,只有当辅助蛋白协助将金属镍传递到活性中心后,脲酶结构蛋白才被激活,从而起到催化尿素分解的作用[9-10]。催化活性依赖镍离子是脲酶的一个独特特征[11],也是脲酶抑制剂开发的一个靶点。因此,本文将从细菌脲酶结构特征、活性中心特征、脲酶催化机制、脲酶抑制剂作用机制4个方面进行综述,以期为脲酶的研究提供参考。
1 脲酶结构蛋白的结构特征
目前蛋白质数据库(Protein Date Bank,PDB)中收录的脲酶结构蛋白晶体结构的总数量为97,而大部分为细菌脲酶,其中产气克雷伯氏菌(Klebsiella aerogenes)脲酶、芽孢杆菌(Sporosarcina pasteurii)脲酶、幽门螺杆菌脲酶分别占总数的35%(34)、23.7%(23)、18.5%(18),在这些晶体结构中包括一些突变的脲酶结构和抑制剂作用下的晶体结构。产气克雷伯氏菌脲酶、巴氏芽孢杆菌(Bacillus pasteurii)脲酶和幽门螺杆菌脲酶是目前研究得较为透彻的3种细菌脲酶。
不同来源的细菌脲酶结构蛋白的亚基数量存在差异,但亚基组成上也存在联系(图1)[12-13]。产气克雷伯氏菌脲酶和巴氏芽孢杆菌脲酶由UreA(γ)、UreB(β)、UreC(α)3个亚基组成,而幽门螺杆菌脲酶则由两个亚基UreA(β)、UreB(α)组成,研究发现幽门螺杆菌脲酶中β亚基和产气克雷伯氏菌脲酶、巴氏芽孢杆菌脲酶中β和γ亚基融合体具有同源性,三者的α亚基具有同源性[14]。尽管脲酶结构蛋白的四级结构存在差异,但是一般都会形成相似的三聚体结构[15]。图2是产气克雷伯氏菌脲酶、巴氏芽孢杆菌脲酶和幽门螺杆菌脲酶的连续剖面图[16],产气克雷伯氏菌脲酶和巴氏芽孢杆菌脲酶由α、β、γ三个亚基聚合形成(αβγ)3形式[13,17],幽门螺杆菌脲酶由α、β二个亚基以[(αβ)3]4形式聚合形成。脲酶结构蛋白的α亚基包括1个TIM(Triosephosphate isomerase,异丙酮酸异构酶)桶状结构和1个β-折叠域;β亚基位于这个三聚物的外表面,以β-折叠为主;γ亚基则既包括α-螺旋也包括β-折叠[18]。幽门螺杆菌脲酶的β亚基有N端和C端域,两个结构域之间由1个短的loop环相连接,位于α亚基的上面和侧面,起着连接3个子单位的作用,3个β亚基的N端以首尾相连的方式连接,从而促使三聚形式的形成[14]。在产气克雷伯氏菌脲酶中,每一个α亚基与2个β和γ亚基相连形成“三角形”的边,并且位于β和γ亚基的中间;每一个β亚基与2个毗邻的α亚基连接,位于“三角形”的角上;每一个γ亚基也与2个α亚基相连,并且与另外2个γ亚基紧密连接[19]。
脲酶结构蛋白亚基的功能目前也有一些研究。通过化学交联质谱的方法对产气克雷伯氏菌脲酶进行研究发现,β亚基上的赖氨酸76(Lys76)与α亚基的赖氨酸382(Lys382)能发生交联,而这两个氨基酸在晶体结构中的位置相距较远,这提示了β亚基可能在与传递镍离子的辅助蛋白相互作用下发生了构象变化,从而使二氧化碳(CO2)和镍离子能更好地进入活性中心[20-21]。通过对产气克雷伯氏菌脲酶的β亚基中的第19个氨基酸进行突变,揭示了β亚基能避免金属离子在进入活性中心前被鳌合,并促进金属离子进入活性中心[22]。

图1 细菌脲酶结构蛋白亚基组成与排布[12-13]
2 脲酶结构蛋白的活性中心及flap区域
2.1 脲酶结构蛋白的活性中心
脲酶活性中心位于结构蛋白中,在催化尿素分解的过程中发挥着重要作用。研究发现,不同来源的细菌脲酶活性中心结构具有很高的相似性,如产气克雷伯氏菌脲酶和芽孢杆菌脲酶[23]。这也提示对不同来源的细菌脲酶结构蛋白活性中心进行比较分析,对开发广谱性微生物脲酶抑制剂化合物有着重要的意义。已知的脲酶的活性中心由高度保守的氨基酸序列[24]、2个金属离子、金属离子配位体组成[25]。金属离子是脲酶的激活剂,只有当金属离子进入活性中心后,脲酶结构蛋白才能被激活。激活脲酶的最有效的金属离子是镍离子,曾有研究用其他金属离子来替代镍离子,发现其他金属离子激活脲酶的效果甚微[26]。脲酶结构蛋白每一个αβγ或每一个αβ亚单位(图2)中含有一个活性中心,活性中心位于α亚基上,每一个活性中心包含2个镍离子(红色球体)。由此可知,一个产气克雷伯氏菌脲酶或巴氏芽孢杆菌脲酶有3个活性中心,包含6个镍离子,一个幽门螺杆菌脲酶有12个活性中心,包含24个镍离子[27]。
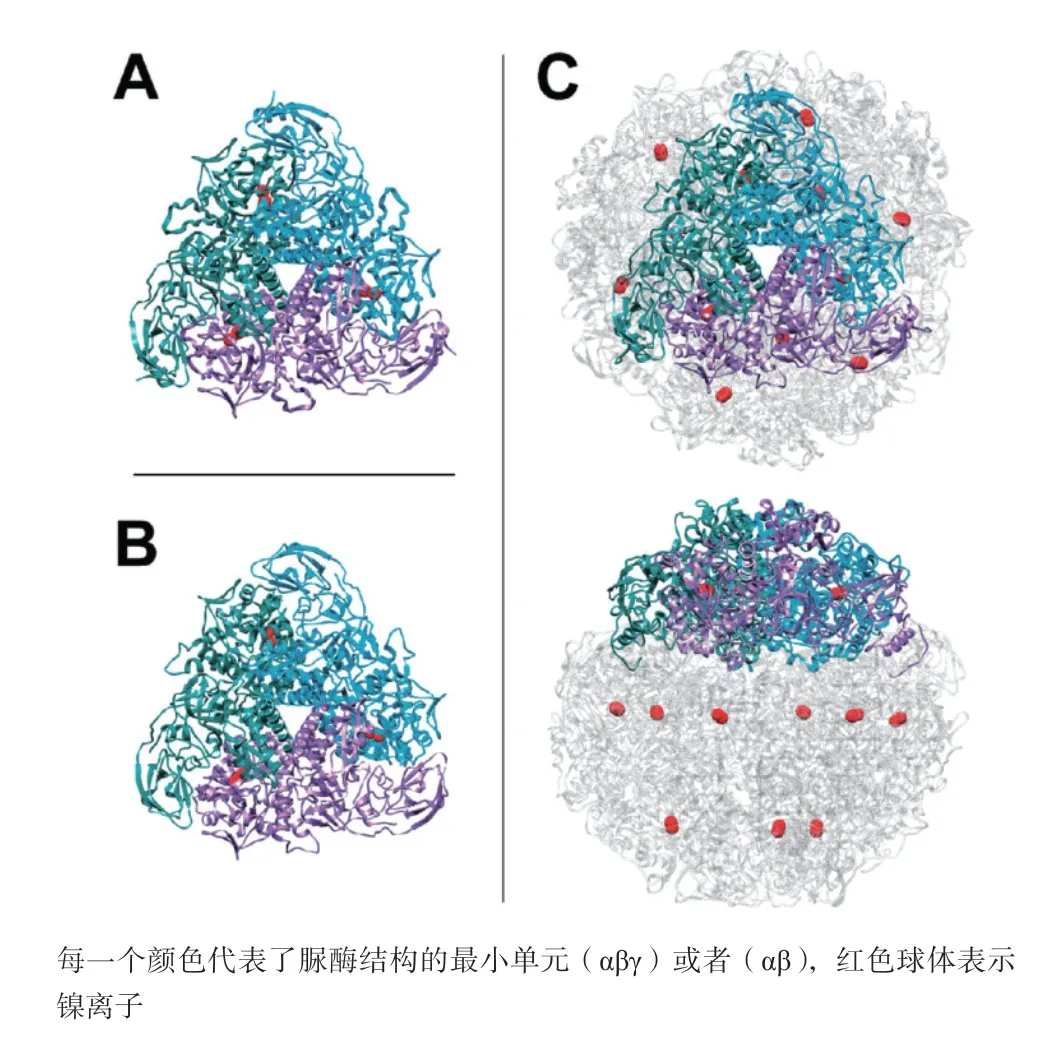
图2 巴氏芽孢杆菌(A)、产气克雷伯氏菌(B)、幽门螺杆菌(C)的脲酶结构蛋白的结构特征[16]
脲酶结构蛋白的活性中心的这两个镍离子称为Ni1和Ni2,两个镍离子由1个氨基酰化的赖氨酸(Lys)残基和1个羟基连接,2个镍离子之间的距离约为3.7 Å,通过突变研究发现,氨基酰化的Lys残基是脲酶活化过程中必不可少的[28-30],除此之外,Ni1还与另外2个组氨酸(His)残基和1个水分子配位,而Ni2除了与2个His残基和1个水分子配位外,还有一个天冬氨酸(Asp)与之配位[31-32](图3),连接2个镍离子的羟基与3个水分子(2个与镍离子配位)一起在活性中心形成了1个四面体[33]。
通过定点突变的方法,用丙氨酸(Ala)对产气克雷伯氏菌脲酶活性中心的His、Asp进行替换,结果发现当活性中心αHis134、αHis136、αHis246等与镍离子相结合的氨基酸以及镍离子周围的αHis219、αAsp221等氨基酸发生突变后,脲酶的活性显著降低,这一结果的原因可能是与镍离子配位的氨基酸发生突变后使镍离子与活性中心的配位发生改变,进一步改变了脲酶活性,而αHis219本身与促进底物与镍离子的结合有关[34-35],发生突变后,致使底物与镍离子的结合能力降低,从而反映出脲酶活性的降低。
2.2 flap区域
在脲酶催化过程中,除活性中心氨基酸残基发挥作用外,活性中心附近的半胱氨酸(Cys)形成了一个柔性、可移动的flap区域(图4)[16]。这个flap区域覆盖在活性中心上,由螺旋-转角-螺旋结构域组成,通过运动控制一个His残基来调控底物的进入和产物的排出[18,36]。在催化过程中,flap区域的氨基酸残基主要通过氢键与底物结合,从而起到稳定催化过渡状态、加速催化反应的作用[37]。用Ala对产气克雷伯氏菌脲酶flap区域的Cys319进行替换,脲酶活性显著下降,验证了Cys319 在脲酶催化中起着重要的作用[38]。
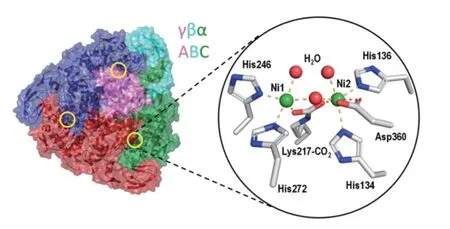
图3 产气克雷伯氏菌脲酶活性中心[12]
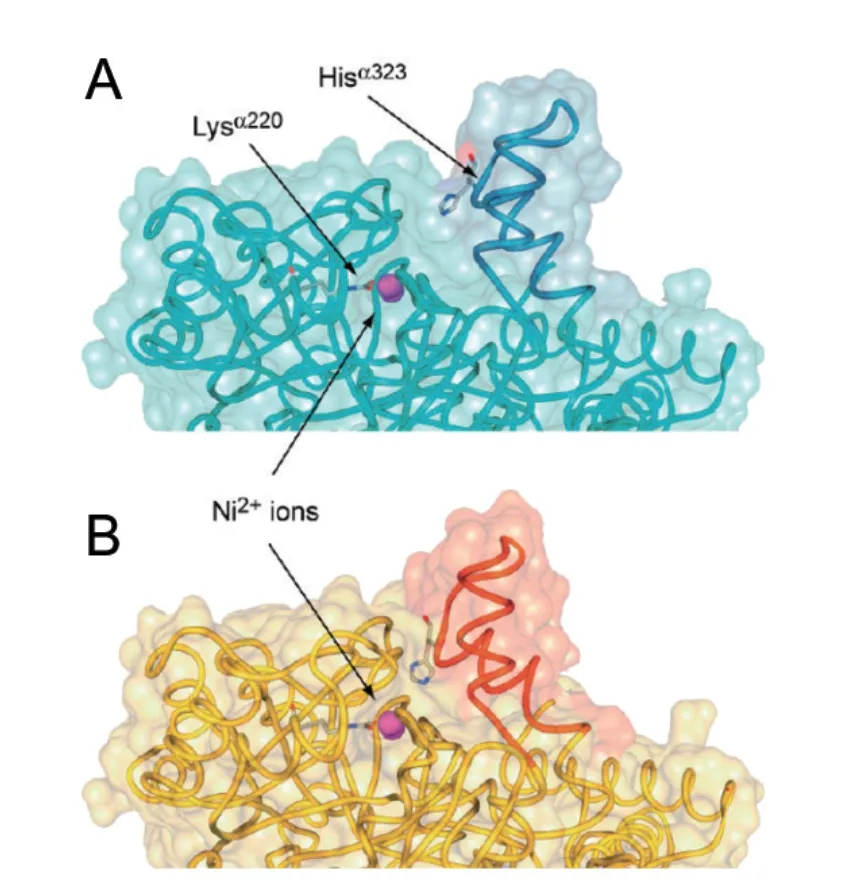
图4 脲酶flap区域开放(A)和关闭(B)[16]
3 脲酶的催化机制
脲酶催化尿素分解的机制一直以来都颇受争议[39-40],随着脲酶抑制剂的研究的深入,有一种催化机制获得了广泛的认可[41-42]。该机制[43]是:脲酶被镍离子激活后,其flap区域打开,允许底物尿素进入活性中心,然后尿素取代活性位点的3个水分子(图5-A),即尿素的羰基氧与Ni1离子结合,这种结合使尿素的碳更亲电,因此更容易发生亲核攻击(图5-B),当尿素与Ni1结合后,flap区域关闭,即整个催化过程与外界隔离。然后,尿素氨基氮原子与Ni2结合,这就使得尿素与脲酶形成双齿配位(图5-C),这种结合有助于连接两个镍离子的水分子亲核攻击尿素的羰基碳,使尿素中的O=C双键发生断裂(图5-D),亲核攻击促使NH3和氨基甲酸酯的形成,而后flap区域打开,将催化产物释放出来(图5-E),flap区域的打开让下一个尿素分子进入活性中心,从而进行下一个催化反应[44]。但是目前这种催化机制也尚存在一点争议,主要争议点是,Benini等[40]提出的这个机制中认为亲核攻击是通过连接两个镍离子的氢氧根来为NH3提供质子的,但Karplus等[39]认为是flap区域的一个His残基起到质子化作用。另外,Karplus等[39]还考虑了一种催化机制,即尿素与Ni1和Ni2单齿结合,而两个镍离子提供的水分子亲核攻击尿素羰基碳。
4 脲酶抑制剂作用机制
脲酶抑制剂可以对脲酶的活性进行调控[45-46]。目前已知的脲酶抑制剂种类繁多,根据脲酶与抑制剂的结构特征可大致分为两类:(1)与脲酶活性中心镍离子相互作用的脲酶抑制剂,如尿素类似物[47]、氧肟酸类[48]、磷酸二酰胺及其衍生物[49]等;(2)与flap区域保守的氨基酸相互作用的脲酶抑制剂,如1,4-苯醌[50]、邻苯二酚[51]、一些重金属离子[52]等。尽管存在多种脲酶抑制剂,但是目前只有乙酰氧肟酸可用于治疗幽门螺杆菌引起的胃和尿道感染疾病,它也是目前市场上唯一的商用抑制剂。
脲酶抑制剂与脲酶活性中心相互作用的机制分成两种,一种是以硫脲为代表的尿素类似物,这类小分子的结构往往大于尿素分子,其结构中含有尿素结构部分,这就使得尿素类似物能像尿素一样与脲酶结合,其结合机制和尿素结合到脲酶的过程一样,区别在于脲酶不能分解尿素类似物[53]。另一种是磷酸二酰胺及其衍生物类脲酶抑制剂,这类小分子的结构与底物没有相似性,它本身不与脲酶活性中心结合,而是通过分解成其他中间产物来发挥作用,也称为“机械性抑制剂”。Mazzei等[54]通过X-射线晶体衍射技术(X-ray)获得了在正丁基硫代磷酰三胺(N-(n-butyl)thiophosphoric triamide,NBPT)作用下的SPU晶体结构,其分辨率达到了1.28 Å,并从结构角度揭示了NBPT能够与脲酶活性位点中的镍离子相互作用,进行原位水解,生成一个四面体结构的分子(MATP)阻断活性位点(图6)。Benini等[40]也通过X-ray获得了苯基磷二酰胺(Phenylphosphorodiamidate,PPD)与巴氏芽孢杆菌脲酶相互作用的晶体结构,他们发现,在PPD作用下,巴氏芽孢杆菌脲酶活性中心与镍离子相互作用的氨基酸残基位置和天然状态下没有显著差异,根据结构显示,实际与活性中心发生结合的不是PPD,而是其一种产物DAP,它是一个四面体分子。电子密度揭示了这个四面体形状的分子精确地取代了天然巴氏芽孢杆菌脲酶中的4个水/氢氧根分子簇,通过3个原子与活性中心结合:一个对称地桥接两个镍离子,而另两个分别与一个镍离子结合。
1,4-苯醌、邻苯二酚及一些重金属离子及其衍生物对脲酶的抑制作用机制是金属离子作用在活性中心周围的flap区域。有研究对1,4-苯醌抑制作用下的芽孢杆菌脲酶的晶体结构进行分析,得到了分辨率为2.07 Å 的脲酶晶体结构,发现1,4-苯醌共价结合脲酶flap区域的Cys322,阻碍flap区域的活动,从而起到抑制脲酶活性的作用[50],而邻苯二酚的抑制机制与1,4-苯醌相类似[51]。Mazzei等[55]获得了分辨率为2.14 Å 的金离子(Au3+)抑制芽孢杆菌脲酶的晶体结构,发现两个Au3+与flap区域的Cys322、His323、Met367三个氨基酸残基结合,两个Au3+由Cys322连接起来,其中一个Au3+与His323结合,另一个Au3+与Met367结合,Cys322、His323能调节调节活性中心空腔大小和催化相关的关键氨基酸残基的位置,而Met367位于面对flap区域的一个loop环上,Au3+与这3个氨基酸残基的结合阻碍了flap区域的活动,从而抑制了脲酶的催化活性,晶体结构分析也发现Au3+的存在对金属离子所在的活性中心没有显著影响(图7),而银(Ag)的衍生物对芽孢杆菌脲酶的抑制机制同Au3+类似[56]。
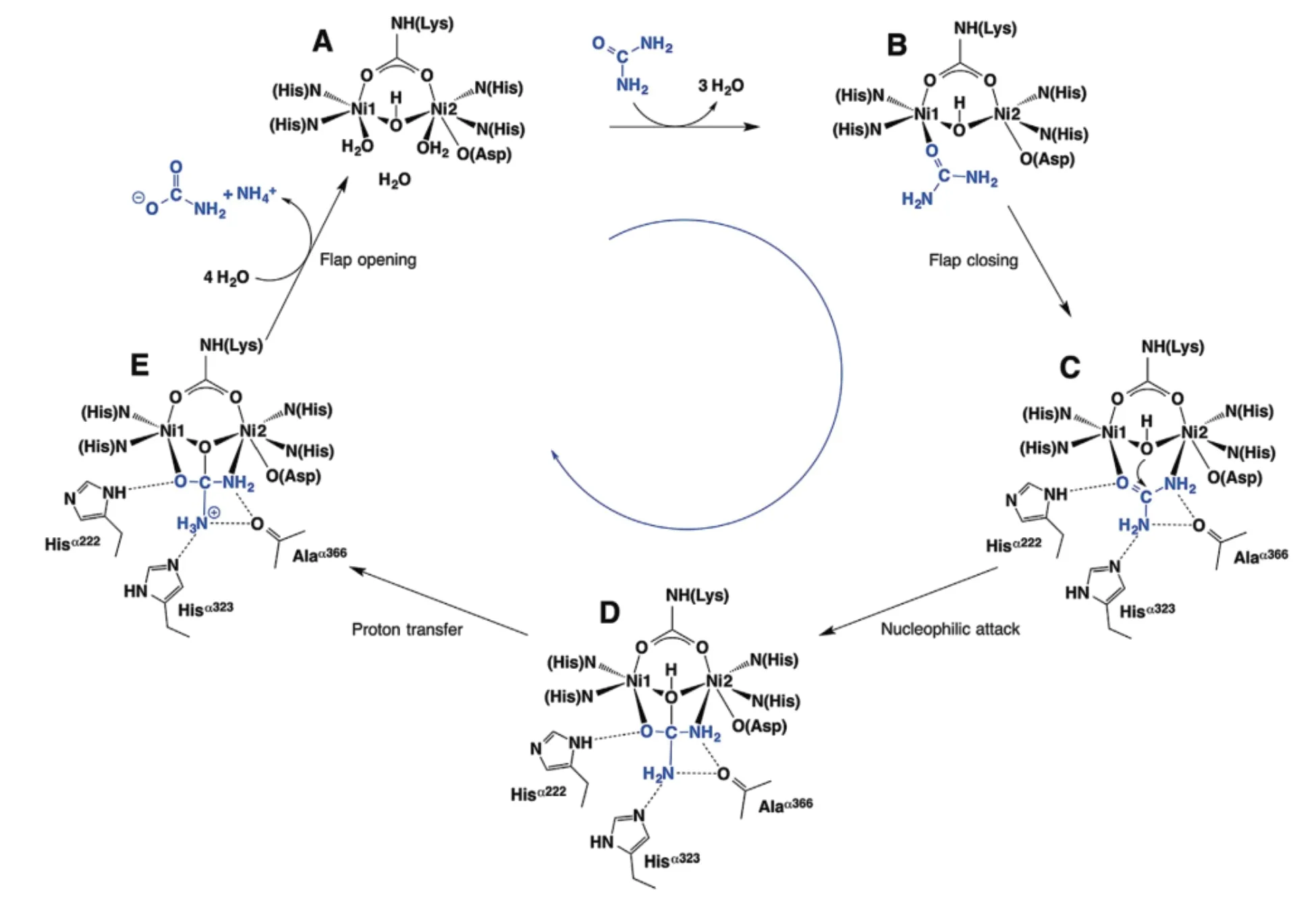
图5 脲酶的催化机理[43]
5 总结
目前运用晶体结构学的手段已经获得了多种来源的细菌脲酶结构蛋白的晶体结构。虽然不同来源的脲酶结构蛋白的组成上存在差异,但是发生催化反应的活性中心及周围的flap区域却极为相似,底物与活性中心的镍离子相互作用后被分解,而脲酶抑制剂可以通过与镍离子或者flap区域相互作用来达到抑制脲酶活性的效果。虽然目前对于脲酶的研究已经很多,但仍需要对以下几个方面的问题进行探索。
一是组成脲酶结构蛋白的各个亚基的结构及功能的研究。目前很少有对不包含活性中心的各个亚基的结构的研究。另外,各个亚基彼此之间是通过什么样的结合方式相互作用,而这种相互作用对于金属离子传递进入活性中心的意义是什么都需要深入研究。
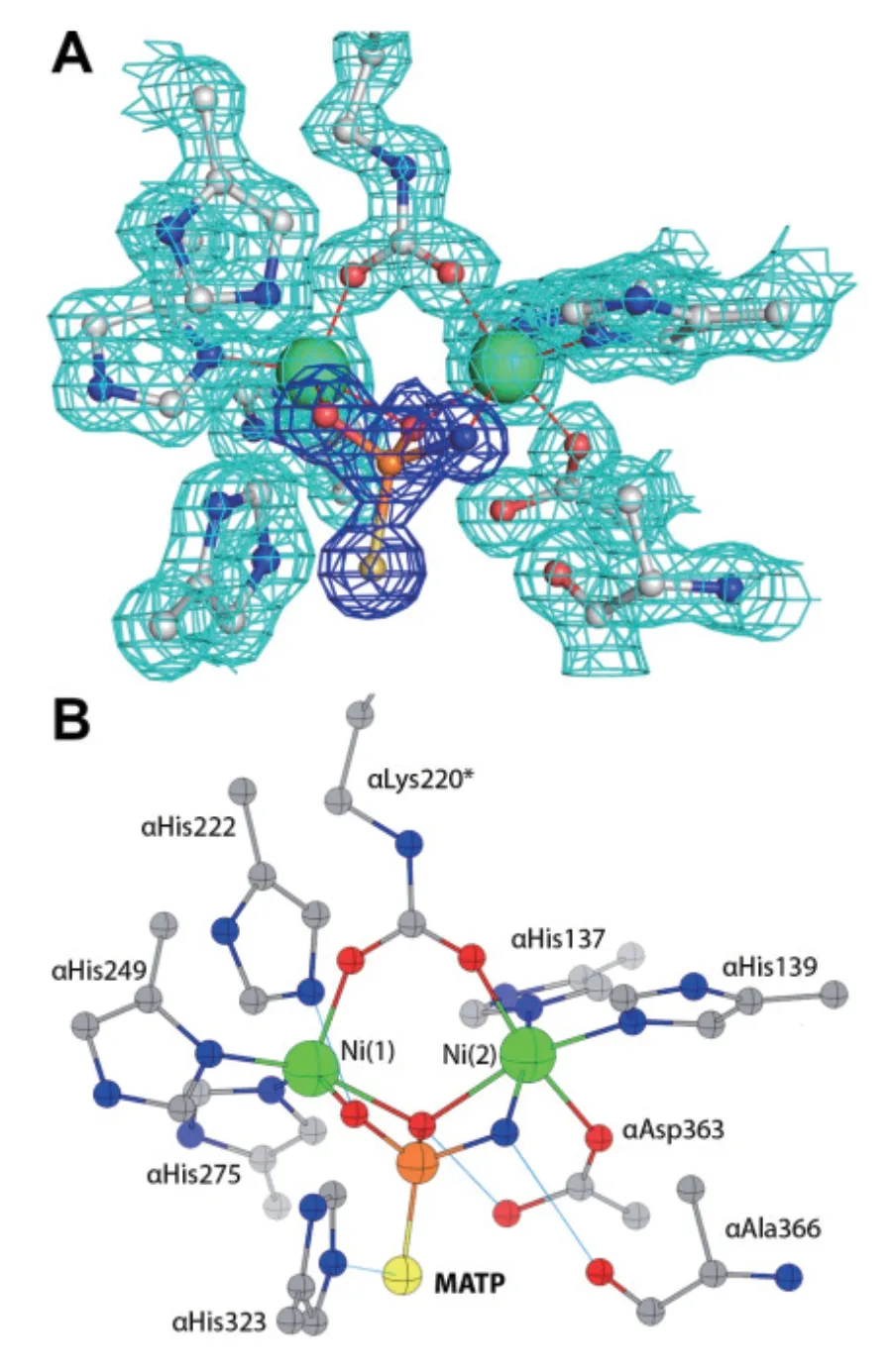
图6 MATP结合SPU活性位点的原子模型[54]
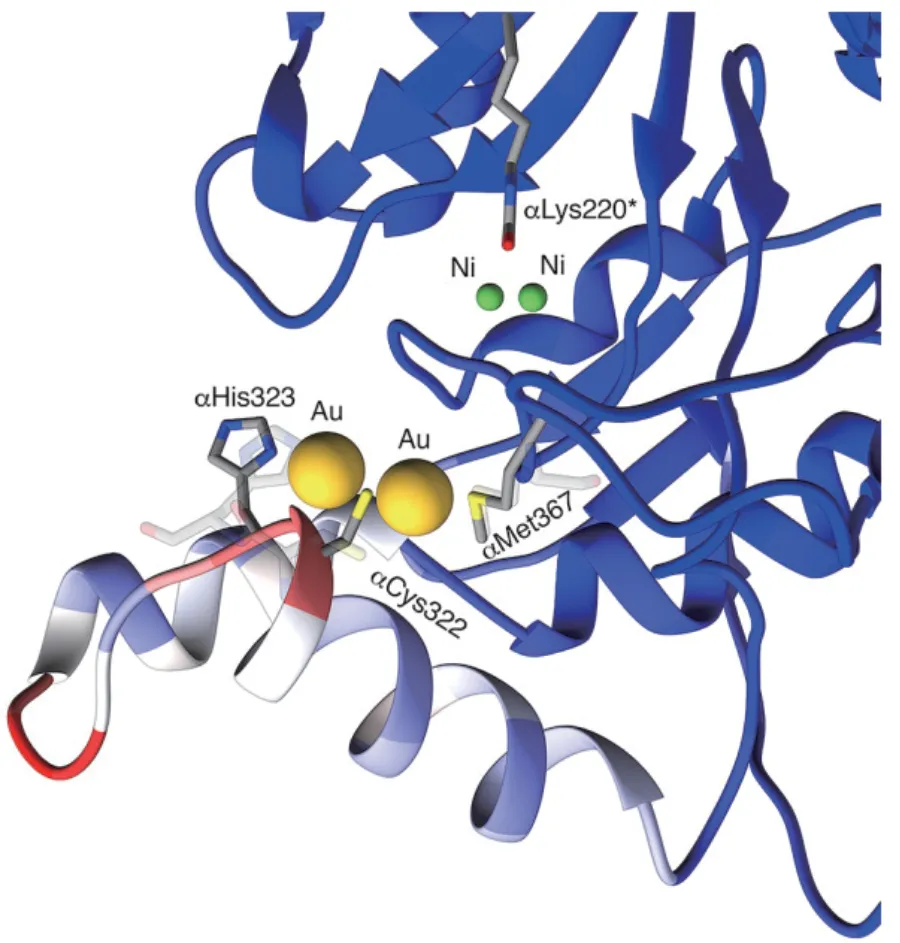
图7 Au3+与芽孢杆菌脲酶相互作用[55]
二是对更多来源的细菌脲酶进行研究。本实验室长期对奶牛瘤胃微生物进行研究发现,瘤胃微生物种类繁多,微生物脲酶蛋白来源具有多样性,有哪些微生物能产生脲酶呢,而这些脲酶基因是如何表达的,瘤胃微生物脲酶的结构同已知的脲酶结构上是否存在差异等问题还未解决。对不同来源的微生物脲酶进行定向的研究,更有利于对脲酶的活性进行有效的调控。
三是基于脲酶晶体结构开发新型脲酶抑制剂。脲酶研究的最终目的是有效地调控它的活性,脲酶抑制剂的开发依赖于脲酶结构的解析。目前所得的脲酶结构几乎都是通过X-射线晶体衍射技术得到的,运用冷冻电镜技术解析脲酶的结构是否会有不同的发现呢,而新开发的脲酶抑制剂如何进行有效的生理评价等问题尚待研究。
