HBx基因通过调节凋亡相关蛋白Bax/Bcl⁃2比值促进人肾小管上皮细胞凋亡
2014-12-03何平李红李德天冯国和
何平,李红,李德天,冯国和
(中国医科大学附属盛京医院1.肾内科;2.心内科;3.感染科,沈阳 110004)
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球范围内重要的公共卫生问题之一。据估计全球范围内有3.5亿人是慢性HBV携带者[1]。长期以来中国、东南亚和热带非洲为高流行区。自1971年Combes等首先描述了第1例具有持续HBsAg血症的患者发生了膜性肾病(MN)以来,肾小球肾炎已被公认为是HBV感染引起的最常见肝外病变,又称乙型肝炎病毒相关性肾炎(HBV⁃associated glomerulo⁃nephritis,HBVGN)。既往认为,HBVGN的发病机制是HBV抗原和抗体形成的循环免疫复合物和原位免疫复合物在肾组织的沉积。但目前认为,HBV因其泛嗜性而直接感染肾组织细胞,产生病毒的杀细胞效应,也是HBVGN重要的发病机制之一,同时也是使用核苷类药物的理论基础[2]。
既往认为,HBVGN以肾小球损害为主,但近年肾小管—间质损害也日益引起重视。肾小管上皮细胞凋亡与增殖之间的不平衡可能是导致HBVGN中肾小管萎缩和肾功能恶化的重要机制之一[3]。在针对HBVGN患者肾穿刺病理研究中,发现HBVGN患者肾组织中凋亡细胞明显增多。肾小管的凋亡细胞明显多于肾小球,多数分布于近端、远端肾小管及集合管上皮细胞,肾间质也有少量凋亡细胞分布。同时凋亡相关蛋白Bax/Bcl⁃2也发生了相应的变化[4,5]。证实了肾小管上皮细胞凋亡也是HBVGN重要的病理改变之一。但HBVGN中肾小管上皮细胞凋亡的机制并不明确。HBx基因是HBV基因组中最小的开放性编码框,编码长度为154个氨基酸的蛋白。现已知HBx是一种多功能蛋白,具有反式激活功能,在培养细胞中表达后,它可在细胞质刺激信号转导途径和细胞核内的转录因子起到转录激活作用参与宿主细胞增殖或凋亡过程[6~9]。HBx在HBVGN发病中的作用和机制目前已成为HB⁃VGN发病机制研究中的热点问题之一[10~12]。张瑜等[13]将HBx真核表达载体转染至足细胞,发现HBx基因可抑制足细胞的增殖并促进其凋亡。但HBx基因对肾小管上皮细胞增殖及凋亡的影响,国内尚未见报道。
在本研究中,我们通过构建HBx基因真核表达载体,研究其对体外培养的人肾小管上皮细胞(HK⁃2)的生物学行为的影响及可能机制,为进一步深入研究HBx基因在HBVGN发病机制中的作用打下坚实的基础。
1 材料与方法
1.1 质粒及细胞株
质粒pCDNA3.1⁃HBx由本室构建、保存。HK⁃2细胞株购自北京中原公司(美国ATCC中国大陆总代理)。
1.2 主要试剂
兔抗HBx单克隆抗体购自Chemicon公司;Bcl⁃2、Bax多克隆抗体购自Santa Cruz公司。CCK8及AnnexinV/PI双染试剂盒购自南京凯基生物科技发展有限公司。
1.3 质粒转染、实验分组
采用脂质体转染法,应用Li PofectamineTMLTX&PLUSTM转染试剂(美国Invitrogen公司),按照说明书步骤进行转染。在实验中,应用与PcDNA3.1(+)HBx大小接近的PEGFP⁃C1荧光质粒共转染,评估目的质粒转染效率。将培养瓶中生长处于对数生长期的肾小管上皮细胞接种在24孔培养板中,每孔500 μL,细胞数约1×105μL。次日清晨观察培养板中的细胞生长良好,达到80%~90%融合。根据质粒及转染试剂比例不同,设置3个组别。第1组:1 μ g质粒+2 μL PLUS∶2 μL LTX;第2组:1 μg质粒+2 μ L PLUS∶3 μL LTX;第3组:1 μg质粒+2 μL PLUS∶4 μ L LTX。24 h后,荧光显微镜下观察转染效率。每孔随即取10个视野,在同个视野内通过将荧光跟白光对比,然后细胞计数,按荧光/白光细胞数×100%得出转染效率。
细胞实验分5组:(1)对照组(control);(2)转染空质粒PCDNA3.1(+)组(PCDNA3.1+);(3)转染质粒PCDNA3.1(+)HBx 24 h组(24 h);(4)转染质粒PCDNA3.1(+)HBx 48 h组(48 h);(5)转染质粒PCD⁃NA3.1(+)HBx 72 h组(72 h)。
1.4 免疫细胞化学
各组细胞在盖玻片上生长融合达到85%~95%时,从孵箱中取出。用PBS洗后,4%的甲醛固定。0.5%Triton X⁃100 37℃温箱透化20 min。血清封闭后,分别加一抗 Bcl⁃2(1∶160)、Bax(1∶320)湿盒里,4℃过夜。PBS洗后,加相应二抗。滴加生物素酶后,DAB显色,苏木素复染,返蓝。脱水、透明、封片、观察。
1.5 Western印迹
实验各组细胞胰酶消化,收获细胞后,用含有PMSF的RIPA裂解液提取细胞总蛋白。细胞提取物用BCA法测定浓度。等量上样,用12%的SDS⁃PAGE凝胶电泳分离。之后将蛋白转移至PVDF膜上。封闭后,分别加入一抗:HBx(1∶1 000,Chemicon公司)、Bcl⁃2(1∶500,Santa Cruz公司)、Bax(1∶1 000,Santa Cruz公司),4℃摇床孵育过夜。加入相应二抗,进行ECL反应。一次性完成定影、显形、图像分析系统测定条带的灰度值。
1.6 细胞增殖测定
CCK8法检测HBx基因对HK⁃2细胞增殖的抑制作用。消化收集细胞并接种于3张96孔板。接种过夜后,分别为对照组、转染空质粒组、转染PCD⁃NA3.1(+)HBx组。细胞在培养箱中分别培养24 h、48 h、72 h。结束培养前2 h每孔加CCK8 10 μL,继续培养2 h。酶标仪检测波长450 nm的每孔光密度值(OD值)。细胞生存率、增殖抑制率按如公式计算:生存率=(实验组OD值/对照组OD值)×100%,抑制率=(1-实验组OD值/对照组OD值)×100%。
1.7 细胞凋亡测定
对数生长期HK⁃2细胞接种于6孔板,后转染空质粒及PCDNA3.1(+)HBx,分别于培养箱中继续培养24 h、48 h、72 h后,直接在倒置显微镜下观察。
应用AnnexinV⁃FITC/PI双标记流式细胞术定量检测各组细胞凋亡。用无EDTA胰酶消化收集各组细胞。离心、PBS洗涤细胞3次。用500 μL 1×Binding Buffer悬浮细胞,浓度大约为1×106/mL。在细胞悬浮液中加入5 μL AnnexinV⁃FITC轻轻混匀,4℃冰箱避光孵育30 min。加入5 μL PI后轻轻混匀4℃避光条件下孵育5 min。随即用流式细胞仪上机检测(最迟1 h内)。结果用Cellquest专业软件获取分析数据。AnnexinV⁃FITC/PI双标记流式细胞术可将实验样本中正常、坏死、凋亡细胞区分开。以FITC和PI荧光作双参数点图,细胞分为4个象限,左下象限:AnnexinV⁃FITC⁃、PI⁃,代表正常活细胞;左上象限:AnnexinV⁃FITC⁃、PI+,代表机械损伤细胞;右下象限:AnnexinV⁃FITC+、PI⁃,代表早期凋亡细胞;右上象限:AnnexinV⁃FITC+、PI+,代表晚期凋亡/坏死细胞。分别计数各组细胞凋亡率并进行组间比较。
1.8 统计学分析方法
2 结果
2.1 目的质粒PCDNA3.1(+)HBx的转染效率评估
通过PEGFP⁃C1的转染效率评估PCDNA3.1(+)HBx的转染效率,可见第3组转染效率最高,大概为40%~60%,后续实验按照此孔量进行转染。结果见图1。

图1 各组转染效率比较 ×100Fig.1 Comparison of transfection efficiency in each group×100
2.2 HBx基因转染后在HK⁃2细胞中的表达
转染PCDNA3.1(+)HBx 24 h、48 h及72 h组在预期的17 kDa出现一条明显条带。表明HBx基因在HK⁃2细胞得到了表达。转染目的基因24 h及48 h,蛋白表达量无明显区别(P>0.05)。转染目的基因72 h后,蛋白表达水平最高,与24 h、48 h比较,差异有统计学意义(P<0.05)。空载体转染及未转染组未见相应蛋白条带,结果见图2。
2.3 转染HBx基因后,凋亡相关蛋白Bax/Bcl⁃2比值显著增高
细胞免疫化学方法检测各组细胞Bcl⁃2、Bax表达。Bcl⁃2在各组细胞中均有表达。在对照组、转染空质粒组均呈高水平表达,两组之间无统计学差异(P>0.05)。转染Pc⁃DNA3.1(+)HBx 24 h后,Bcl⁃2表达水平开始下降,Bax表达水平明显上升,Bax/Bcl⁃2比值显著增高,至转染后72 h,升至最高。转染Pc⁃DNA3.1(+)HBx各组间及与对照组比较,差异有统计学意义(P<0.05),见图3,图4。
WB方法检测Bcl⁃2、Bax表达。在对照组、转染空质粒组均呈较高水平表达,2组之间无统计学差
异(P>0.05)。转染Pc⁃DNA3.1(+)HBx 24 h后,Bcl⁃2表达水平开始下降,Bax表达水平开始增加,Bax/Bcl⁃2比值显著增高,至转染后72 h,升至最高。转染Pc⁃DNA3.1(+)HBx各组间及与对照组比较,差异有统计学意义(P<0.05),见图5、图6。

图3 对照组、转染空质粒组及转染HBx 24 h、48 h、72 h后各组细胞免疫化学Bcl⁃2表达 ×200Fig.3 Immunohistochemical analysis of Bcl⁃2 expression in the each group ×200

图4 对照组、转染空质粒组及转染HBx 24 h、48 h、72 h后各组细胞免疫化学Bax表达 ×200Fig.4 Immunohistochemical analysis of Bax expression in each group×200
2.4 转染HBx基因后,对HK⁃2细胞增殖抑制作用
转染空质粒组细胞存活率与对照组无明显差别(P>0.05),提示对细胞无明显增殖抑制作用。转染PCDNA3.1(+)HBx24 h后,对细胞的增殖有明显抑制作用,达到(14.08±2.14)%,与对照组相比,差异具有显著性(P<0.05)。转染PCDNA3.1(+)HBx 48 h后,细胞的增殖抑制率显著增加,达到(31.33±2.24)%,与对照组、转染PCDNA3.1(+)HBx24 h比较,差异有统计学意义(P<0.05)。转染72 h后,细胞的增殖抑制率达到(35.27±1.10)%,与对照组、转染PCDNA3.1(+)HBx 24 h比较,差异有统计学意义(P<0.05);但与转染48 h比较无明显差异(P>0.05)。
2.6 转染HBx基因后,引起HK⁃2细胞凋亡
倒置显微镜观察各组细胞形态变化。对照组细胞及转染空质粒组细胞密度较大,形态基本正常;而转染PCDNA3.1(+)HBx后各时间点各组出现细胞增殖受抑,细胞密度变小;凋亡细胞的体积变小、变圆,细胞出现皱缩、脱落,见图7。

图5 各组细胞Bcl⁃2、Bax的Western⁃blot条带Fig.5 Western blot bands of Bcl⁃2 and Bax in each group

图6 各组细胞Bax/Bcl⁃2比值Fig.6 The ratio of Bax/Bcl⁃2 in each group

图7 倒置显微镜观察各组细胞形态 ×100Fig.7 Cell morphology in each group using inverted microscope×100
流式细胞仪检测HBx基因对细胞凋亡的影响。对照组HK⁃2细胞凋亡率为(5.82±1.62)%;转染空质粒组细胞凋亡率为(5.91±1.09)%;转染PCD⁃NA3.1(+)HBx 24 h组细胞的凋亡率为(15.12±1.98)%;转染PCDNA3.1(+)HBx 48 h组细胞的凋亡率(21.62±2.23)%;PCDNA3.1(+)HBx 72 h组细胞的凋亡率为(23.80±2.16)%。转染空质粒组凋亡率较对照组无明显变化。转染PCDNA3.1(+)HBx后各组细胞的凋亡率较对照组凋亡率均显著增高,差异有统计学意义(P<0.05)。转染48 h较转染24 h组凋亡率显著增高,差异有统计学意义(P<0.05)。但转染48 h与转染后72 h无统计学差异,见图8、图9。

图8 流式细胞仪检测各组细胞凋亡率Fig.8 Apoptosis rates in each group as determined by flow cytometry
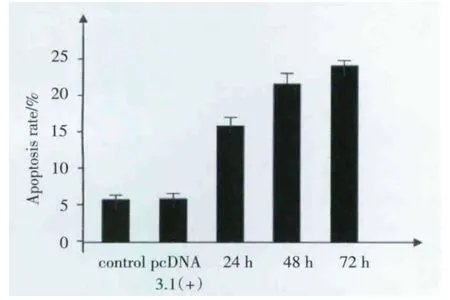
图9 各组细胞凋亡率比较柱状图Fig.9 Comparison of the apoptosis rates in each group
3 讨论
HBVGN是中国儿童继发性肾脏损害最常见的病因[14],近年来研究报道HBV相关核酸分子在肾组织的存在和意义,发现HBVGN患者肾脏中存在HBV⁃DNA,HBV⁃RNA 和闭合环状双链DNA(cccD⁃NA),甚至完整的病毒颗粒[15~17],进一步支持了HBV可直接感染肾脏并原位复制而致病的观点。
本实验成功构建了HBx基因的真核表达载体PCDNA3.1(+)HBx,为进一步研究HBx对肾脏固有细胞的作用及其在HBVGN发病中的作用和意义奠定了重要基础。
现有的研究表明,HBx蛋白与细胞凋亡有密切关系。然而,针对不同种类的细胞及不同的外界条件,HBx调节细胞凋亡的作用及机制也各不相同[18]。HK⁃2细胞是正常人近端肾小管上皮细胞株,具有人类肾小管上皮细胞的标志及生理、生化特性本研究以体外培养的HK⁃2细胞株为研究对象,通过应用CCK8、透射电镜及流式细胞仪等检测方法探讨HBx基因对HK⁃2增殖和凋亡的影响。结果发现,转染HBx基因后,抑制了HK⁃2细胞的增殖、促进了其凋亡。在转染后72 h,HK⁃2细胞凋亡率最高。我们的研究证明了HBx基因可以导致体外培养的肾小管上皮细胞发生凋亡,从而更深入研究凋亡相关蛋白Bax及Bcl⁃2的表达。
细胞凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞程序性死亡,是从细胞外信号—细胞内信号通路—凋亡相关基因和酶的复杂过程[19]。研究表明,多种肾脏疾病的发生和发展除与细胞凋亡有着密切关系外,还伴随着凋亡相关基因表达的变化[20,21],Bcl⁃2家族的成员是细胞凋亡整合期决定细胞生存和死亡信号至关重要的整合因子,其中Bcl⁃2是一种抗凋亡蛋白;而Bax与Bcl⁃2的作用相反,是一个典型的促凋亡蛋白。因此Bax和Bcl⁃2二者的表达水平及Bax/Bcl⁃2比值则成为影响细胞生存的重要因素。Bax/Bcl⁃2比值增高决定了细胞走向死亡并进入细胞凋亡的执行期,通过一系列复杂的级联反应及细胞内的信号传导途径导致细胞的凋亡[22]。在糖尿病肾病和梗阻性肾病动物模型中已检测到凋亡蛋白Bax/Bcl⁃2的异常表达。在原发性肾脏疾病患者的肾组织中也发现Bax的表达随肾小管间质病变的加重而增加。环孢素A所致肾毒性机制研究及实验性肾小管坏死(ATN)模型中,发现肾小管上皮细胞Bax表达增加[23]。在急性肾小管排异的研究中发现小管上皮细胞Bcl⁃2表达水平下降,Bax表达水平上升,同时伴随细胞凋亡的增加。提示凋亡相关基因Bcl⁃2和Bax在原发和继发性肾脏疾病的进展中起着重要作用。孙莉静等[4]分析HBV⁃GN患者肾脏病理资料时发现,HBV⁃GN患者较对照组肾细胞凋亡指数明显增加,凋亡细胞多分布于近端、远端肾小管及集合管上皮细胞。HBV⁃GN患者Bcl⁃2主要在肾小管上皮细胞表达;Bax在肾小球、肾小管均有表达,与对照组相比,Bax表达水平明显上升。提示在HBVGN中,伴随着凋亡细胞增加,凋亡相关蛋白Bax及Bcl⁃2表达水平也发生了相应的变化。
本实验结果显示,转染HBx基因24 h后,Bcl⁃2表达水平显著下降,Bax水平显著增加,Bax/Bcl⁃2比值明显增高,细胞凋亡率显著增加,与孙莉静[4]等人的HBVGN临床病理研究结果是一致的。本实验有助于对HBVGN中肾小管上皮细胞细胞凋亡相关作用机制的阐明;进一步证明了HBx基因通过上调Bax/Bcl⁃2比值,引起肾小管上皮细胞凋亡;同时丰富了HBVGN发病机制中HBV直接损伤的致病理论。本实验是以永生细胞株为研究对象,故进一步深入研究仍待继续。
[1]Han SH.Extrahepatic manifedtations of chronic heptitis B[J].Clin Liver Dis,2004,8(2):403-418.
[2]何平,冯国和.乙型肝炎病毒相关性肾炎中病毒直接损伤肾组织作用机制研究现状[J].中华传染病杂志,2012,30(2):123-125.
[3]Carrizo LC,Ruete CM,Manucha WA,et al.Heat shock protein 70 expression is associated with inhibition of renal tubule epithelial cell apoptosis during recovery from low ⁃protein feeding[J].Cell Stress Chaperones,2006,11(4):309-324.
[4]孙莉静,于建平,袁伟杰,等.Bcl⁃2和Bax在乙型肝炎病毒相关性肾炎患者肾组织中的表达[J].第二军医大学学报,2007,28(5):492-494.
[5]张瑜,周建华.乙型肝炎病毒相关性膜性肾病肾组织细胞凋亡的意义[J].华中科技大学学报(医学版),2008,37(5):77-80.
[6]Tang RX,Kong FY,Fan BF,et al.HBx activates FasL and mediates HePG2 cell apoptosis through MLK3⁃MKK7⁃JNKs signal module[J].World J Gastroenterol,2012,18(13):1485-1495.
[7]Bouehard MJ,Sehneider RJ.The enigmatic X gene of hepatitis B vi⁃rus[J].J Virol,2004,78(23):12725-12734.
[8]Kim H,Lee H,Yun Y.X⁃gene Product of hepatitis B virus induces apoptosis in liver cells[J].J Biol Chem,1998,273(1):381-385.
[9]Arbuthnot P,CaPovilla A,Kew M.Putative role of hepatitis B virus X protein in hepatocarcinogenesis:effects on apoptosis,DNA repair,mitogen⁃activated protein kinase and JAK/STAT pathways[J].J Gas⁃troenterol Hepatol,2000,15(4):357-368.
[10]Hong L,Zhang J,Min J,et al.A role for MHBst167/HBx in hepati⁃tis B virus⁃induced renal tubular cell apoptosis[J].Nephrol Dial Transplant,2010,25(7):2125-2133.
[11]卢宏柱,樊启红,刘丹,等.乙型肝炎病毒X蛋白通过激活ERKs和NF⁃kB上调大鼠系膜细胞表达TNF⁃a[J].基础医学与临床,2011,31(6):144-148.
[12]Yin XL,Zhou JH.Hepatitis B virus X protein upregulates the ex⁃pression of CD59 and Crry in mouse Podocytes[J].Zhonghua Er Ke Za Zhi,2010,48(12):934-938.
[13]张瑜,周建华.乙型肝炎病毒X蛋白抑制足细胞增殖[J].中华肾脏病杂志,2010,26(2):116-122.
[14]Xu H,Sun L,Zhou LJ,et al.The effect of hepatitis B vaccination on the incidence of childhood HBV⁃associated nephritis[J].Pedi⁃atr Nephrol,2003,18(12):1216-1219.
[15]Venkataseshan VS,Lieberman K,KIMDU,et al.Hepatitis⁃B⁃asso⁃ciated glomerulonephritis:pathology,pathogenesis,and clinical course[J].Medicine(Baltimore),1990,69(4):200-216.
[16]He XY,Fang LJ,Zhang YE,et al.In situ hybridization of hepatitis B DNA in hepatitis B ⁃associated glomerulonephritis[J].Pediatr Nephrol,1998,12(2):117-120.
[17]Lai KN,Ho RT,Tam JS,et al.Detection of hepatitis B virus DNA and RNA in kidneys of HBV related glomerulonephritis[J].Kid⁃ney Int,1996,50(6):1965-1977.
[18]CliPPinger AJ,Gearhart TL,Bouchard MJ.Hepatitis B virus X pro⁃tein modulates apoptosis in primary rat hepatocytes by regulating both NF⁃kB and the mitochondrial permeability transition Pore[J].J Virol,2009,83(10):4718-4731.
[19]CliPPinger AJ,Bouchard MJ.Hepatitis B virus HBx protein localiz⁃es to mitochondria in primary rat hepatocytes and modulates mito⁃chondrial membrane potential[J].J Virol,2008,82(14):6798-6811.
[20]Kang BP,Urbonas A,Baddoo A,et al.IGF⁃1 inhibits the mitochon⁃drial apoptosis program in mesangial cells exposed to high glucose[J].Am J Physiol Renal Physiol,2003,285(5):1013-1024.
[21]Qiu LQ,Sinniah R,I⁃Hong S.Downregulation of Bcl⁃2 by podo⁃cytes is associated with progressive glomerular injury and clinical indices of poor renal prognosis in human IgA nephropathy[J].J Am Soc Nehprol,2004,15(1):79-90.
[22]Yang B,Johnson TS,Thomas GL,et al.A shift in the Bax/Bcl⁃2 bal⁃ance may activate caspase⁃3 and modulate apoptosis in experimen⁃tal glomerulonephritis[J].Kidney Int,2002,62(4):1301-1313.
[23]Ortiz A,Lorz C,Catalan MP,et al.Expression of apoptosis regulato⁃ry proteins in tubular epithelium stressed in culture or following acute renal failure[J].Kidney Int,2000,57(3):969-981.
