18F⁃FLT 和18F⁃FD G PET⁃CT 显像评价Wistar大鼠Walker256肿瘤化疗后的早期疗效
2014-08-21徐微娜于树鹏辛军郭启勇
徐微娜,于树鹏,辛军,郭启勇
(中国医科大学附属盛京医院放射科,沈阳 110004)
判断抗肿瘤治疗效果的传统方法是检测治疗引起的肿瘤大小的变化,一般需要较长时间(平均为几个月)。对于一些难治性肿瘤,早期评价治疗反应可以在肿瘤大小改变之前调整治疗方案,避免不必要的毒性及经济上的浪费。恶性肿瘤一个重要的生物学特征是肿瘤细胞的增殖活性,因此肿瘤细胞增殖活性检测对于评价肿瘤细胞对治疗的反应具有重要的意义[1]。随着PET⁃CT在临床应用的开展,应用正电子药物评价肿瘤治疗效果(尤其是治疗后早期疗效)成为可能。目前临床应用最为广泛的正电子显像剂是18F⁃FDG,但由于其反映的仅是葡萄糖代谢水平,特异性较差。18F⁃FLT作为嘧啶类似物在临床前及临床的研究中初步得出了一些结果[2~7],但是其作用机制及对肿瘤诊断的意义我们还不完全清楚,对于不同的肿瘤及不同的治疗方式所得结果也不尽相同[8],还需要更多的研究来探索18F⁃FLT在肿瘤诊断及疗效评价中的价值。本研究对比化疗后早期肿瘤18F⁃FLT及18F⁃FDG摄取的变化及其与肿瘤细胞增殖活性之间的相关性。
1 材料与方法
1.1 实验动物、试剂与仪器
Wistar大鼠,雌性,体质量(120±20)g,清洁级,购自中国医科大学实验动物中心。荷Walker256腹水瘤Wistar大鼠购自中国医学科学院肿瘤研究所,清洁级。示踪剂18F⁃FLT和18F⁃FDG由中国医科大学附属盛京医院PET⁃CT中心合成,FLT和FDG前体由常熟华益化工有限公司生产。正电子药物合成系统为GE公司生产的Minitrace药物合成系统。PET⁃CT为GE公司生产的Discovery ST16 PET⁃CT。化疗药物表柔比星由浙江海正药业股份有限公司生产。增殖细胞核抗原(Ki⁃67)免疫组化试剂盒购于武汉博士德公司。
1.2 方法
1.2.1 荷Walker 256肿瘤大鼠模型的制备:将荷Walker 256瘤大鼠饲养至腹部彭隆,从腹水型Walk⁃er256瘤株大鼠腹腔中抽取淡黄色腹水5~6 mL,用生理盐水稀释成4×107/mL细胞悬液备用。用注射器于大鼠右前腋部皮下接种Walker256细胞,0.2 mL/只,7~10 d成瘤。当接种部位肿瘤最大径长至1.5~2.0 cm左右时进行实验。
1.2.2 动物分组及处理:30只Wistar大鼠随机分为对照组、化疗后24 h组和化疗后48 h组,每组10只。化疗后24 h组和化疗后48 h组大鼠尾静脉注射表柔比星,表柔比星稀释成1 mg/mL,按5 mg/kg给药,体积约0.5~0.7 mL,2组分别于化疗后24 h及48 h行18F⁃FLT及18F⁃FDG PET⁃CT显像(各5只)。对照组大鼠尾静脉注射同等体积的生理盐水,分别行18F⁃FLT及18F⁃FDG PET⁃CT显像(各5只)。
1.2.318F⁃FLT及18F⁃FDG PET⁃CT显像及图像处理:各组Wistar大鼠尾静脉分别注射18F⁃FLT及18F⁃FDG 0.5 mCi,0.2 mL(18.5 MBq/0.2mL),注射前后分别测定注射器放射性活度。注射显像剂后40 min腹腔注射水合氯醛(3 mL/kg)进行麻醉,注射显像剂后1 h行PET⁃CT显像。大鼠麻醉后俯卧于泡沫固定板,置于PET⁃CT成像系统内(GE公司Discovery ST16 PET⁃CT),CT 采集条件:120 kV,60 mA,层厚5 mm;PET采用3D采集模式,3 min/床位,扫描范围从头顶到尾部。图像后处理系统为GE公司Xeleris工作站。数据处理:将采集数据在Xeleris工作站进行图像断层、融合,定量测定肿瘤部位感兴趣区内放射性计数与对侧相同部位软组织相同面感兴趣区内放射性计数比值(T/NT)。
1.2.4 肿瘤组织处理:显像后即刻脱臼处死大鼠,称重后剥离肿瘤组织,生理盐水冲洗擦干后测定肿瘤放射性活度及重量,计算每克肿瘤组织摄取放射性百分比(%ID/g)。然后放入10%的中性甲醛缓冲液固定后24 h内石蜡包埋,制成切片及HE染色。免疫组化测定:将制成的石蜡切片经过脱蜡和水化、抗原修复、滴加Ⅰ抗和滴加Ⅱ抗后,DAB显色、苏木精复染、脱水、透明、封片后进行光镜下观察Ki⁃67的表达情况。涂片及切片观察方法:Ki⁃67蛋白以细胞核呈棕黄色或细胞质同时呈棕黄色为阳性,单纯细胞质着色而细胞核无着色或二者均无着色为阴性。采用OLYMPUS显微镜在高倍镜(×400)下随机观察10个视野,计算阳性细胞所占百分比,表示为标记指数(labelling index,LI)。所有计数由同一人操作。
1.3 统计学分析
数据处理使用SPSS17.0统计分析软件,计量资料数据采用±s表示,化疗前后各组数据比较采用方差分析,相关性比较采用Spearman相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 PET⁃CT显像结果
化疗后24和48 h时PET⁃CT结果显示大鼠肿瘤部位18F⁃FLT和18F⁃FDG放射性分布较对照组均降低(图1、2)。对照组肿瘤18F⁃FLT放射性分布高于周围本底,化疗后24 h肿瘤18F⁃FLT放射性分布较对照组降低,化疗后48 h肿瘤18F⁃FLT放射性分布较对照组进一步降低(图1)。对照组肿瘤18F⁃FDG放射性分布明显高于周围本底,化疗后24 h肿瘤18F⁃FDG放射性分布较对照组降低,化疗后48 h肿瘤18F⁃FDG放射性分布较对照组进一步降低(图2)。18F⁃FLT及18F⁃FDG组T/NT比值也较对照组降低(P<0.01和P<0.05),见表1。
2.2 肿瘤组织Ki⁃67检测结果
细胞核染成褐色为增殖肿瘤细胞,与对照组相比,化疗后24和48 h Ki⁃67阳性细胞比例均明显降低(P<0.001),见表1、图3。
2.3 肿瘤18F⁃FLT、18F⁃FDG摄取与LI⁃Ki⁃67的相关性
化疗后18F⁃FLT和18F⁃FDG摄取(T/NT)与LI⁃Ki⁃67均呈正相关(r=0.899,P<0.05;r=0.813,P<0.05)。18F⁃FLT及18F⁃FDG的T/NT与%ID/g之间有良好的相关性(r=0.898,P<0.05;r=0.843,P<0.05)。
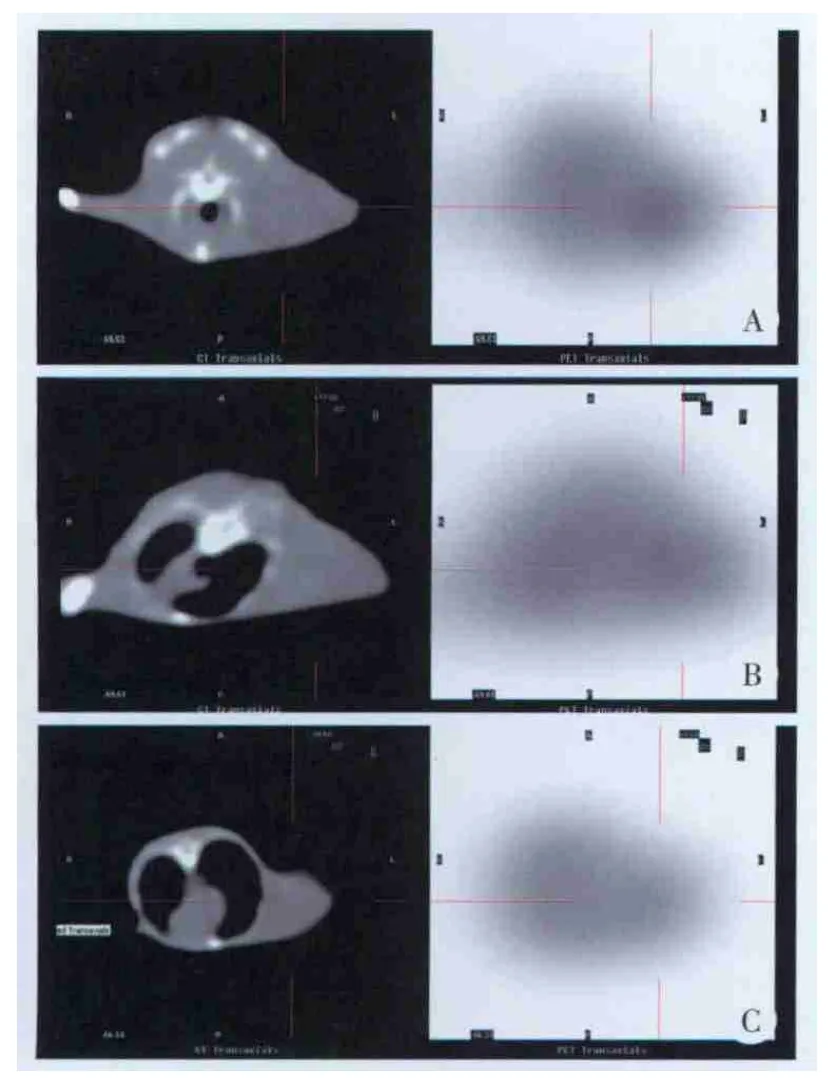
图1 化疗前后肿瘤部位18F⁃FLT放射性分布Fig.1 18F⁃FLT distribution in tumor before and after chemotherapy

图2 化疗前后肿瘤部位18F⁃FDG放射性分布Fig.2 18F⁃FDG distribution in tumor before and after chemotherapy

图3 化疗前后肿瘤组织Ki⁃67分布 ×400Fig.3 Ki⁃67 distribution in tumor before and after chemotherapy ×400
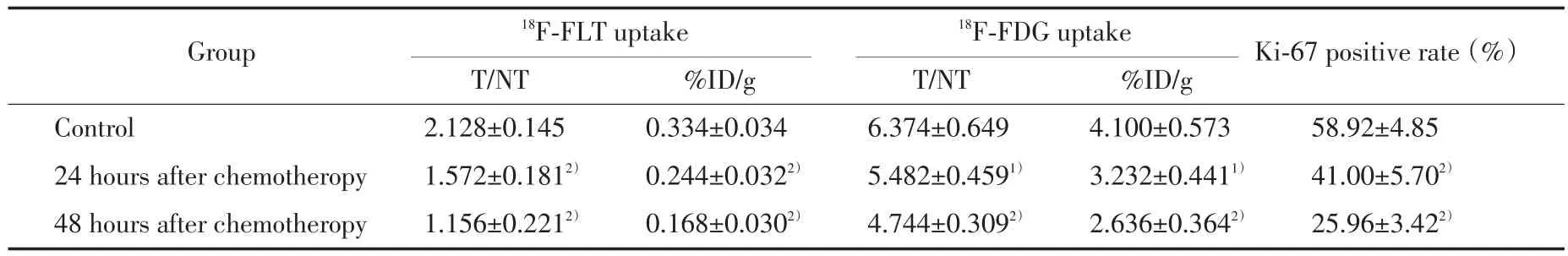
表1 化疗后24和48 h肿瘤组织18F⁃FLT和18F⁃FDG摄取及Ki⁃67的变化Tab.1 Change of Ki⁃67 and18F⁃FLT,18F⁃FDG uptake in tumor 24 and 48 hours after chemotherapy
3 讨论
本研究结果表明,Walker256肿瘤在表柔比星化疗后早期(24 h)18F⁃FLT摄取降低,48 h降低更加明显,同时免疫组化检测肿瘤组织Ki⁃67也出现了下降,表柔比星抑制了肿瘤的增殖活性,而18F⁃FLT PET⁃CT显像可以检测到此种变化。
表柔比星4′位置上的羟基由顺位变为反位,为细胞周期非特异性药物,其主要作用机制与其能与DNA结合有关。体外培养的细胞加入本品可迅速透入胞内,进入细胞核与DNA结合,从而抑制核酸的合成和有丝分裂。从表柔比星的作用机制可以得出,由于抑制了细胞的DNA合成,导致肿瘤细胞利用胸腺嘧啶脱氧核苷的量减少,因而其摄取胸腺嘧啶脱氧核苷类似物18F⁃FLT的量降低。18F⁃FLT作为嘧啶类似物在细胞增殖过程中能够掺入DNA,但不掺入RNA。18F⁃FLT通过被动扩散和Na+依赖载体的易化转运进入细胞,随后在胸腺嘧啶核苷激酶1(TK1)的作用下发生磷酸化生成18F⁃FLT一磷酸盐而滞留在细胞内。TK1是DNA补救合成途径中的一种重要的酶,在静止细胞中无活性,但在增殖细胞的G1期后期和S期该酶活性达到最大[9]。因此,18F⁃FLT通过TK1催化发生磷酸化形成了其作为增殖示踪剂的基础。文献报道TK1在恶性肿瘤细胞中的活性比在良性细胞中高3~4倍[10],而且肿瘤细胞TK1羧基末端发生突变,使其在M期不能正常降解失活,最终导致TK1在肿瘤细胞中的活性异常增高[11]。因此增殖活跃的肿瘤可以摄取18F⁃FLT而在PET⁃CT上表现为局部放射性浓聚。由此可见Walker256肿瘤在表柔比星化疗后摄取18F⁃FLT降低很大可能与细胞增殖活性受抑有关,18F⁃FLT摄取的量的多少可以反映化疗后早期肿瘤细胞的增殖状态。
虽然本研究表明18F⁃FLT摄取与细胞增殖相关,但是需要注意的是肿瘤的DNA合成有从头合成和补救合成两种途径,不同的肿瘤其DNA合成途径也不尽相同,或者以补救合成途径为主,或者以从头合成途径为主[12],而TK1仅是DNA补救合成途径的酶,因此仅反映补救合成途径的DNA合成。化疗药物可引起不同合成途径的转换,有些化疗药物通过抑制DNA从头合成途径而激活了补救途径,使TK1活性增强,导致18F⁃FLT摄取增加。如肿瘤经过化疗药物5⁃氟尿嘧啶治疗后,5⁃氟尿嘧啶在体内转变成5⁃氟尿嘧啶衍生物一磷酸脱氧核糖氟尿嘧啶核苷及三磷酸氟尿嘧啶核苷后,阻断dTMP的合成,从而影响DNA的生物合成,使其停滞在S期从而激活DNA补救合成途径,TK1活性增高。TK1活性增高会使18F⁃FLT摄取增加,但此时DNA合成(即细胞增殖速度)却减慢[13],此种情况18F⁃FLT的摄取就不能反映细胞的增殖。尽管不同的研究结果不尽相同,但不能因此就完全否认18F⁃FLT的作用,18F⁃FLT摄取与肿瘤细胞增殖相关性还需要更深入细致的研究。
不同药物抑制肿瘤生长的机制不同,作用于细胞周期的环节不同,而18F⁃FLT也仅是与DNA的补救合成途径相关,因此对于一些以从头合成途径为主的肿瘤则不能反映其增殖变化。所以我们在判断18F⁃FLT摄取对肿瘤细胞增殖影响时,一定要了解使用的抑制肿瘤药物及其作用机制,从而通过18F⁃FLT摄取变化来判断肿瘤细胞增殖状况。临床治疗中对肿瘤患者多采用联合化疗方法,使得肿瘤DNA合成变化更加复杂,引起摄取18F⁃FLT的变化也不尽相同,因此对不同的肿瘤以及不同的治疗方式还需要更多的临床前及临床研究加以了解及认证[14]。
18F⁃FDG摄取在肿瘤化疗后早期也出现了降低的改变,分析原因可能与18F⁃FDG的摄取机制有关。细胞18F⁃FDG摄取主要依赖于细胞膜葡萄糖转运体及己糖(磷酸)激酶的活性。表柔比星治疗后肿瘤组织18F⁃FDG摄取降低,可能是由于表柔比星降低了己糖(磷酸)激酶的活性,从而使肿瘤细胞摄取18F⁃FDG降低;或者由于表柔比星抑制肿瘤细胞的分裂从而使肿瘤细胞利用能量减少,而肿瘤能量的主要来源为葡萄糖,因此葡萄糖利用降低,导致18F⁃FDG摄取减少。因此肿瘤细胞摄取18F⁃FLT降低是由于肿瘤细胞增殖降低,而18F⁃FDG摄取减少是细胞增殖降低的间接结果,因此18F⁃FDG代谢在一定程度上也可以间接反映细胞增殖,但其影响因素相对较多,如血糖水平、脑组织的功能状态等都会引起肿瘤组织18F⁃FDG摄取的变化。18F⁃FDG摄取可以部分反映细胞增殖,细胞增殖活性是影响18F⁃FDG摄取的一个因素。
与18F⁃FDG相比,18F⁃FLT在大鼠肿瘤组织摄取较低,心脏及脑组织分布较少,而且在大鼠体内分布比较稳定,所受影响因素较少。而18F⁃FDG受血糖及脑功能状态的影响,心脏及脑组织摄取18F⁃FDG变化较大,影响肿瘤定量测定的结果。因此18F⁃FLT显像重复性好,更适合于肿瘤治疗疗效的评价。
本研究结果表明,化疗后早期18F⁃FLT及18F⁃FDG摄取均与肿瘤细胞增殖活性呈正相关,即18F⁃FLT及18F⁃FDG摄取可以反映肿瘤治疗后早期的细胞增殖活性的变化,是评价化疗后早期疗效的有效指标。
不足之处在于本研究将临床PET⁃CT应用于小动物,所得图像清晰度欠佳,但是研究比较了PET⁃CT显像测定肿瘤摄取T/NT与肿瘤组织实际摄取%ID/g的相关性,结果显示它们之间有良好的正相关,表明通过PET⁃CT显像所得T/NT可以反映小动物肿瘤组织的实际摄取。
[1]Colozza M,Azambuja E,Cardoso F,et al.Proliferative markers as prognostic and predictive tools in early breast cancer:where are we⁃now?[J].Ann Oncol,2005,16(11):1723-1739.
[2]Shields AF,Grierson JR,Dohmen BM et al.Imaging proliferation in vivo with[F⁃18]FLT and positron emission tomography[J].Nat Med,1998,4(11):1334-1336.
[3]Grierson JR,Shields AF.Radiosynthesis of 3′⁃deoxy⁃3′⁃[18F]fluoro⁃thymidine:[18F]FLT for imaging of cellular proliferation in vivo[J].Nucl Med Biol,2000,27(2):143-156.
[4]Rasey JS,Grierson JR,Wiens LW,et al.Validation of FLT uptake as a measure of thymidine kinase⁃1 activity in A549 carcinoma cells[J].J Nucl Med,2002,438(9):1210-1217.
[5]Buck AK,Halter G,Schirrmeister H,et al.Imaging proliferation in lung tumors with PET:18F⁃FLT versus18F⁃FDG[J].J Nucl Med,2003,44(9):1432-1434.
[6]Mier W,Haberkorn U,Eisenhut M.[18F]FLT:portrait of a prolifera⁃tion marker[J].Eur J Nucl Med,2002,29(2):165-169.
[7]Shields AF.Positron emission tomography measurement of tumour metabolism and growth:its expanding role in oncology[J].Mol Im⁃aging Biol,2006,8(3):141-150.
[8]Yamamoto Y,Nishiyama Y,Ishikawa S,et al.Correlation of18F⁃FLT and18F⁃FDG uptake on PET with Ki⁃67 immunohistochemistry in non ⁃small cell lung cancer[J].Eur J Nucl Med Mol Imaging,2007,34(10):1610-1616.
[9]Munch⁃Petersen B,Cloos L,Jensen HK,et al.Human thymidine ki⁃nase 1,regulation in normal and malignant cells[J].Adv Enzyme Regul,1995,35:69-89.
[10]Boothman DA,Davis TW,Sahijdak WM.Enhanced expression of thymidine kinase in human cells following ionizing radiation[J].Int J Radiat Oncol Biol Phys,1994,30(2):391-398.
[11]Kauffman MG,Kelly TJ.Cell cycle regulation of thymidine kinase:residues near the carboxyl terminus are essential for the specific degradation of the enzyme at mitosis[J].Mol Cell Biol,1991,11(5):2538-2546.
[12]Cole PD,Smith AK,Kamen BA.Osteosarcoma cells,resistant to methotrexate due to nucleoside and nucleobase salvage,are sensi⁃tive to nucleoside analogs[J].Cancer Chemother Pharmacol,2002,50(2):111-116.
[13]Dittmann H,Dohmen BM,Kehlbach G,et al.Early changes in18F⁃FLT uptake after chemotherapy:an experimental study[J].Eur J Nucl Med Mol Imaging,2002,29(11):1462-1469.
[14]Dittmann H,Dohmen BM,Paulsen F,et al.[18F]FLT PET for diag⁃nosis and staging of thoracic tumours[J].Eur J Nucl Med Mol Im⁃aging,2003,30(10):1407-1412.
