两种方案治疗广泛期小细胞肺癌的临床观察
2014-12-02张容榕刘爱学冯天举
张容榕,林 琳,刘爱学,冯天举
(深圳市第二人民医院肿瘤科,广东深圳 518035)
二十世纪起,肺癌已成为全世界最常见的恶性肿瘤,在恶性肿瘤相关死亡原因中占第一位。其中小细胞肺癌占所有肺癌的15%~20%,而新发病例60%~70%是广泛性病变。临床研究发现虽然小细胞肺癌对化疗比较敏感,很容易达到缓解,但是缓解后复发率也高,因此治疗效果并不理想。能够最大程度地提高治疗效果,降低副反应发生率是治疗小细胞肺癌的主要目的。目前化疗是广泛期小细胞肺癌的标准治疗,而联合化疗的有效率为60%~70%,中位生存期9~11个月,2年生存率5%[1]。
我院肿瘤科2010年1月至2013年1月对70例住院治疗的广泛期小细胞肺癌患者分别采取伊立替康联合顺铂(IP)和VP-16联合顺铂(EP)方案化疗,现将结果总结报告如下。
1 资料与方法
1.1 入组标准
入组条件①均经病理或细胞学确诊为小细胞肺癌。②VALG分期为广泛期。③至少有一个双径可测量病灶,常规检测条件下病灶最大径≥20mm或螺旋CT和MRI检测最大径≥10mm。④ECOG行为能力评分≤2分。⑤预计生存期超过3个月。⑥均无严重的肝肾、心功能障碍及骨髓抑制,心电图显示无异常。⑦患者确诊后未接受过针对本病的系统治疗。
本试验经医院伦理委员会批准,所有患者均签署知情同意书。
1.2 临床资料
2010年1月至2013年1月间,共有70例小细胞肺癌患者入组,其中包括男性45例和女性25例;患者年龄45~70岁,平均年龄(50.3±0.5)岁;病程1个月~2年,平均(0.8±0.6)年,被分为伊立替康(IP)组和VP-16(EP)组。每组各35例。两组患者年龄、性别构成、病情、病程等基本情况比较差异无统计学意义(P>0.05),见表1。两组患者中胸腔积液有压迫症状者均给予胸腔置管引流胸水,有颅内转移和上腔静脉压迫综合症者给予放射治疗控制远处转移。
1.3 治疗方案
1.3.1 伊立替康(IP)组 给予伊立替康60mg/m2,第 1、8、15 天,静脉滴注;顺铂 70mg/m2,第 1天,静脉滴注,每四周重复。
1.3.2 VP-16(EP)组 给予 VP-16 100mg/m2,第1、2、3 天,静脉滴注;顺铂 70mg/m2,第 1 天,静脉滴注,每三周重复。
应用顺铂时提前水化,减轻顺铂的肾脏的损害。所有患者均接受至少2个周期化疗,最多接受6个周期化疗。2周期后评价疗效,有效者继续原方案治疗,无效者改用其他方案。整个化疗过程中均给予抑酸、保护胃粘膜、保护骨髓等对症支持治疗。

表1 70例小细胞肺癌患者临床特征
1.4 观察指标及疗效评定标准
所有患者在治疗前1周内完成基线评估(主要包括采集病史和体格检查,胸、腹部CT、头颅MRI、骨扫描,心电图以及血常规和肝肾功能检查),化疗2个周期后进行疗效评估,对目标病灶采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progression disease,PD)。CR完全缓解:所有目标病灶消失,至少维持四周。PR部分缓解:基线病灶最大径之和至少减少30%,至少维持四周。PD病变进展:基线病灶最大径之和至少增加20%或出现新病灶。SD病变稳定:基线病灶最大径之和有减少但未达到PR或有增加但未到达PD。不良反应按照WHO抗癌药物毒性分级标准评价,分为Ⅰ~Ⅳ度[1]。
有效率(Response rate,RR)为CR+PR的病例数占所有病例数的百分比。无进展生存期(progression-free survival,PFS)指从治疗开始之日至肿瘤病灶进展的时间,总生存时间(overall survival,OS)指从治疗开始之日至死亡的时间。
所有患者的不良反应按照WHO抗癌药物毒性分级标准评价,分为Ⅰ~Ⅳ度。
1.5 统计学处理
所有数据应用SPSS19.0统计软件包进行统计学分析,计数资料比较采用卡方检验,采用Fisher精确检验法,PFS和OS采用Kaplan-Meier法计算,显著性检验采用Log-Rank法分析。毒副反应不同方案组间比较采用秩和检验法。P<0.05为差异有统计学意义。
2 结果
2.1 IP组和EP组患者临床疗效对比
2.1.1 近期疗效 70例患者均完成4个周期的化疗,在完成了2个周期化疗后评价疗效,CR 13例(18.57%),IP组 7例,EP组 6例;PR 38例(54.28%),IP组 19例,EP组 19例;SD 8例(11.43%),IP组 4例,EP组 4例;PD 11例(15.71%),IP组4例,EP组4例。患者总有效率(CR+PR)为72.86%,其中 IP组和 EP组分别为74.29%(26/35)与71.43%(25/35),两组患者比较差异无统计学意义(P>0.05),见表2。
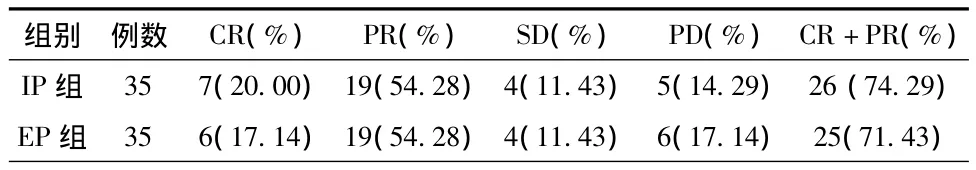
表2 两组患者临床疗效对比[n(%)]
2.1.2 生存期 随访至2014年1月,中位随访8.5个月。IP组和EP组的PFS分别为4.3个月和3.7个月,差异无统计学意义(Log-Rank χ2=1.410 P=0.235),见图 1。中位 OS 分别为 9.3 个月和8.9 个 月,差 异 无 统 计 学 意 义 (χ2=1.700 P=0.403),见图2。
2.2 两组患者毒副反应发生情况对比
所有患者的不良反应按照WHO抗癌药物毒性分级标准评价,分为Ⅰ~Ⅳ度。由于本院未开展UGTIAI突变的检测,所有患者未做此项检查。IP组患者主要不良反应有:粒细胞减少54.29%(19/35)、血小板减少 14.29%(5/35)、贫血 25.71%(9/35)、腹泻 22.86%(8/35)、消化道反应 71.43%(25/35)。EP组患者的主要不良反应有:粒细胞减少80.0%(28/35)、血小板减少 60.0%(21/35)、贫血54.29%(19/35)、腹泻 2.86%(1/35)、消化道反应74.29%(26/35)。其中EP组的血液毒性明显高于IP组,两组比较差异有统计学意义(P<0.01);IP组的腹泻反应发生率高于EP组,两组比较差异有统计学意义(P<0.05)。而其他消化道反应两组比较差异无统计学意义(P>0.05),见表3。两组均无化疗相关死亡患者。

图1 两组方案PFS比较

图2 两组方案OS比较
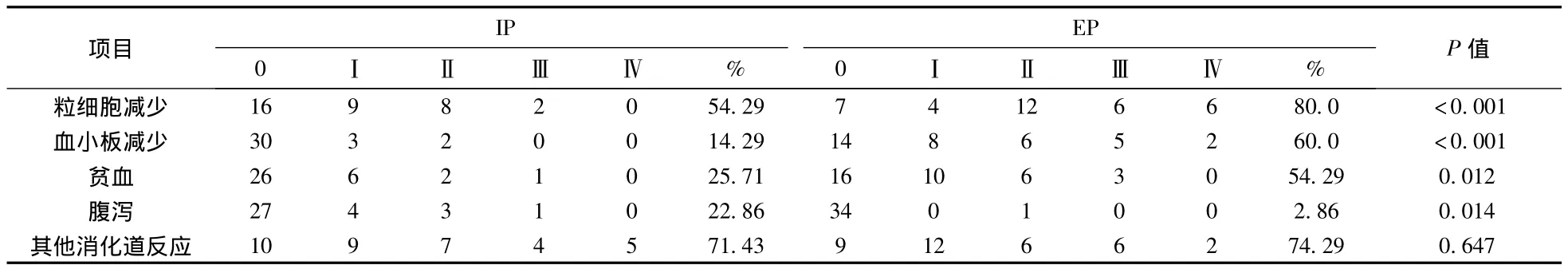
表3 两组患者毒副反应发生情况对比
3 讨论
由于小细胞肺癌独特的生物学特性,因此对化疗药物比较敏感。自二十世纪90年代后,广泛期小细胞肺癌的标准一线治疗方案为铂类联合VP-16[2-5],但因其易复发,总的治疗效果并不理想[6]。2002年日本临床肿瘤学组织的JCOG9511研究结果显示伊立替康联合顺铂(IP)对比依托泊苷联合顺铂(EP)可以提高总生存期和无进展生存期,从而为小细胞肺癌治疗了提供较好的方法[7]。Ichiki等报道伊立替康对复发性SCLC治疗有效,证明伊立替康也是一个有效的SCLC二线治疗的药物[8]。国内有文献报道,伊立替康与顺铂联合治疗晚期复发非小细胞肺癌有效率达48.3%,对初治SCLC有效率达 84%[9]。而 Hanna、SWOGO124和Zatloukal的研究并没有显示出IP较EP有生存优势[10-12],究其原因,可能与药物基因组的人种差异有关,已有基础研究表明,伊立替康代谢受药物代谢、解毒或转运相关的单核苷酸多态性的影响,导致迟发性腹泻发生率在不同人群中存在明显差异,因此推测其疗效在不同人群中存在明显差异[13-14]。
本研究对70例广泛期小细胞肺癌肺癌患者分别采取伊立替康联合顺铂和VP-16联合顺铂方案化疗,观察统计两组方案的有效性,结果显示伊立替康联合顺铂方案有效率(74.29%)略高于VP-16联合顺铂方案(71.43%),但是统计学上未证实存在差异,有必要扩大样本进行分层分析。
在不良反应方面,伊立替康联合顺铂较VP-16联合顺铂方案血液毒性明显小,前者在中性粒细胞和血小板的减少方面显示出显著的差异,此结果与JCOG报道的结果相一致[7]。伊立替康的副反应主要为腹泻,分为早期腹泻和迟发型腹泻,早期腹泻是由乙酰胆碱能综合征引起的,属于一过性反应,偶尔发生,可通过阿托品预防和治疗。而迟发型腹泻一般发生在用药后第5~8天,可用口服洛派丁胺进行治疗。已有研究表明伊立替康的迟发型腹泻反应程度与UGT1A1有关,但是本研究中未进行该基因检测,而实际本研究中IP组发生严重腹泻的比例并不大,这与国内外报道的东西方UGT1A1基因突变发生率存在差异一致,中国人突变发生率较小[15-18]。两组患者消化道反应发生率相似,并且没有出现不可预测的不良反应,均可耐受。本研究两组间PFS和OS均未证明差异有统计学意义(P>0.05)。
综上所述,小细胞肺癌广泛期的患者应用伊立替康联合顺铂和VP-16联合顺铂两种化疗方案虽然疗效相当,在毒副反应方面IP组腹泻相比VP-16组毒性较重,但可控可逆,并且患者可以耐受,所以前者在临床应用中更值得临床推广。
[1] 吴一龙.中国肺癌临床指南[M].北京:人民出版社,2007:1-17.
[2] Akerley W,HcCoy J,Hesketh PJ,et al.Gemcitabine and irinotecan for patients with untreated extensive stage small cell lung cancer:SWOG 0119[J].J Thorac Oncol 2007;2(6):526-530.
[3] Chen G,Huynh M,Fehrenbacher L,et al.Phase Ⅱtrial of irinotecan and carboplatin for extensive or relapsed small-cell lung cancer[J].J Clin Oncol.2009,27(9):1401-1404.
[4] Okamoto H,Watanabe K,Kunikane H,et al.Randomised phase Ⅲtrial of carboplatin plus etoposide in elder or poor-risk patients with extensive disease small-lung cancer.JGOG 9702 [J].Br J Cancer.2007.97(2):162-169.
[5] Schuette W,Nagel S,Juergens S,et al.Phase Ⅱtrial of gemcitabine/irinotecan in refractory or relapsed small-cell lung cancer[J].Clin Lung Cancer,2005,7(2):133-137.
[6] 汪晓洁,李丽华,寿 涛,等.IP与EP方案治疗广泛期小细胞肺癌的临床疗效比较[J].实用医学杂志,2012,28(17):2946-2947.
[7] Sekine,Nishiwaki Y,Noda K,et al.Randomized phase Ⅱstudy of cisplatin,irinotecan and etoposidecombinationsadministered weekly or every 4 weeks for extensive small-cell lung cancer(JCOG9902-DI)[J].Ann Oncol 2003;14(0923-7534):709-714.
[8] Ichiki M,Gohara R,Rikimaru T,et al.Combination chemotherapy with irinotecan and ifosfamide as second-line treatment of refractory or sensitive relapsed small-cell lung cancer:a phase Ⅱstudy[J].Chemotherapy,2003,49(4):200-205.
[9] 赵金波,周金平,刘 芳,等.伊立替康联合顺铂治疗小细胞肺癌60例临床观察[J].中华全科医学,2011,9(3):371-372.
[10] Hanna N,Bunn P A Jr,Langer C,et al.Randomised phase Ⅲtrial comparing with previously untreated extensive-stage disease small-cell lung cancer[J].J Clin Oncol,2006,24(13):2038-2043.
[11] Lara P N Jr,Natale R,Crouley J,et al.Phase Ⅲ trial of irinotecan/cisplatin compared with etoposide/cisplatin in extersive-stage small-cell lung cancer:clinical and pharmarogenomic results from SWOG SO124 [J].J Clin Oncol,2009,27(15):2530-2535.
[12] Zatloural P,Cardenal F,Szczesna A,et al.A multicenter international randomized phaseⅢstudy comparing cisplatin in combination with irinotecan or etoposide in preriously untreated small lung cancer patients with extersive disease [J].Ann Oncol,2010,21(9):1810-1816.
[13] De Jong F A,Marsh S,Mathussen R H,et al.ABCG2 pharmacogenetics:ethnic differences in allele frequency and assessment of influence on irinotecan disposition[J].Clin Cancer Res,2004,10(17):5889-5894.
[14] Hoskins J M,Marcuello E,Alts A,et al.Irinotecan pharmacogenetics influence of pharmacodynamic genes[J].Clin Cancer Res,2008,14(5):1788-1796.
[15]王 岩,徐建明,沈 琳,等.中国人尿苷二磷酸葡糖苷酸转移酶1A基因多态性与伊立替康毒性的相关性[J].中华肿瘤杂志,2007,29(12):913-918.
[16] Liu CY.UGT1A1*28 polymorphism predicts irinotecan-induced severe toxicities without affecting treatment outcome and survival in patients with metastatic colorectal carcinoma[J].Cancer,2008,112(9):1932-1940.
[17] Douillard JY.Effects of ageon proximal gastric motorand sensory function[J].Lancet,2000,35(21):1041-1047.
[18] Kohne CH.Phase III study of weekly high-dose infusional fluorouracil plus folinic acid with or without irinotecan in patients with metastatic colorectal cancer:European Organisation for Researchand Treatment of Cancer Gastrointestinal Group Study 40986 [J].J Clin Oncol,2005,23(22):4856-4865.
