乳杆菌A-2代谢产物对人舌鳞癌CAL-27细胞增殖与凋亡的初步研究
2014-11-22张国梁李德超王心彧
张国梁,吴 江,关 键,关 宏,李德超,王心彧
(1.佳木斯大学口腔医学院,黑龙江 佳木斯 154002;2.齐齐哈尔医学院,黑龙江 齐齐哈尔 161006)
口腔颌面部恶性肿瘤以癌最为常见,其中又以鳞状细胞癌最多见,约占80%以上[1]。舌癌是最常见的口腔癌,容易发生早期颈部淋巴结转移,且转移率较高[1,2]。目前舌癌的治疗方式是以手术治疗为主,以及术前、术后的化疗来提高疗效。但是传统的化疗通常存在着肿瘤细胞耐药、化疗药物毒副作用等不利因素,因此从动植物、矿物质、海洋生物等天然物质中寻找高效低毒的治疗恶性肿瘤的药物已经成为研究热点。乳杆菌属于益生菌[3],通过发酵糖类、蛋白质、脂类和氨基酸等,可以得到乳酸、乙酸、细菌素、过氧化氢、胞外多糖、胞外多聚糖、血管紧张素转化酶抑制剂等代谢产物物质,乳杆菌及其代谢产物具有抗感染、抗氧化、抗龋齿和抗肿瘤功能,并与细胞凋亡和细胞分化的调控有关[4]。实验中乳杆菌A-2的代谢产物1(LSPM1)和代谢产物2(LSPM2))均为复杂的混合物,里面包含氨基酸、蛋白质和游离的金属离子等成分。本实验主要目的是检测该混合物对人舌鳞癌CAL-27细胞的抑制及诱导凋亡情况,混合物的抗癌有效成分仍需进一步研究,以便为筛选新的抗肿瘤生物活性剂提供更有利的实验基础。
1 实验方法
1.1 实验仪器
Annexin V-FITC/PI双染法细胞凋亡检测试剂盒(南京凯基生物技术有限公司),CO2培养箱,倒置荧光显微镜(X-50,Nikon),流式细胞分析仪(FACSCalibur型)。
1.2 实验材料
乳杆菌A-2(Lactobacillus sp A-2)(齐齐哈尔医学院提供),人舌鳞癌细胞CAL-27(协和医科大学提供),DMEM(Dulbecco’s Modified Eagle Medium)培养基,胎牛血清(上海生工生物工程技术服务有限公司),MTT 试剂盒,吖啶橙(AO)染料(上海生工生物工程技术服务有限公司),MRS(DeMan Rogosa-Sharpe)培养基,复原乳清培养基(乳清粉50g/L,碳酸钙20g/L,pH6.0~6.5,121℃灭菌15min),复原乳清菊糖培养基(乳清粉50g/L,碳酸钙20g/L,菊糖10g/L,pH6.0~6.5,121℃灭菌15min)。
1.3 乳杆菌A-2菌悬液的制备
乳杆菌A-2放入已添加MRS的15mL离心管中,放入37℃CO2培养箱内24h,以上步骤重复3次,72h后取出,再离心,取等体积的无菌生理盐水(含10mM CaCl2)冲洗乳杆菌A-2沉淀2次,再离心,弃上清液,然后制备菌悬液,备用。
1.4 乳杆菌A-2代谢产物的制备
将上述菌悬液分别接种于复原乳清培养基和复原乳清菊糖培养基中,菌液浓度为1OD/mL,100r/min振荡,放置于40℃CO2培养箱内,48h。然后取出菌液,离心,取上清液,经过真空冷冻干燥分别得到冻干粉(乳杆菌A-2代谢产物LSPM1和LSPM2),-20℃保存,备用。
1.5 CAL-27细胞培养
CAL-27 细胞复苏后,加入DMEM 培养基,放置于37℃CO2培养箱内,12h,观察细胞状态。当细胞呈单层贴壁生长、80%~90%融合时,利用0.05%胰蛋白酶消化传代。
1.6 MTT 法测定LSPM1和LSPM2对CAL-27细胞生长抑制率
将1.0×104/mL 的CAL-27细胞分别接种到96孔板中,每孔0.1mL,实验组是浓度分别为1.875mg/mL、3.75mg/mL、7.5mg/mL、15mg/mL、30mg/mL 的LSPM1;阳性对照组是浓度1μg/mL的紫杉醇;空白对照组是只加培养液。置于37℃、5%CO2的培养箱中培养48h,于终止培养前2h加入5mg/mL的MTT 溶液20μL,培养2h,离心,弃上清液,加入150μL 的DMSO,震荡5~10min,直到完全溶解。测定570nm 的吸光度(A570nm)值,公式:细胞生长抑制率(%)=(1-实验组A570nm值/空白对照组A570nm值)×100%。利用上述方法再测定LSPM2对CAL-27细胞生长抑制率。
1.7 荧光显微镜观察CAL-27细胞的形态学变化
将2.4×105/mL CAL-27细胞悬液接种于放有盖玻片的培养皿中,置于37℃、5%CO2培养中24h后,分别加入浓度为36mg/mL的LSPM1和36mg/mL的LSPM2,空白对照组只添入培养基,再置于37℃、5% CO2培养箱中16h,取出盖玻片,固定5min,吖啶橙染色5~10min,再用PBS冲洗后,在荧光显微镜下观察。
1.8 流式细胞仪检测
制备1.5×106/mLCAL-27细胞悬液,取2mL 接种于培养皿中。置于37℃、5%CO2培养箱12h,分别加入浓度为36mg/mL LSPM1和36mg/mL LSPM2,继续培养12h,然后用0.05%的胰蛋白酶消化,PBS冲洗2次,500μL 1×Binding Buffer悬浮细胞(1.0~1.5×106/mL)加入5μL Annexinv-FITC,轻轻混匀,于2~8℃避光条件下孵育15min,再加入5μLPI,轻轻混匀后于2~8℃避光条件下孵育5min,1h内用流式细胞仪检测。
1.9 琼脂糖凝胶电泳法分析
将3×106/mL 的CAL-27细胞悬液接种于培养皿中,置于37℃、5% CO2培 养 箱24h,经36mg/mL LSPM1和36mg/mL LSPM2分别作用后,定时收集细胞,PBS冲洗,加入100μL 细胞裂解液,置于4℃下10min,离心后吸取上清液,并加入2μL 浓度为20mg/mL 的RNase A,置于37℃下60min,再加入2μL 浓度为20mg/mL 的proteinase K,置于37℃下60min,然后加入NaCl-异丙醇,置于-20℃下,静止过夜。然后离心(7,200g)15min后,去除NaCl-异丙醇,加入TE后沉淀溶解,经过1%的琼脂凝胶电泳(80V),1h后,紫外灯下检测并摄像。
1.10 统计学分析
采用SPSS 17.0软件包进行处理。用独立样本方差分析各组间的差异,结果以均数±标准偏差(±s)表示。
2 结果
2.1 LSPM1和LSPM2对CAL-27细胞生长抑制率的影响
通过数据分析发现:1.875mg/mL、7.5mg/mL、15mg/mL、30mg/mL LSPM1对CAL-27细胞作用48h后,抑制率分别达到(45.40±9.51)%、(43.35±5.19)%、(65.63±5.45)%和(79.14±8.09)%,与空白对照组比较,具有显著性差异,有统计学意义(P<0.01)。1.875mg/mL、3.75 mg/mL、7.5mg/mL、15mg/mL和30mg/mL LSPM2对CAL-27细胞作用48h后,抑制率分别达到)21.94±2.68)%、(39.31±4.63)%、(47.81±14.24)%、(69.66±5.38)%和(85.29±2.95)%,与空白对照组比较,具有显著性差异,有统计学意义(P<0.01)。LSPM1和LSPM2对CAL-27细胞的作用无显著性差异(见图1)。以上结果表明:乳杆菌A-2代谢产物对CAL-27细胞生长抑制率具有浓度依赖性。
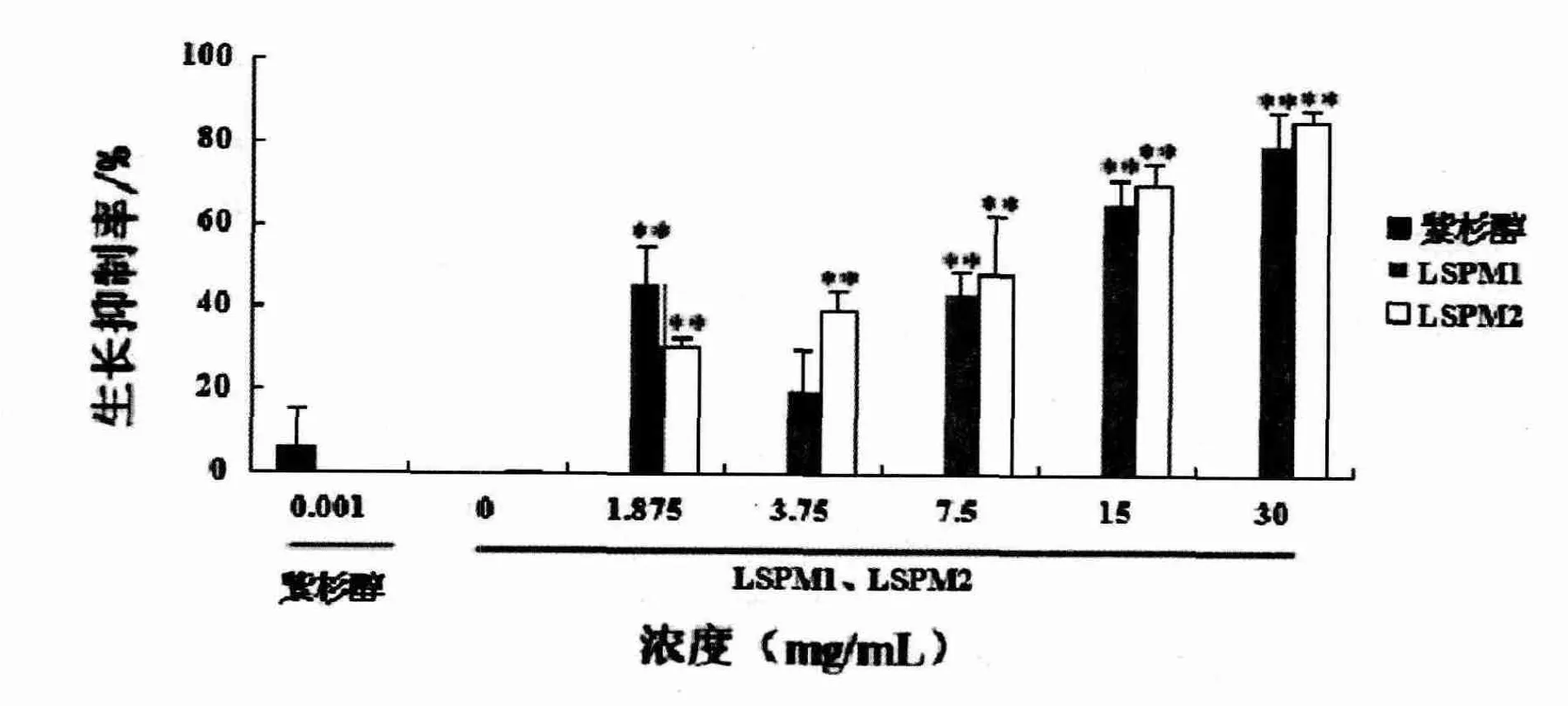
图1 LSPM1和LSPM2对CAL-27细胞增殖的影响
2.2 荧光显微镜观察CAL-27细胞凋亡的形态学改变
利用经吖啶橙染色后在荧光显微镜下观察,空白对照组中CAL-27细胞核为均一的绿色荧光,细胞贴壁良好;然而经过36mg/mL LSPM1和36mg/mL LSPM2 处 理16h 后,CAL-27细胞染色质浓缩成块状、边缘化、核膜裂解、出现凋亡小体(见图2)。

图2 CAL-27细胞形态特征
2.3 LSPM1和LSPM2诱导CAL-27细胞凋亡的流式细胞仪分析
经FCM 检测发现,浓度为36mg/mL 的LSPM1作用于CAL-27 细胞12h 后,早期凋亡率和晚期凋亡率分别为37.20%和10.09%;浓度为36mg/mL 的LSPM2 作用于CAL-27 细胞12h 后,早期凋亡率和晚期凋亡率分别为11.22%和69.48%;而对照组的早期凋亡率和晚期凋亡率分别为2.23%和4.27%。可见,实验组结果明显高于对照组(见图3)。

图3 LSPM1和LSPM2对CAL-27细胞凋亡的影响
2.4 琼脂糖凝胶电泳法分析细胞凋亡
琼脂糖凝胶电泳显示,36mg/mL LSPM1和36mg/mL LSPM2对CAL-27细胞作用不同的时间后,DNA 出现片段化,在250~750bp之间出现明显的“阶梯状”DNA 条带,说明DNA 在核小体连接处被切断,CAL-27 细胞发生凋亡。由此证明了乳杆菌A-2代谢产物可诱导CAL-27细胞凋亡。
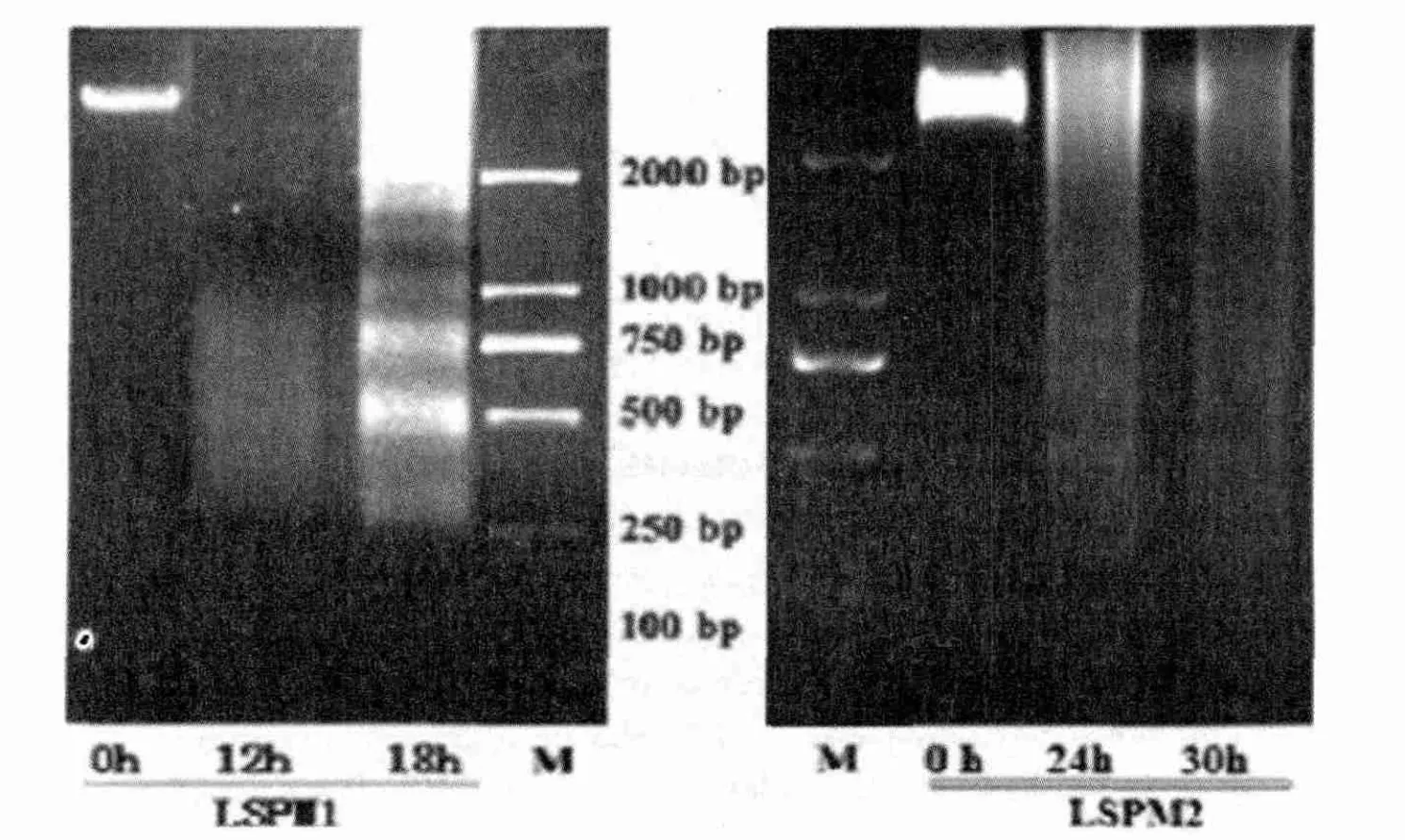
图4 LSPM1和LSPM2诱导CAL-27细胞凋亡电泳图
3 讨论
益生菌是口腔微生物菌群的重要组成菌,益生菌(尤其是乳杆菌)可通过抑制致病菌生长和繁殖、与致病菌竞争口腔黏膜表面的黏附位点等,保护口腔健康,预防口腔软硬组织疾病。肖越红等[5]研究证明乳杆菌DM9811代谢产物脂肪酸组分对口腔白假丝酵母菌有明显的抑杀作用;对口腔链球菌有促进作用,可能有调整口腔菌群平衡的作用。曲虹等[6]研究发现乳杆菌DM9811(Lactobacillus DM9811)代谢产物可以改善固定正畸治疗患者的改良菌斑指数(MPLI)和唾液pH,抑制变形链球菌(streptococcusmutans)生长和维持正畸治疗患者的口腔内菌群平衡。
肽聚糖(peptidoglycan,PG)是乳酸杆菌细胞壁的主要组成成分[7]。研究显示肽聚糖成分在提高肌体免疫监视功能方面可能起重要作用。温晓庆等[8]以肝癌H22细胞移植瘤KM 小鼠为模型,研究干酪乳杆菌(Lactobacillus case)细胞壁肽聚糖的抗肿瘤作用,结果显示,实验组增殖细胞核抗原(PCNA)的m RNA 表达和BLC-2基因的蛋白表达平均光密度值均明显低于对照组,且抑瘤率37.21%。
乳杆菌的代谢产物乳杆菌胞外多糖(exopoly-saccharides,EPS)具有抗肿瘤、免疫调节等功能。Choi等[9]研究证实嗜酸乳杆菌EPS具有抗癌活性且可诱导HT-29结肠癌细胞凋亡。张钧等[10]研究表明乳杆菌EPS在体外有一定的促进对人大肠癌LS174T 细胞的凋亡的作用。翟硕莉[11]报道了乳酸菌胞外多糖抗肿瘤的作用机制之一是乳酸菌能够诱导癌细胞凋亡。王江等[12]证明弯曲乳杆菌T79-3黏附能力最强,对金黄色葡萄球菌的抑制作用最强,排除作用方式抑制金黄色葡萄球菌黏附He La细胞作用效果较好,提示乳杆菌T79-3有可能作为益生菌防治妇女泌尿生殖道感染。
乳清蛋白主要用于治疗糖尿病和高血压,在抗肿瘤方面的研究较少[13,14]。乳清蛋白主要由β-乳球蛋白(β-Lactoglobulin,BLG,58%)和α-乳白蛋白(α-Lactalbumin,ALA,13%)组成。β-乳球蛋白是硫氨基酸主要来源,具有免疫调节作用,α-乳白蛋白具有预防癌症的功能[15]。而且,乳清蛋白中的生物活性肽和氨基酸可以通过蛋白酶降解或微生物发酵而释放出来。本实验中,通过乳杆菌A-2去降解乳清蛋白和乳清蛋白与菊糖组成的混合物,分别得到代谢产物LSPM1和LSPM2,已经证实LSPM1和LSPM2中含有一些多肽、氨基酸、短链脂肪酸,乳酸、醋酸、丁酸等化学物质。利用人舌鳞癌细胞系CAL-27 体外培养模型初步评价了LSPM1和LSPM2的抗癌活性,为益生菌代谢产物在治疗口腔癌方面提供理论和实验基础。
[1]张震康,俞光岩.口腔颌面外科[M].北京:北京大学医学出版社,2007,339-340
[2]于世凤.口腔组织病理学[M].北京:人民卫生出版社,2003,338-339
[3]张秀静,王心彧,张国梁,等.植物乳杆菌代谢产物和Ca2+诱导人舌鳞癌CAL-27细胞凋亡的研究[J].黑龙江医药科学,2013,36(2):16-17
[4]史晓艳,陈骏,车团结,等.嗜酸乳杆菌对人舌癌细胞增殖的影响[J].华西口腔医学杂志,2012,30(1):87-92
[5]肖越红,唐立,文姝,等.乳杆菌DM9811代谢产物脂肪酸组分对义齿性口炎患者口腔中白假丝酵母菌的抑制[J].中国微生态学杂志,2006,18(1):35-37
[6]曲虹,闫莉肭,文殊,等.乳杆菌DM9811代谢产物对固定正畸治疗患者口腔内主要致龋菌的影响[J].中国微生态杂志,2010,22(1):43-47
[7]Ingrid W,Gerhard R,Beatrice LP.Protective role of pro biotics and pre biotics in colon cancer[J].Am J Clin Nutr,2001,73:451-455
[8]温晓庆,托娅,段智变,等.Lb.casei Zhang肽聚糖体内外抗肿瘤作用[J].山西农业大学学报,2008,28(3):353-361
[9]Chois S,Kim Y,Han KS,et al.Effects of Lactobacillus strains on cancer cell proliferation and oxidative stress in vitro[J].Lett Appl Micro bio,2006,42(3):452-458
[10]张钧,刘宁,孟晨详.保加利亚乳杆菌胞外多糖对人癌细胞抑制作用的研究[J].中华预防医学杂志,2007,41(3):238-239
[11]翟硕莉.乳酸菌胞外多糖的培养条件及应用现状[J].科技风,2011,8:154
[12]王江,张瑞芬,周莉,等.乳杆菌抑制金黄色葡萄球菌对He La细胞的黏附[J].生物工程学报,2012,28(6):715-725
[13]Keefe JH,Bell DSH.Postprandial Hyperglycemia/Hyperlipidemia(Post prandialdys metabolism)is a cardiovascular risk factor[J].Am J Cardiol,2007,100(5):899-904
[14]Yu-Mi Lee,Thomas S,Michael H.Effect of a milk drink supplemented with whey peptides on blood pressure in patients with mild hypertension[J].Eur J Nutr,2007,46(3):21-27
[15]李莹,林晓明.乳清蛋白营养特点与功能作用[J].中国食物与营养,2008,6(6):62-64
