离子色谱法测定合成气制烯烃产物中的C1~C6有机酸
2014-10-22顾一丹李继文宋卫林张祥民
顾一丹,李继文,宋卫林,张祥民
(1.上海石油化工研究院,上海 201208;2.复旦大学化学系,上海 200433)
合成气制烯烃(syngas to olefins,SGTO)[1,2]是以合成气(H2+CO)为原料制得C2~C4烯烃及副产汽油、柴油等馏分的反应。合成过程中最主要的一类副产物为含氧化合物,包括醇、酮、醛、酸、醚等,其中SGTO反应过程中生成的酸主要是C1~C6小分子有机酸,这些酸类物质会对装置及设备产生腐蚀,影响装置运行的安全性。因此,SGTO产物中有机酸含量的测定对研究SGTO反应特征、改进催化剂制备、优化反应工艺参数、选择合适的装置设备材料具有非常重要的意义[3,4]。
有机酸常用的检测方法有高效液相色谱法[5]、毛细管电泳法[5-8]和离子色谱法[9-11]等。近年来离子色谱产品生产公司推出的高选择性、高容量的离子色谱分离柱可以实现对低碳小分子有机酸的良好分离[12,13]。C1~ C4有机酸与水混溶,戊酸能溶于30倍体积的水中,己酸(俗称羊油酸)微溶于水,C5以上的有机酸随着碳数的增大,水溶性变差,油溶性增强。C1~C6有机酸在水溶液中部分电离呈离子状态,比较适合使用离子色谱进行测定。目前文献报道的主要是针对水样中有机酸的测定,对油样中有机酸的测定报道较少,其难点主要是样品的预处理[14]。本实验针对SGTO水相产物和油相产物中低碳有机酸测定的需要,采用IonPac AS11-HC型阴离子交换分离柱分离,电导检测器检测建立了C1~C6小分子有机酸的离子色谱测定方法,并用该方法对SGTO水相产物和油相产物中C1~C6小分子有机酸进行了测定。
1 实验部分
1.1 仪器和设备
ICS-1100型离子色谱仪(美国Dionex公司),配有RFC30淋洗液自动发生器、电导检测器和变色龙色谱工作站;Dionex公司的IonPac AS11-HC型分离柱(250 mm×4 mm)、IonPac AG11型保护柱(50 mm×4 mm)和ASRS-ULTRA阴离子自身抑制器。2 mL玻璃注射器及其他实验室常备的玻璃和塑料器皿。
1.2 试剂及材料
甲酸(色谱纯,迪马科技),纯度大于99.0%;乙酸(分析纯,纯度大于99.5%)、戊酸(分析纯,纯度大于99%)、己酸(分析纯,纯度大于98%)(国药集团);丙酸钠(分析纯,纯度大于99%,固体)、丁酸钠(分析纯,纯度大于98%,固体)(梯希爱上海化成试剂有限公司);实验用水为超高纯水(Millipore公司的Milli-Q超纯水系统制备);0.22 μm水系醋酸纤维膜。
1.3 标准溶液的配制
分别准确称取丙酸钠、丁酸钠固体1.0282 g、1.0125 g(精确至0.1 mg),用水溶解并定容于100 mL容量瓶中,制备质量浓度分别为10282 mg/L、10125 mg/L的丙酸钠、丁酸钠储备液,备用。
取甲酸50 μL,乙酸、戊酸、己酸各100 μL,丙酸钠、丁酸钠溶液各10 mL定容于500 mL容量瓶中,制备甲酸、乙酸、丙酸、丁酸、戊酸、己酸质量浓度分别为99、199、159、162、99、98 mg/L 的储备液。用上述溶液再稀释配制所需的系列浓度的混合标准溶液(见表1),用于定量工作曲线的绘制。
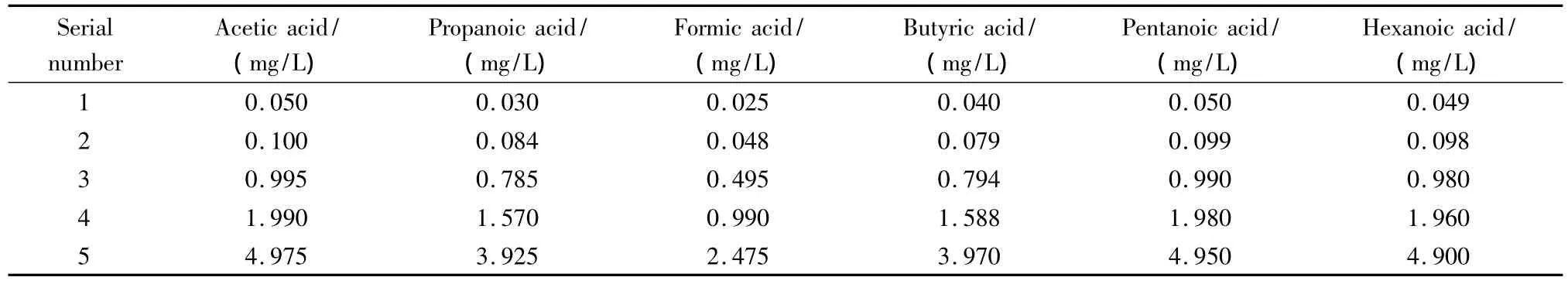
表1 绘制标准工作曲线的混合标准溶液的质量浓度Table 1 Mass concentrations of standard serial solutions for standard working curves
1.4 色谱条件
采用KOH溶液梯度淋洗,梯度淋洗程序:初始KOH溶液浓度为3 mmol/L,保持10 min,然后KOH溶液浓度以等梯度升高,至20 min时KOH溶液浓度升至30 mmol/L,然后KOH溶液浓度以等梯度下降,至30 min时KOH溶液浓度降至3 mmol/L;流速1 mL/min。进样量25 μL,柱温30℃,抑制电流75 mA,以峰面积定量。
1.5 样品预处理
1.5.1 SGTO水相产物样品的处理
采用2级稀释的办法处理样品:第1级稀释10倍,第2级稀释50倍,即用水将样品稀释500倍后进行分析。
1.5.2 SGTO油相产物样品的处理
取20 mL油相样品置于分液漏斗中,加入等体积的0.05 mol/L NaOH溶液,盖上瓶盖振荡5 min后静置20 min,取下层清液,吸取其中500 μL,并用水稀释、定容至50 mL(稀释100倍),用注射器吸取2 mL并经滤膜过滤,滤液供离子色谱分析。根据具体样品碱洗3~5次。
2 结果与讨论
2.1 C1~C6正构羧酸混合标准溶液的分离
经过优化得到1.4节的色谱条件,图1为优化条件下表1中4#混合标准溶液的分离色谱图。从图1可以看出,C1~C6有机酸的分离效果良好,特别是分离难度比较大的C1~C4有机酸得到了良好的分离。在己酸流出后,还会有水中常见的阴离子如碳酸根、草酸根以及硫酸根等流出,因此梯度淋洗程序待己酸流出后,需要使用较高浓度的淋洗液淋洗以保证这些可能存在的干扰离子流出。

表2 C1~C6有机酸的标准工作曲线、线性相关系数和线性范围Table 2 Calibration curves,correlation coefficients(R2)and linear ranges of C1-C6organic acids

表3 C1~C6有机酸测定的精密度和回收率(n=5)Table 3 Precisions and recoveries of C1-C6organic acids(n=5)
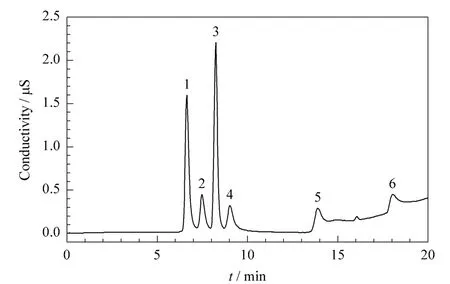
图1 C1~C6正构羧酸混合标准溶液的离子色谱图Fig.1 IC chromatograms of a mixed solution of C1-C6organic acid standards
2.2 标准工作曲线的绘制
由于离子色谱的灵敏度很高,同时为了保证C1~C4有机酸的良好分离,因此配制的标准溶液的浓度比较低(见表1)。在实际样品测定时,需要将样品稀释以调节样品中有机酸的浓度在标准工作曲线的线性范围内。采用1.4节色谱条件对表1中1#~5#标准溶液进行分析,以峰面积Y(μS·min)为纵坐标,标准溶液的质量浓度X(mg/L)为横坐标绘制标准工作曲线,得到各组分的线性回归方程见表2。从表2可以看出,C1~C6小分子有机酸在各自配制的浓度范围内呈现良好的线性关系,相关系数均大于0.99。测定1#标准溶液的峰高和噪声,以信噪比(S/N)为3计算各组分的检出限(LOD)(见表1)。
2.3 方法的精密度和回收率
为了考察方法的精密度和准确性,另外配制2个浓度水平的混合标准溶液(见表3),每个浓度水平样品平行测定5次,用表2的标准工作曲线进行计算,得出各离子的质量浓度,计算相对标准偏差(RSD)和回收率,结果见表3。表3的结果表明,各组分的RSD均小于4%,回收率在95.6%~104.3%之间,定量数据的精密度良好,定量结果准确可靠。
2.4 SGTO水相产物中C1~C6有机酸的测定
2.4.1 样品预处理
SGTO水相产物中C1~C6有机酸的含量较高,不能直接进样分析,其原因包括:C1~C4有机酸浓度太高会影响其分离效果;高浓度的组分会在色谱系统中残留而影响后面的分析;而且,SGTO水相产物中除了含有C1~C6有机酸外,还溶解了一些低碳的醇、酮、醛类含氧化合物(如乙醇、丙酮、丁酮等),这些含氧化合物包括有机酸在内的总量约为2%~3%,虽然这些醇、酮、醛类有机物在水中不能电离,但浓度较高时会影响柱效,导致基线波动,直接进样分析会影响定量的准确性和精密度。本文根据实际样品中有机酸的浓度进行了优化试验,在保证分离和减少干扰的前提下,选择稀释倍数为500倍。为了减少稀释过程中的相对误差,采用2级稀释的办法,第1级稀释10倍,第2级稀释50倍,最终用水稀释500倍后进行分析。样品稀释会相应提高各组分的检出限,因此稀释的倍数必须考虑稀释后各组分的检出限在可以接受的范围内。根据稀释倍数换算,实际样品中6种有机酸的检出限为乙酸2.0 mg/L、丙酸1.0 mg/L、甲酸 0.5 mg/L、丁酸6.0 mg/L、戊酸6.0 mg/L、己酸5.0 mg/L。考虑到SGTO实际水相样品中的有机酸总量以及C2~C4有机酸含量比较高,上述稀释倍数及检出限可以接受。
2.4.2 样品测定
样品稀释后用上述所建方法对稀释后的样品进行测定。用标准工作曲线对样品中的有机酸进行计算,在离子色谱测定结果的基础上乘以样品稀释倍数500,即为样品中C1~C6有机酸的最终浓度。表4为3组SGTO水相产物中C1~C6有机酸的测定结果,图2为稀释500倍的样品III的分离色谱图。从图2可以看出,SGTO水相产物样品稀释500倍后分离效果良好,基线平滑,说明样品中其他有机物对有机酸的测定没有明显的干扰。SGTO水相产物样品中5.35 mg/L的己酸可以被检出,与前面计算的检出限一致,可以满足要求。样品稀释500倍依然能够满足实际检测的需要得益于离子色谱的高灵敏度。
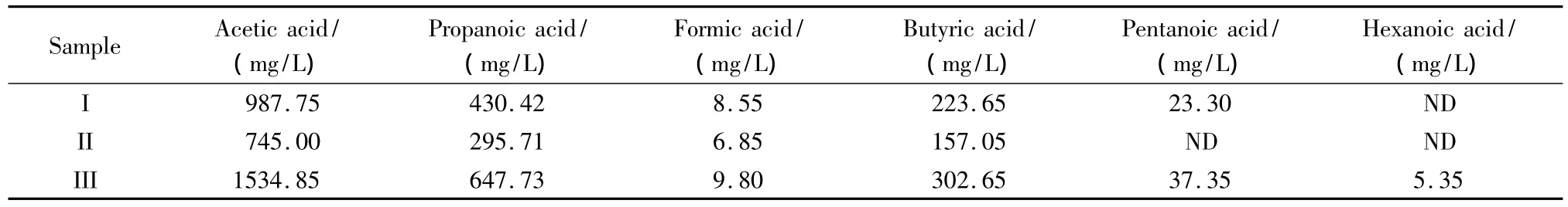
表4 实际SGTO水相产物样品中C1~C6有机酸的质量浓度Table 4 Mass concentrations of C1-C6organic acids in the water phase samples of SGTO
表4的测定结果表明,SGTO水相产物中C2~C4有机酸含量较高,甲酸的含量较低,戊酸和己酸含量较低甚至无法检出。SGTO产物中有机酸含量较高为SGTO的工业化提出了挑战。
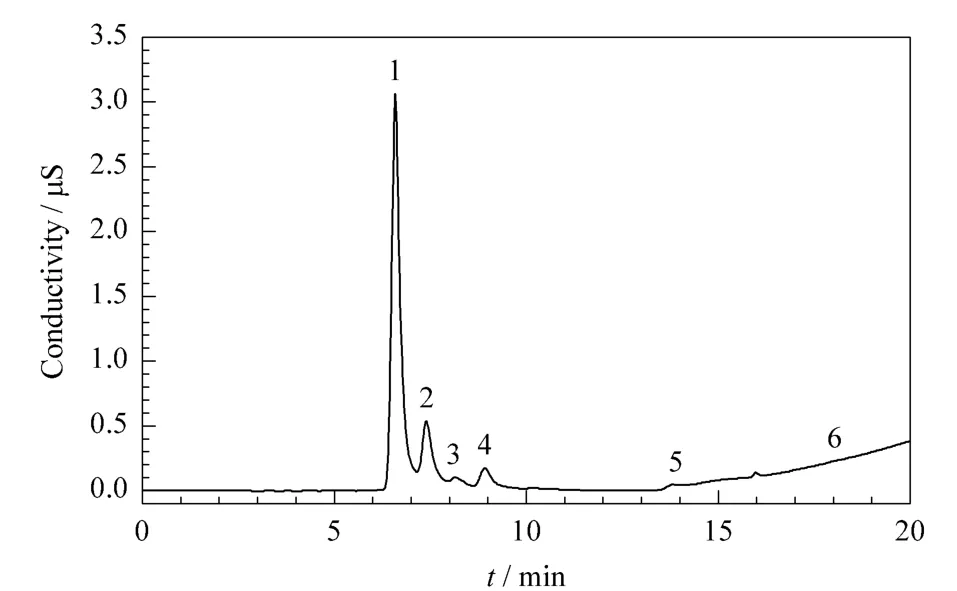
图2 实际SGTO水相产物中C1~C6有机酸的离子色谱图Fig.2 IC chromatogram of C1-C6organic acids in a water phase sample of SGTO
2.5 SGTO油相产物中C1~C6有机酸的测定
2.5.1 样品预处理
SGTO油相产物中的有机酸无法用离子色谱直接测定,必须转移至水相形成离子状态才能用离子色谱进行分析,因此油相产物中的有机酸可用水或碱液萃取后测定。经试验发现水洗的效果不是很好,SGTO油相产物样品水洗5次后仍然有较高含量的有机酸存在油相中,这是由于有机酸在油相和水相中存在一定的分配比例,而且随着碳链的增加,有机酸的油溶性越来越强,水溶性越来越差。
有机酸为弱酸,甲酸在脂肪酸中酸性最强,电离常数Ka=2.1×10-4。随着碳链的加长,有机酸的酸性越来越弱。采用碱洗的方法进行样品处理,由于碱液能够中和有机酸从而促使有机酸向水相转移,因此碱洗的效果要优于水洗的效果。本实验采用NaOH溶液碱洗SGTO油相产物中的有机酸,并对碱液的浓度进行了优化。配制不同浓度的NaOH溶液,对一个SGTO油相产物样品进行洗涤试验。试验结果表明,洗涤效果最好的NaOH溶液浓度为0.05 mol/L。当NaOH溶液的浓度从0.005 mol/L逐渐升至0.05 mol/L时,碱洗的总体效果越来越好。但当碱液浓度高于0.05 mol/L时会出现乳化的现象,洗脱的效果反而变差。实验还考察了碱洗次数的影响。由于样品中有机酸的含量不同,碱洗的次数也会有所不同。碱洗的次数需要根据碱洗的结果进行判断,直到最后一次碱洗液的测定结果小于第1次碱洗测定结果的2%或无检出即认为碱洗完全,这时残留在油相中的有机酸对整体的测定结果没有大的影响。实际样品测定过程中,根据油相样品中有机酸的含量碱洗3~5次可以达到上述要求。另外,采用相同体积的碱液进行萃取是为了便于计算和数据处理。
2.5.2 样品测定
用上述所建立的方法对SGTO油相产物每次碱洗后的萃取液进行了小分子有机酸含量测定,将每次测定结果加和后乘以样品稀释倍数100,即为样品中小分子有机酸的最终浓度。表5为3组SGTO油相产物中小分子有机酸的测定结果,图3为样品3第1次碱洗并稀释后的分离色谱图。
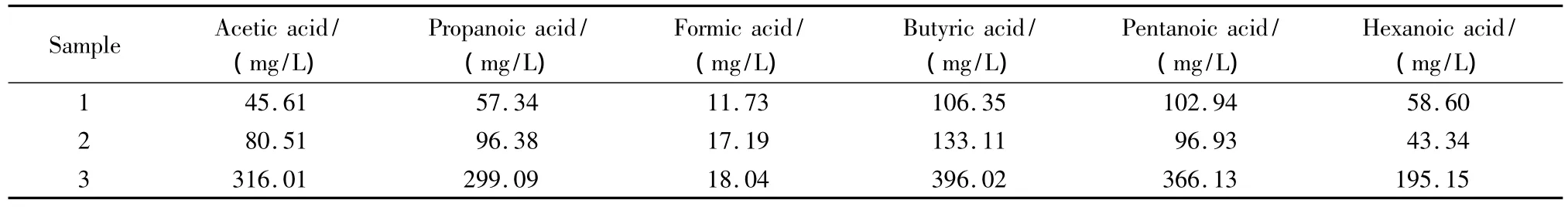
表5 实际SGTO油相产物中C1~C6有机酸的质量浓度Table 5 Mass concentrations of C1-C6organic acids in the oil phase samples of SGTO
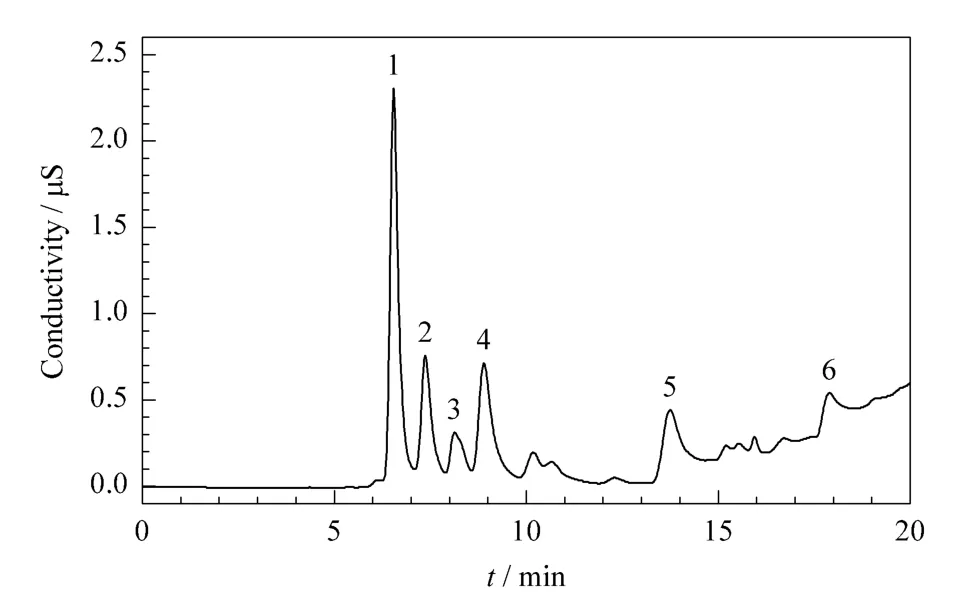
图3 实际SGTO油相产物中C1~C6有机酸的离子色谱图Fig.3 IC chromatogram of C1-C6organic acids in an oil phase sample of SGTO
SGTO油相产物和水相产物中C1~C6有机酸的测定结果比较表明,SGTO油相产物中戊酸和己酸的含量远高于水相产物,其原因是随着有机酸碳数的升高,其油溶性增强。水相产物和油相产物中的甲酸含量均较低,说明SGTO反应本身产生的甲酸较少。从图3可以看出,油相产物样品中不仅含有C1~C6的正构有机酸,同时可能含有戊酸和己酸的异构体。在正丁酸和正戊酸之间的峰以及在正戊酸和正己酸之间的峰是否分别是戊酸和己酸的异构体还有待进一步研究。
SGTO产物中C1~C6有机酸含量较高不仅对实验室研究和工业化过程中塔釜的材质提出了较高的要求,而且会影响到SGTO产物的质量,尤其是油溶性较强的C4以上有机酸的分离和脱除将成为一个重要的课题。
2.5.3 SGTO油相产物样品的加标回收率测定
为了进一步考察整个碱洗过程对测定结果准确性的影响,在上述经多次碱洗已不含有有机酸的油相产物样品中添加一定量的甲酸、乙酸、戊酸和己酸(由于丙酸和丁酸的标准样品是钠盐,故没有加入进行加标回收试验),然后按照SGTO油相产物样品的处理方法进行处理并测定。4种有机酸在SGTO油相产物样品中的加标回收率见表6。从表6的结果可以看出,SGTO油相产物样品中的加标回收率在91.1%~96.8%之间,5次重复测定的相对标准偏差为0.7%~2.3%,准确性可以满足实际分析的需要。
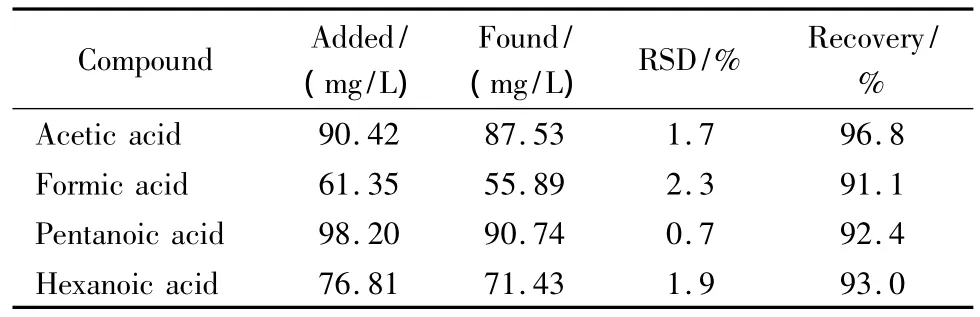
表6 SGTO油相产物样品中4种有机酸的加标回收率Table 6 Recoveries of the four organic acids spiked in a SGTO oil phase sample
3 结论
采用离子色谱建立了SGTO水相产物和油相产物中C1~C6有机酸的测定方法。标准样品的试验结果表明:C1~C6有机酸的质量浓度在各自配制的浓度范围内均呈现良好的线性关系,相关系数均大于0.99。标准溶液的回收率测定结果为回收率在95.6%~104.3%之间,5次重复测定的相对标准偏差在0.4%~3.6%之间,表明该方法具有良好的准确性和精密度。SGTO油相样品中的加标回收率在91.1%~96.8%之间,5次重复测定的相对标准偏差在0.7%~2.3%之间,准确性可以满足实际分析的需要。
实际SGTO水相产物和油相产物中C1~C6有机酸分析结果表明,SGTO水相产物中C2~C4有机酸含量较高,而SGTO油相产物中C4~C6有机酸含量较高。SGTO产物中有机酸含量较高对SGTO的工业化提出了挑战。
[1]Zhang L P,Xin Z.Applied Chemical Industry(张丽平,辛忠.应用化工),2009,38(5):731
[2]Dong L,Yang X P.Petrochemical Technology(董丽,杨学萍.石油化工),2012,41(10):1201
[3]Teng B T,Chang J,Zhang C H,et al.Appl Catal A General,2006,301(1):39
[4]Wang X F,Wang F,Chen M Y,et al.Journal of Fuel Chemistry and Technology(王雪峰,王锋,陈满英,等.燃料化学学报),2005,33(5):612
[5]Yang Z X,Wang X Y,Li M.Beer Technology(杨朝霞,王珣璎,李梅.啤酒科技),2009(9):17
[6]Wang M,Qu F,Lin J M.Journal of Analytical Science(王敏,屈锋,林金明.分析科学学报),2005,21(4):454
[7]Han H F,Wang Q,Liu X,et al.Chinese Journal of Chromatography(韩海峰,王庆,刘霞,等.色谱),2012,30(5):538
[8]Garcia A,Olmo B,Lopez-Gonzalvez A,et al.J Pharm Biomed A-nal,2008,46:356
[9]Hou K W,Hou D J,Qian M H,et al.Modern Scientific Instruments(侯凯文,侯读杰,钱门辉,等.现代科学仪器),2010(5):90
[10]Zhao J T,Xi H B,Song G Q,et al.Industrial Water Treatment(赵京田,席宏波,宋广清,等.工业水处理),2012,32(9):72
[11]Zhang Y Q,Wu H.Petroleum Processing and Petrochemicals(张月琴,吴昊.石油炼制与化工),2009,40(6):51
[12]Zhong Y,Yu C L,Peng P A.Chinese Journal of Chromatography(钟颖,于赤灵,彭平安.色谱),2010,28(10):923
[13]Kozaki D,Shi C H,Tanaka K,et al.Chinese Journal of Chromatography(Kozaki D,Shi C H,Tanaka K,等.色谱),2012,30(4):361
[14]Fan Y C,Zhu Y.Chinese Journal of Chromatography(范云场,朱岩.色谱),2007,25(5):633
