Chiralpak AD-H和Chiralcel OJ-H手性固定相拆分扁桃酸系列化合物
2014-10-22王敏
王 敏
(中国科学院福建物质结构研究所,福建 福州 350002)
扁桃酸系列化合物既是一类具有广泛用途的医药、化工产品,又是制备化学中重要的合成砌块。该类化合物含有一个手性中心,具有左旋和右旋两种光学异构体,其单一光学对映体在生物活性上通常存在较大差异,因此对扁桃酸系列化合物的拆分研究具有很重要的意义[1-4]。目前,关于扁桃酸的拆分方法已发展为化学拆分、酶拆分、色谱拆分、分子印迹拆分、毛细管电泳拆分等[1,2]。前两种拆分方法主要用于生产制备,后3种拆分方法主要用于分析检测。其中,液相色谱拆分法因具有高选择性、高稳定性、高效率等诸多优势,在手性分析检测中占有重要席位[5-8]。在高效液相色谱(HPLC)中,采用商品化的淀粉型手性固定相和纤维素型手性固定相拆分个别扁桃酸化合物虽已有一些报道[9-14],但是对于一系列结构极为相似的扁桃酸化合物的手性拆分的系统研究还未见报道。
本文在纤维素型手性固定相Chiralpak AD-H和淀粉型手性固定相Chiralcel OJ-H手性柱上对8个扁桃酸化合物(结构如图1所示)进行了拆分对比研究,考察了扁桃酸系列化合物苯环上的取代基对其在手性固定相上被识别的难易程度的影响,并探讨了手性拆分机理。该研究可为一些实际光学活性扁桃酸及其类似物的对映体纯度测定与拆分研究提供参考。
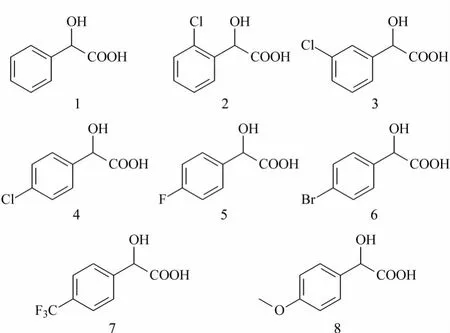
图1 扁桃酸系列化合物的结构Fig.1 Structures of the mandelic acid and its analogs
1 实验部分
1.1 仪器和试剂
日本岛津公司的LC-20AD高效液相色谱仪,配有光电二极管阵列(PDA)检测器、手动进样器、手性柱 Chiralcel OJ-H(250 mm ×4.6 mm,5 μm)和Chiralpak AD-H(250 mm ×4.6 mm,5 μm)。
正己烷、异丙醇(iPrOH)为HPLC纯(德国默克公司);三氟乙酸(TFA)为分析纯(中国国药集团化学试剂公司);扁桃酸、2-氯扁桃酸、3-氯扁桃酸、4-氯扁桃酸、4-氟扁桃酸、4-溴扁桃酸、4-三氟甲基扁桃酸和4-甲氧基扁桃酸外消旋标准品均为分析纯(Aldrich公司)。
1.2 标准溶液的配制
称量外消旋标准品5 mg,溶于5 mL异丙醇中,溶解后转移至10 mL容量瓶中,用异丙醇定容至刻度,摇匀,获取质量浓度为500 mg/L的外消旋标准溶液。
1.3 色谱条件
色谱柱为Chiralcel OJ-H柱和Chiralpak AD-H。流动相为不同配比的正己烷-异丙醇-三氟乙酸混合物,用前经过0.45 μm微孔滤膜过滤,并超声脱气30 min;流速1 mL/min。检测波长为210~230 nm范围内每个化合物的最大吸收波长值;柱温35℃;进样体积10 μL。色谱死时间通过进样 1,3,5-三叔丁基苯测定。
2 结果与讨论
2.1 Chiralpak AD-H手性柱对扁桃酸系列化合物的拆分
在正相条件下,采用分离酸性物质常用的流动相配比,以正己烷-异丙醇-三氟乙酸(90∶10∶0.1,v/v/v)为流动相,首先考察了8个扁桃酸化合物在手性柱Chiralpak AD-H上的拆分情况(见表1)。如表1所示,在上述条件下Chiralpak AD-H手性固定相对扁桃酸对映体的选择性识别能力最强(分离因子(α)最大,为1.20);对带有取代基的扁桃酸对映体的选择性识别能力都有不同程度的下降,其中对2-氯扁桃酸对映体的选择性识别能力最强(α为1.10),对3-氯扁桃酸、4-甲氧基扁桃酸、4-氟扁桃酸对映体的选择性识别能力依次降低(α依次为1.09、1.07、1.05),对 4-氯扁桃酸、4-溴扁桃酸和 4-三氟甲基扁桃酸对映体没有选择性(α为1.00)。在上述条件下,8个外消旋扁桃酸化合物中扁桃酸获得了最大分离度(Rs为2.86),2-氯扁桃酸实现了基线分离(Rs为1.60),3-氯扁桃酸和4-甲氧基扁桃酸实现了基本分离(1.0<Rs<1.5),4-氟扁桃酸仅有小部分分离(Rs为0.34),4-氯扁桃酸、4-溴扁桃酸和4-三氟甲基扁桃酸则完全没有被分离(Rs为0)。3-氯扁桃酸和4-甲氧基扁桃酸在优化的流动相正己烷-异丙醇-三氟乙酸(95∶5∶0.1,v/v/v)条件下可以实现基线分离,分离度分别为1.83和2.07,而对于扁桃酸系列化合物4~7(见图1),距离实现基线分离的目标差距太大,即使再优化条件也很难达到。更换适宜的手性柱是较快实现该系列 化合物基线分离目标的方法。典型色谱图见图2。
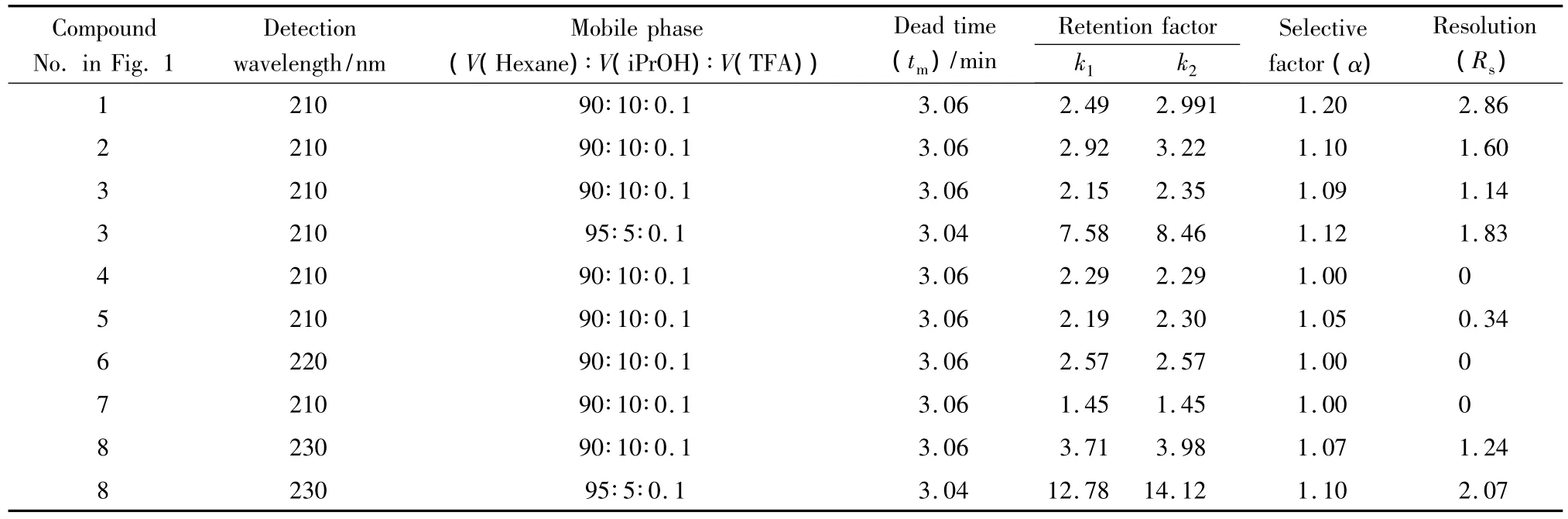
表1 不同配比的流动相体系下外消旋扁桃酸系列化合物在Chiralpak AD-H手性柱上的拆分Table 1 Enantioseparations of racemic mandelic acid and its analogs on a Chiralpak AD-H column by using various mixtures of hexane-isopropanol-TFA as mobile phases
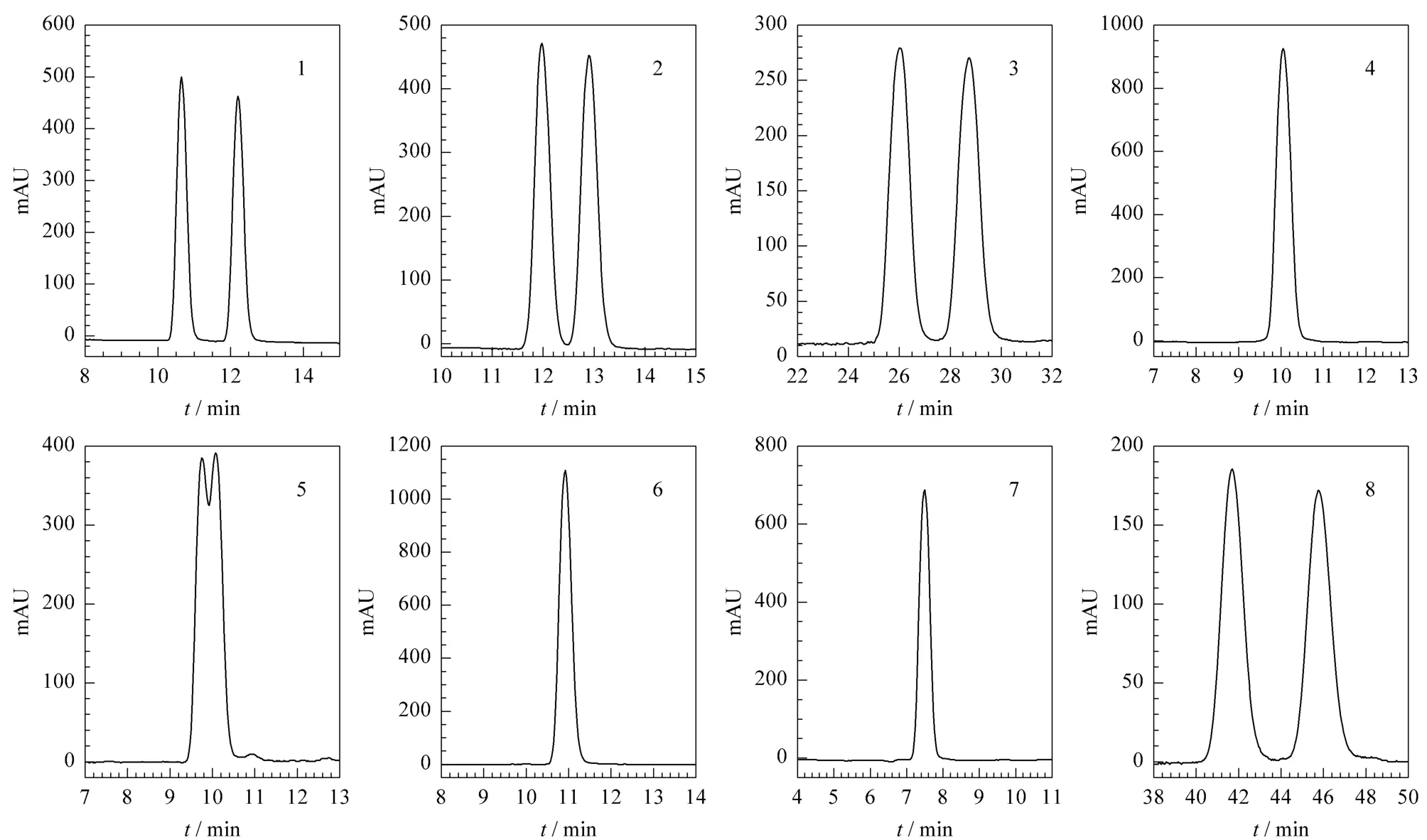
图2 8种扁桃酸系列化合物在Chiralpak AD-H柱上拆分的典型色谱图Fig.2 Typical chromatograms of enantioseparations of the eight mandelic acid compounds on a Chiralpak AD-H column
2.2 Chiralcel OJ-H手性柱对扁桃酸系列化合物的拆分
在淀粉型手性固定相Chiralcel OJ-H柱上我们首先考察了在Chiralpak AD-H柱上不能分离的扁桃酸化合物4~7的拆分情况。如表2所示,以正己烷-异丙醇-三氟乙酸(95∶5∶0.1,v/v/v)为流动相,上述4个外消旋化合物都能达到基线分离。在同样色谱条件下,2-氯扁桃酸和3-氯扁桃酸也得到了很好的拆分(Rs>4),但是分析时间偏长,2-氯扁桃酸的拆分需要50 min;增加流动相中极性溶剂异丙醇的比例,将流动相调整为正己烷-异丙醇-三氟乙酸(90∶10∶0.1,v/v/v),2-氯扁桃酸的拆分在 20 min内即可完成,且分离因子基本不变,分离度仍然很高(Rs=4.26)。在流动相为正己烷-异丙醇-三氟乙酸(90∶10∶0.1,v/v/v)条件下,其余 3 种扁桃酸化合物1、3和8都可以被完全地拆分。典型色谱图见图3。
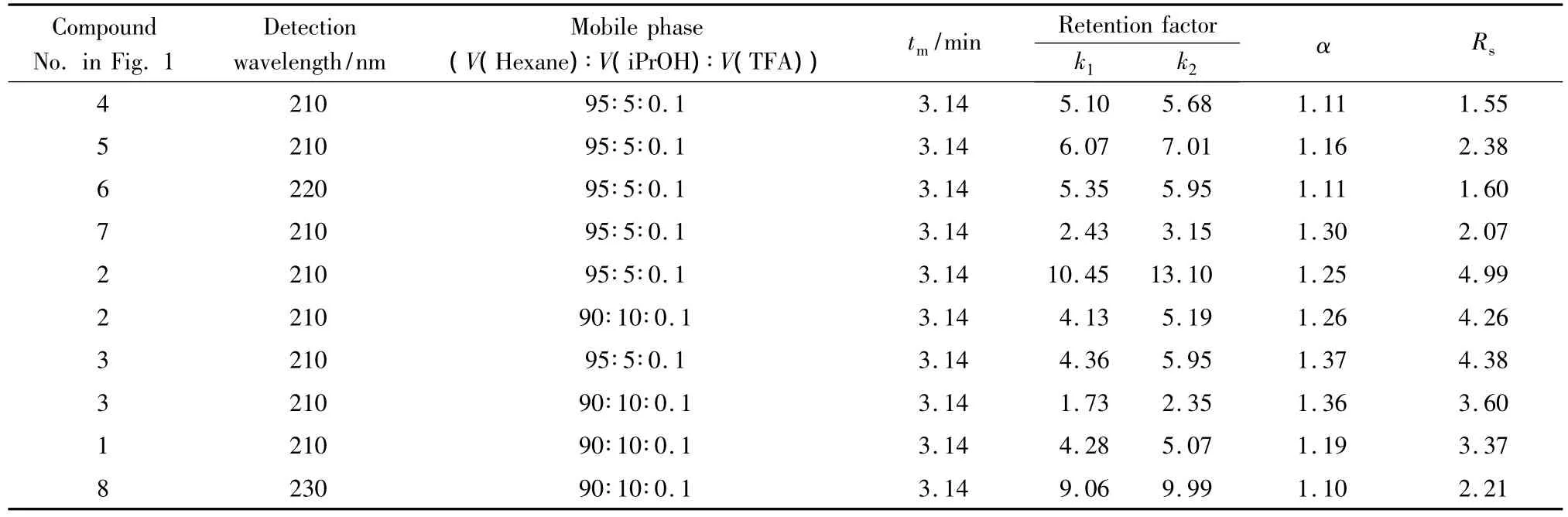
表2 不同配比的流动相体系下外消旋扁桃酸系列化合物在Chiralcel OJ-H手性柱上的拆分Table 2 Enantioseparations of racemic mandelic acid and its analogs on a Chiralcel OJ-H column by using various mixtures of hexane-isopropanol-TFA as mobile phases
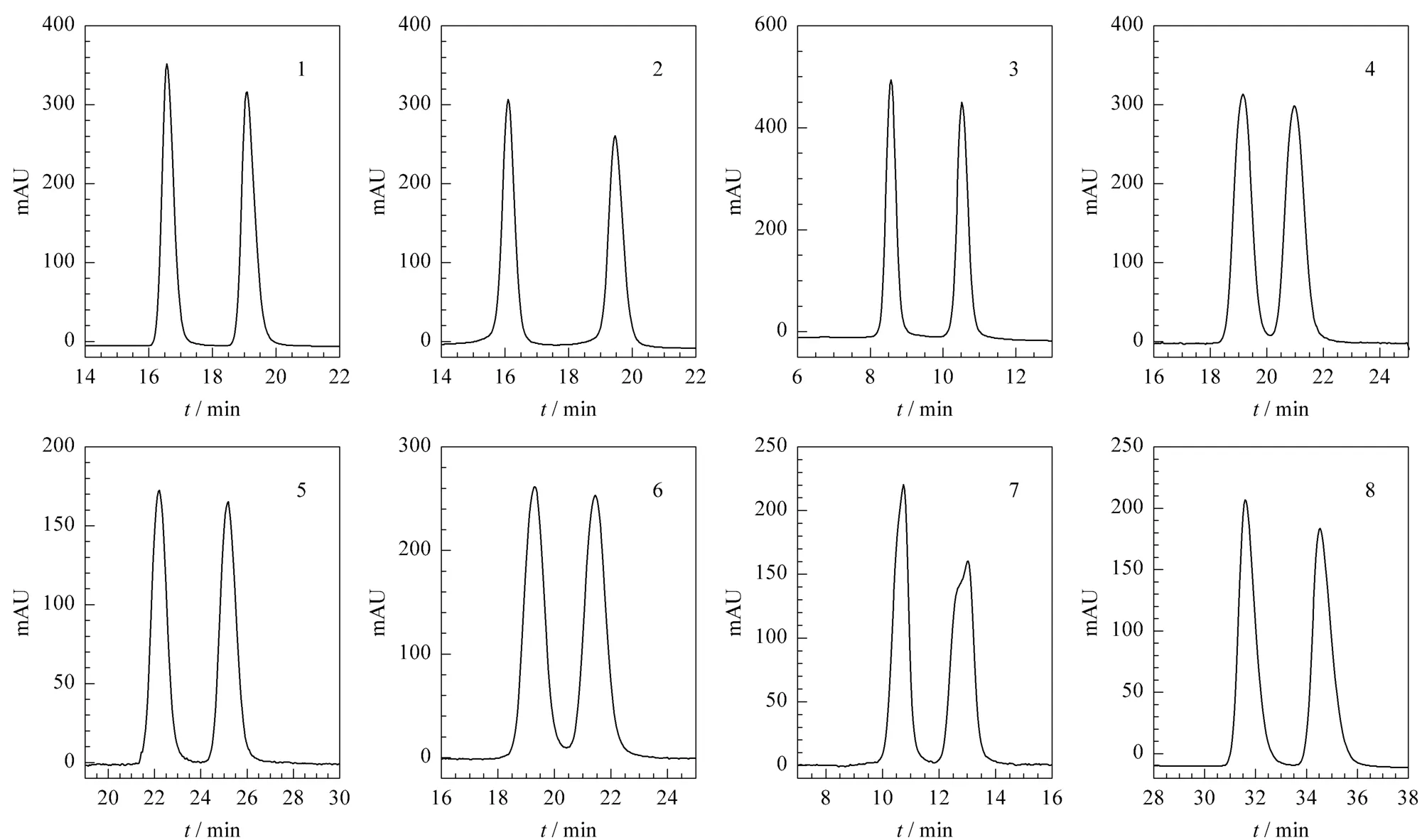
图3 8种扁桃酸系列化合物在Chiralcel OJ-H柱上拆分的典型色谱图Fig.3 Typical chromatograms of enantioseparations of the eight mandelic acid compounds on a Chiralcel OJ-H column
2.3 Chiralpak AD-H和Chiralcel OJ-H手性柱的拆分对比和拆分机理探讨
通过对比可以发现两种类型的手性柱对扁桃酸系列化合物的拆分情况有同有异。共同点是在相同的色谱条件下所有被测扁桃酸类化合物在淀粉型手性固定相Chiralcel OJ-H柱上的保留时间都大于在纤维素型手性固定相Chiralpak AD-H柱上的保留时间;增加流动相中极性溶剂异丙醇的比例都可以缩短分析时间,减小拆分底物的分离度。不同点在于两种手性柱对扁桃酸系列化合物的拆分选择性不同,Chiralpak AD-H柱对扁桃酸和2-氯扁桃酸的拆分能力较强,对3-氯扁桃酸、4-甲氧基扁桃酸稍低,对对位带有吸电子基团的扁桃酸化合物4~7的拆分能力最弱,很难使其实现基线分离;而Chiralcel OJ-H柱则是对2-氯扁桃酸、3-氯扁桃酸和扁桃酸的拆分能力较强,对4-氟扁桃酸、4-甲氧基扁桃酸和4-三氟甲基扁桃酸稍低,对4-氯扁桃酸和4-溴扁桃酸较弱,但对8个外消旋扁桃酸化合物都能实现基线分离。相比之下,Chiralcel OJ-H柱对每个底物的拆分能力都大于Chiralpak AD-H柱,对扁桃酸系列化合物显示了更强的手性识别能力。
淀粉型和纤维素型手性固定相的拆分机理目前尚不完全清楚,一般认为是与对映体之间存在氢键-氢键、偶极-偶极、π-π作用等作用力,除此之外,还有内部手性空腔(由固定相的构成单元葡萄糖单元形成多糖单手螺旋结构而产生)与溶质的空间适应性[15]。这些作用力的综合作用结果将影响固定相与两个对映体之间形成的瞬时的非对映体复合物的稳定性并产生差异而得到分离[16]。
本文中Chiralpak AD-H柱和Chiralcel OJ-H柱对扁桃酸系列化合物的拆分可能是受扁桃酸的羟基和羧基和固定相之间形成的氢键、苯基和固定相芳环部分之间存在的π-π作用以及扁桃酸与固定相内部手性空腔的空间适应性等作用力综合作用的结果。8个扁桃酸系列化合物在结构上十分相似,差异仅在于苯环上的取代基的位置或种类不同,但它们被手性拆分的难易程度却相差很大,说明识别过程中取代基起到了非常重要的作用。首先,取代基的电子诱导效应影响了扁桃酸类化合物在固定相上的保留时间。带有吸电子基团特别是在对位带有吸电子取代基的化合物其吸电子诱导效应导致扁桃酸的羟基和羧基部分电荷密度降低,从而削弱了与手性固定相形成的氢键相互作用,降低了固定相与两个对映体之间形成的瞬时的非对映体复合物的稳定性,缩短了保留时间,例如4-三氟甲基扁桃酸;带有供电子基团的化合物的供电子诱导效应会导致扁桃酸的羟基和羧基部分电荷密度升高,从而加强了与手性固定相形成的氢键相互作用,增强了固定相与两个对映体之间形成的瞬时的非对映体复合物的稳定性,延长了保留时间,例如4-甲氧基扁桃酸。其次,取代基的空间位阻效应是决定扁桃酸在固定相上被拆分成败的关键因素之一。具有恰当位阻效应的取代基使得扁桃酸分子与固定相内部的手性空腔产生良好的空间适应性将有助于固定相与两个对映体之间形成的瞬时的非对映体复合物的稳定性并产生差异,从而促进手性分离。例如在邻位有取代基的2-氯扁桃酸与其间位和对位的异构体相比,它们与手性固定相之间的氢键-氢键、偶极-偶极、π-π作用基本无差别,2-氯扁桃酸能得到更好的手性拆分效果的决定因素就是其与手性固定相之间较好的空间适应性。对扁桃酸系列化合物的手性拆分,Chiralcel OJ-H柱比Chiralpak AD-H柱显示了更强的手性识别能力,分析其原因空间适应性适宜也是主要原因之一。另外,固定相与扁桃酸芳环之间的π-π相互作用也是影响手性拆分效果的又一因素,Chiralcel OJ-H柱衍生化基团4-甲苯基甲酰基比Chiralpak AD-H柱衍生化基团3,5-二甲苯基氨基甲酰基的位阻要小,更容易贴近扁桃酸分子产生更强的π-π相互作用,因而会增加保留时间,产生更好的拆分效果。综上所述,Chiralcel OJ-H柱与Chiralpak AD-H柱拆分扁桃酸系列化合物都是基于两者之间的氢键-氢键、偶极-偶极、π-π相互作用以及空间适应性等诸多因素综合影响的拆分机理,其中空间适应性起到至关重要的作用。
3 结论
本研究系统地考察了8个扁桃酸系列化合物的外消旋体在Chiralpak AD-H和Chiralcel OJ-H手性柱上的分配行为,发现Chiralcel OJ-H柱对扁桃酸系列化合物具有更强的手性识别能力;还考察了扁桃酸系列化合物苯环上的取代基对其在手性固定相上被识别的难易程度的影响,并探讨了手性拆分机理。基于Chiralcel OJ-H柱建立了有效的拆分方法,8个外消旋扁桃酸化合物在36 min内都得到了基线分离,该方法简单可靠、准确可行。该研究可为一些实际光学活性扁桃酸及其类似物的对映体纯度测定与拆分研究提供参考。
[1]Lu H Y,Chen J,Zheng Y G,et al.Modern Chemical Industry(鲁海英,陈静,郑裕国,等.现代化工),2007,27(2):66
[2]Shao H,Gan Y P,Zhang W K,et al.Chemical Regents(邵恒,甘永平,张文魁,等.化学试剂),2007,29(3):143
[3]Zhang J B,Yang J C,Liu R L,et al.Agrochemicals(张金波,杨吉春,刘若霖,等.农药),2009,48(2):82
[4]Qian J,Xu S Z,Xue Y P,et al.Chemical Industry and Engineering Progress(钱晶,徐赛珍,薛亚平,等.化工进展),2011,30(2):396
[5]Sun Y N,Li T,Ma C.Chinese Journal of Chromatography(孙亚男,李彤,马辰.色谱),2013,31(5):447
[6]Wang L P,Fan H J,Wu K H,et al.Chinese Journal of Chromatography(王李平,范华均,巫坤宏,等.色谱),2012,30(12):1265
[7]Xia T T,Zhang X X,Gu F,et al.Chinese Journal of Chromatography(夏婷婷,张晓翔,顾芳,等.色谱),2011,29(12):1188
[8]Sun Y,Xu F,Gong B L.Chinese Journal of Chromatography(孙杨,徐飞,龚波林.色谱),2011,29(9):918
[9]Hu Y,Yu Z E,Zhuang X X,et al.Chemical World(胡昱,俞卓尔,庄晓晓,等.化学世界),2012,53(6):364
[10]Chen Z Y,Yao T W,Zeng S.Chinese Pharmaceutical Journal(陈仲益,姚彤炜,曾苏.中国药学杂志),2007,42(7):544
[11]Zhang K,Zhao S F,Wang H,et al.Chinese Journal of Analysis Laboratory(张凯,赵淑凤,王欢,等.分析试验室),2009,28(Suppl):134
[12]Zhang M,Xi W H,Zi M,et al.Chinese Journal of Analysis Chemistry(张美,奚文汇,字敏,等.分析化学),2010,38(2):181
[13]Okamoto Y,Aburatani R,Kaida Y,et al.Chem Letters,1988(7):1125
[14]Zhou J,Liu Q,Fu G J,et al.Journal of Zhejiang University:Science B,2013,14(7):615
[15]Okamoto Y,Yashima E.Angew Chem Int Ed,1998,37(8):1020
[16]Cui X,Wang B,Feng X M,et al.Chinese Journal of Analytical Chemistry(崔欣,王斌,冯小明,等.分析化学),2002,30(9):1099
