秀珍菇胞外多糖活性炭脱色工艺研究
2014-09-26戴世华孙玉军宋玉玲赵为容
戴世华,孙玉军,宋玉玲,赵为容
(安徽科技学院 生命科学学院,安徽 凤阳 233100)
秀珍菇(Pleurotus geesteranus)隶属于真菌门、担子菌纲、伞菌目、侧耳科侧耳属[1],其菇体娇小,柄长5~6cm,菇盖直径<3cm,因此称之为秀珍菇。秀珍菇口感柔嫩,营养丰富,富含蛋白质、多糖、微量元素和人体必需的8种氨基酸[2]。张安强等[3]对秀珍菇子实体多糖PGPS1的结构进行了解析,杨润亚[4]、耿中华[5]研究发现秀珍菇子实体多糖具有体外抗氧化活性,但关于秀珍菇胞外多糖的研究鲜有报道。
秀珍菇胞外多糖是秀珍菇菌种在发酵过程中产生的分泌至细胞外的水溶性多糖,存在于发酵液中。发酵液经乙醇沉淀得到的胞外粗多糖呈深褐色,色素的存在既影响多糖的外观、纯度,也不利于其纯化及其结构鉴定,因此色素的脱除显得尤为重要。本文以活性炭为脱色剂,探讨活性炭用量、脱色时间、脱色温度、pH值对秀珍菇胞外多糖脱色效果的影响,并通过正交试验优化最佳脱色工艺,为秀珍菇胞外多糖的分离纯化和进一步研究提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂 秀珍菇菌种(Pleurotus geesteranus),由安徽科技学院食用菌研究所提供。液体发酵培养基:葡萄糖30g/L、蛋白胨5g/L、酵母粉5g/L、KH2PO43g/L、MgSO4·7H2O 1g/L,浓硫酸、葡萄糖、蒽酮、颗粒活性炭等均为国产分析纯。
1.1.2 仪器与设备 101AS-3型电热鼓风干燥箱(上海浦东荣丰科学仪器有限公司);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);ZHWY-2102C往复式恒温摇床(上海智诚分析仪器制造有限公司);FA2004电子天平(上海精密科学仪器有限公司);FD-15A-50冷冻干燥机(北京博医康实验仪器有限公司)。
1.2 方法
1.2.1 秀珍菇胞外粗多糖的制备 秀珍菇菌种按10%的接种量接种,转速180r/min,23℃液体发酵培养7d,发酵液过滤获得菌丝体,滤液经浓缩、离心、sevag法脱蛋白、乙醇沉淀、离心、冷冻干燥得秀珍菇胞外粗多糖。
1.2.2 秀珍菇胞外粗多糖及其色素含量的测定 将秀珍菇胞外粗多糖用蒸馏水配制成一定浓度的多糖溶液,采用蒽酮-硫酸法[6]测定该多糖液的A620脱色前表示脱色前的多糖含量。
将上述秀珍菇胞外溶液于400~700nm波长范围内扫描,结果发现秀珍菇胞外粗多糖在515nm处呈现最大吸收峰,因此将515nm作为秀珍菇胞外多糖色素的测定波长。测定此时A515脱色前表示脱色前色素的含量。
1.2.3 秀珍菇胞外多糖活性炭脱色的单因素试验
1.2.3.1 活性炭的用量对胞外多糖脱色效果的影响分别准确量取秀珍菇胞外粗多糖溶液15mL于6支试管中,依次加入质量体积比为0.4%、0.8%、1.2%、1.6%、2.0%、2.4%的颗粒活性炭,调 pH5,50℃恒温水浴60 min,离心,取上清液分别测定脱色后多糖的吸光度A620脱色后和色素的吸光度A515脱色后,计算胞外多糖的保留率和色素的脱除率。多糖保留率和多糖脱色率计算公式为(下同):
多糖保留率(%)=(A620脱色前-A620脱色后)/A620脱色前×100%
多糖脱色率(%)=(A515脱色前-A515脱色后)/A620脱色前×100%
1.2.3.2 脱色时间对胞外多糖脱色效果的影响 分别准确量取秀珍菇胞外粗多糖溶液15mL于6支试管中,加入质量体积比为1.6% 的颗粒活性炭,调pH4,50℃条件下分别恒温水浴30min、40min、50min、60min、70min、80min,离心,取上清液分别测定脱色后多糖的吸光度A620脱色后和色素的吸光度A515脱色后,计算胞外多糖的保留率和色素的脱除率。
1.2.3.3 温度对胞外多糖脱色效果的影响 分别准确量取秀珍菇胞外粗多糖溶液15mL于6支试管中,加入质量体积比为1.6%的颗粒活性炭,调pH4,分别于30℃、40℃、50℃、60℃、70℃、80℃条件下恒温水浴60min,离心,取上清液分别测定脱色后多糖的吸光度A620脱色后和色素的吸光度A515脱色后,计算胞外多糖的保留率和色素的脱除率。
1.2.3.4 pH对胞外多糖脱色的影响 分别准确量取秀珍菇胞外粗多糖溶液15mL于6支试管中,加入质量体积比为1.6%的颗粒活性炭,分别调pH3、pH4、pH5、pH6、pH7、pH8,于50℃条件下恒温水浴60min,离心,取上清液分别测定脱色后多糖的吸光度A620脱色后和色素的吸光度A515脱色后,计算胞外多糖的保留率和色素的脱除率。
1.2.4 活性炭脱色的正交试验 以活性炭用量、脱色时间、脱色温度和pH四个因素,每一个因素选取三个水平,按L9(34)设计正交试验,测定多糖的脱色率和保留率,根据脱色效果优化最佳脱色工艺。因素水平如表1所示。
脱色效果脱色效果评价采用加权评分法[7]。将各项指标除以该列最大值再乘以100,为该项得分,设定多糖脱色率和多糖保留率两者的权重系数均为0.5,对两项指标进行加权求和,通过公式得到综合评分Z=0.5X+0.5Y,式中Z为综合得分,X为多糖脱色率,Y为多糖保留率。
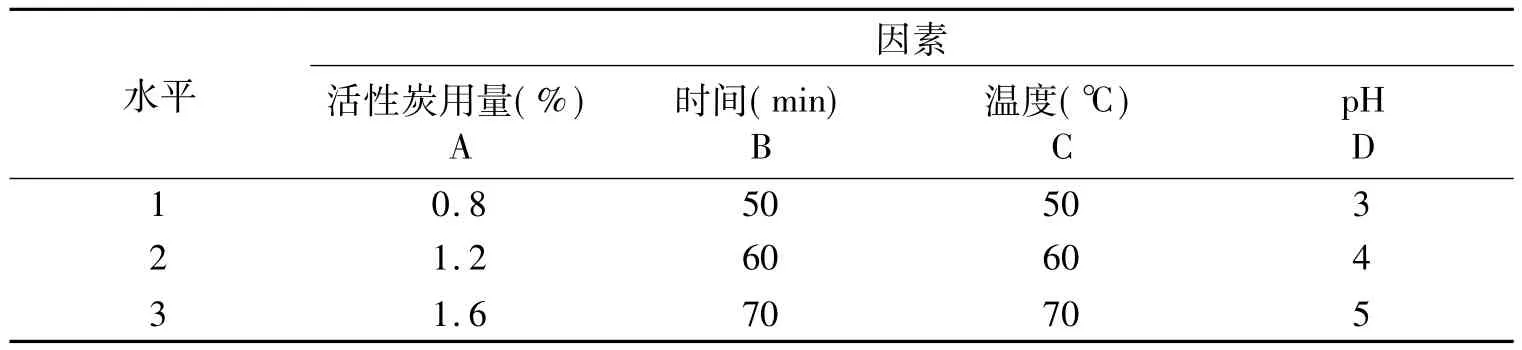
表1 正交试验因素水平表Table 1 Factors and levels for orthogonal experiment
2 结果与分析
2.1 活性炭用量对胞外多糖脱色效果的影响
活性炭用量对秀珍菇胞外多糖脱色效果的影响如图1所示。由图1可见,秀珍菇胞外多糖的脱色率随着活性炭用量的增加而升高,而多糖的保留率却随着活性炭用量的增加而降低,说明活性炭在吸附色素的同时,也吸附了胞外多糖,造成多糖的损失。综合考虑,选取0.8%、1.2%、1.6%作为正交试验活性炭用量因素的三个水平。
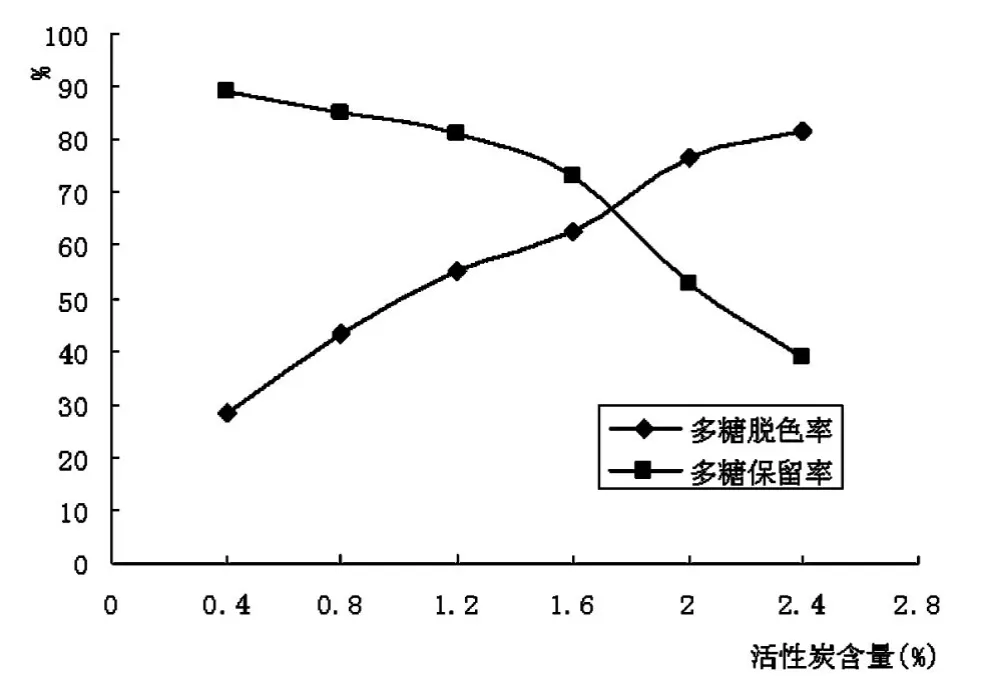
图1 活性炭用量对胞外多糖脱色效果的影响Fig.1 Effect of activated carbon dosage on decoloriztion efficiency of exopolysaccharide
2.2 脱色时间对胞外多糖脱色效果的影响
脱色时间对秀珍菇胞外多糖脱色效果的影响如图2所示。由图2可见,秀珍菇胞外多糖的脱色率随着时间的延长而升高,当脱色时间达到70min时,脱色率的升高程度趋于平缓,而多糖的保留率随着时间的延长而降低。综合考虑,选取50min、60min、70min作为正交试验时间因素的三个水平。
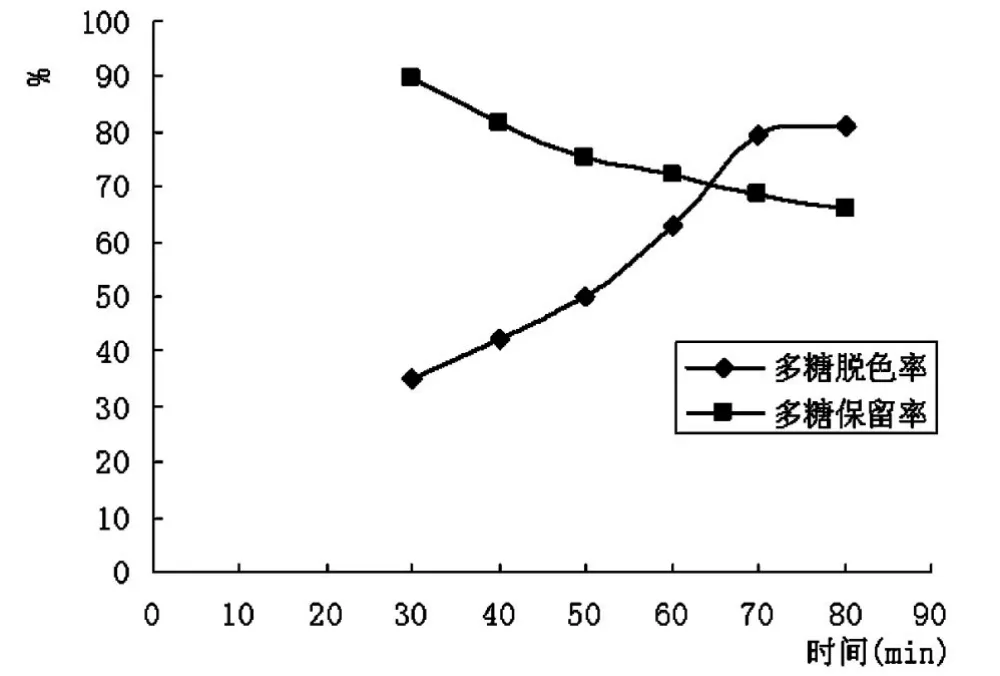
图2 时间对胞外多糖脱色效果的影响Fig.2 Effect of time on decoloriztion efficiency of exopolysaccharide
2.3 温度对胞外多糖脱色效果的影响
温度对秀珍菇胞外多糖脱色效果的影响如图3所示。由图3可见,秀珍菇胞外多糖的脱色率随着温度的升高而增大,在30℃ -60℃之间,脱色率升高幅度大,60℃之后,上升幅度减小,而多糖的保留率随着温度的升高而降低。综合考虑,选取50℃、60℃、70℃作为正交试验温度因素的三个水平。
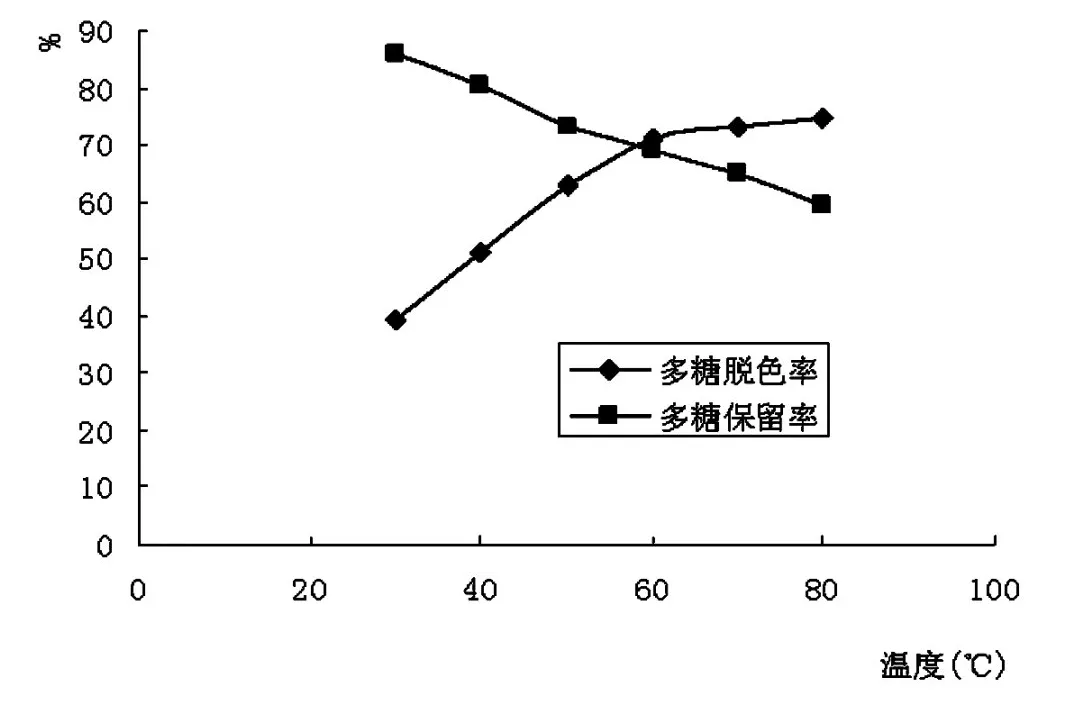
图3 温度对胞外多糖脱色效果的影响Fig.3 Effect of temperature on decoloriztion efficiency of exopolysaccharide
2.4 pH对胞外多糖脱色效果的影响
pH对秀珍菇胞外多糖脱色效果的影响如图4所示。秀珍菇胞外多糖的脱色率随着pH的升高而降低,而多糖的保留率随着pH的升高而增大,这种结果表明,活性炭在偏酸的条件下吸附能力强,pH升高,吸附能力随之降低。因此,综合考虑,选取pH3、pH4、pH5作为正交试验pH因素的三个水平。
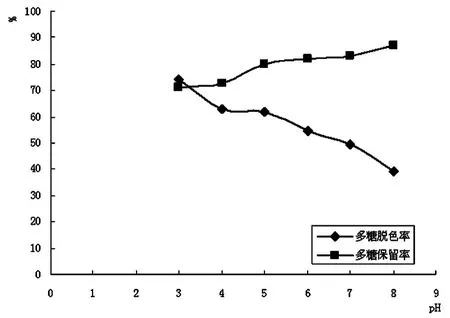
图4 pH对胞外多糖脱色效果的影响Fig.4 Effect of pH on decoloriztion efficiency of exopolysaccharide
2.5 活性炭脱色的正交试验结果
秀珍菇胞外多糖活性炭脱色正交试验结果如表2所示。根据表2中极差R的大小顺序B>C>A>D可知,影响秀珍菇胞外多糖脱色效果的最主要因素是脱色时间,其次为温度、活性炭用量,最后是pH值。优化出的最佳脱色工艺为A3B3C3D1,即活性炭用量1.6%、脱水时间70min、脱色温度70℃,pH3。
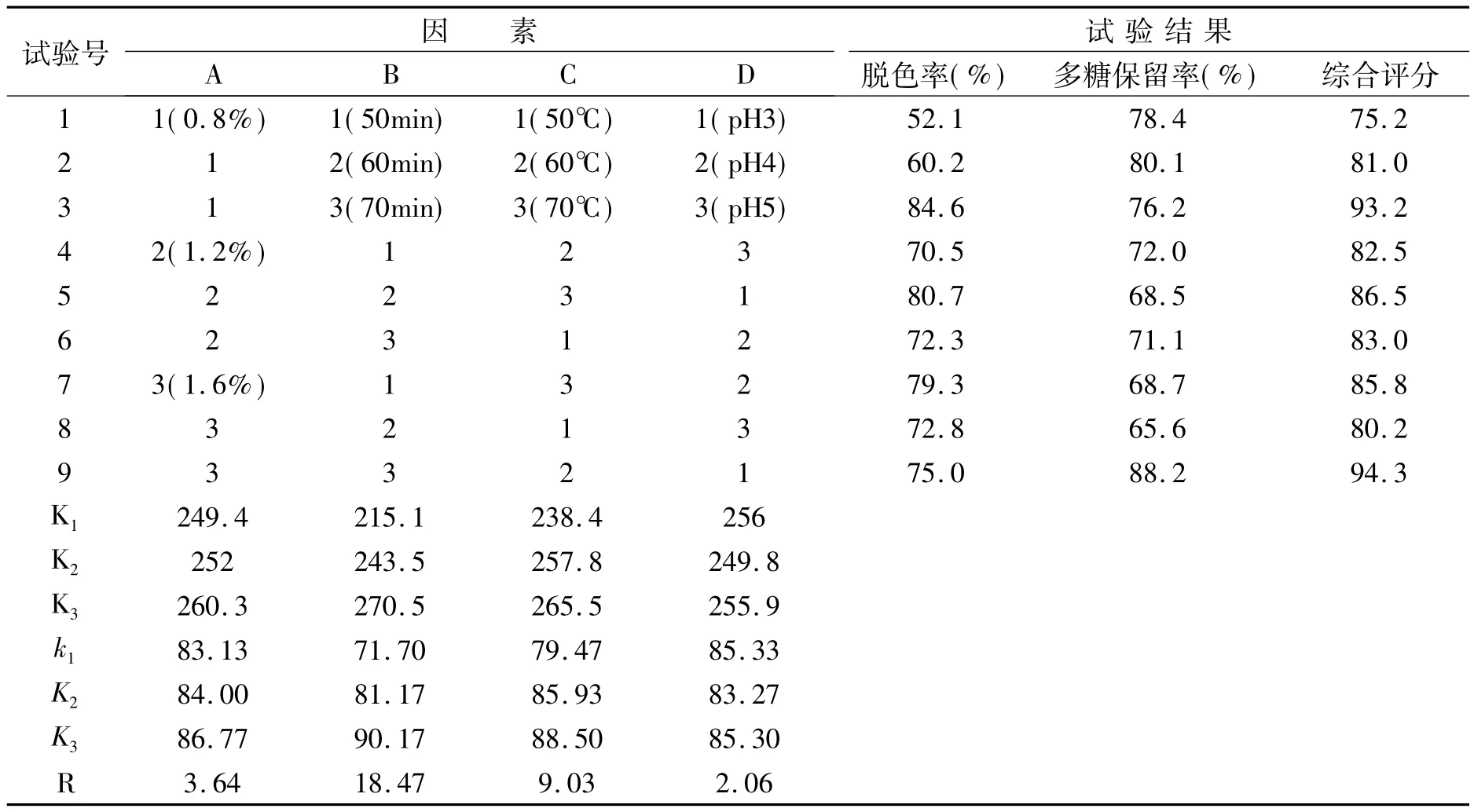
表2 活性炭脱色正交实验结果Table 2 Activated Carbon decolorization orthogonal test result
2.6 验证试验
根据正交试验优化得到的最佳脱色工艺,在此工艺条件下进行三次脱色试验,多糖的脱色率平均为80.5%,多糖的保留率平均为84.8%,均高于正交试验中的每组脱色结果,说明优化的脱色条件佳,适合秀珍菇胞外多糖的脱色。
3 讨论与结论
多糖脱色素的方法一般为活性炭、过氧化氢、大孔树脂脱色法。活性炭法是利用活性炭具有吸附特性将色素进行吸附达到除去的目的,当然在吸附色素的同时,也会吸附多糖,会造成多糖的损失。过氧化氢法是利用过氧化氢的氧化性将色素氧化除去,但由于多糖中含有还原性基团,与过氧化氢发生氧化还原反应,也往往会造成多糖的损失。而大孔树脂法也是利用其对色素的吸附性来脱除色素,同样也会因吸附多糖造成样品的损失[8]。本试验采用的活性炭法对秀珍菇胞外多糖进行脱色,经正交试验优化最佳脱色工艺为活性炭用量1.6%、脱水时间70min、脱色温度70℃,pH3。在此条件下,胞外多糖的脱色率为80.5%,多糖的保留率为84.8%,脱色效果好,且活性炭成本低廉,相对于过氧化氢法来说不会因过氧化氢的氧化反应引入新的杂质;相对于大孔树脂法来说操作简单、方便易行,适合秀珍菇胞外多糖的脱色。
:
[1]张金霞,黄成阳.平菇新品种:秀珍菇的特征特性[J].中国食用菌,2005(4):25-26.
[2]李维焕,蔡德华,郑芳.秀珍菇菌株的亲缘关系分析[J].食品科学,2010,31(17):267 -271.
[3]张安强,许媚,周赛静,等.秀珍菇子实体多糖中3-O-甲基-半乳糖组分的谱学鉴定[J].药物分析杂志,2013,33(1):90 -93,115.
[4]杨润亚,李维焕,吕芳芳.秀珍菇子实体多糖的提取工艺优化及体外抗氧化性[J].食品与生物技术学报,2012,31(10):1093-1099.
[5]耿中华,李超.秀珍菇多糖的抗大豆油氧化活性研究[J].农业机械,2013(6):57-59.
[6]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:12-14.
[7]孙玉军,李正鹏.羊肚菌胞外多糖活性炭脱色工艺[J].中国医院药学杂志,2012,32(23):1885-1888.
[8]付学鹏,杨晓杰.植物多糖脱色技术的研究[J].食品研究与开发,2007,28(11):166-169.