重组人糜蛋白酶表达、纯化和性质研究
2014-09-18刘晓李素霞
刘晓,李素霞
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
重组人糜蛋白酶表达、纯化和性质研究
刘晓,李素霞Δ
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
目的研究重组人糜蛋白酶(human Chymotrypsin)在大肠杆菌中的表达、纯化和部分性质。方法大肠杆菌BL 21(DE 3)高效表达目的蛋白,表达形式为包涵体,复性后的重组蛋白,通过阳离子交换层析纯化,对纯化蛋白进行性质研究。结果SDS-PAGE分析重组蛋白酶原大小约为30 KD,CM-FF阳离子交换层析纯化后最终活性回收率为93.7%,重组酶在pH 3~pH5范围内稳定,温度稳定性好,以N-苯甲酰-L-酪氨酸乙酯(n-benzoyl-ltyrosine ethyl ester,BTEE)作为底物时的Km值为0.067 mmol/L,紫外最大吸收波长为281 nm。结论重组人糜蛋白酶工程菌成功表达目的蛋白,并通过复性、激活后获得了活性蛋白,建立了生产该酶的方法。
重组人糜蛋白酶;表达;性质
采用基因工程方法表达重组糜蛋白酶不仅能从根源上解决这一问题,而且生产过程简洁有效,生产工艺稳定易控制,通过大肠杆菌高密度发酵和包涵体复性大大提高了重组酶的产率,改善了纯化工艺,因此利用基因工程技术研究和生产重组糜蛋白酶具有非常重要的意义。
1 材料与方法
1.1 质粒,菌株和试剂 含有重组人糜蛋白酶基因的质粒pET-hCT和菌株BL 21(DE 3)由本实验室保存;重组胰蛋白酶购自上海雅心生物技术有限公司;蛋白低分子量标准(Takara);BTEE,IPTG(Sigma);其他试剂均为国产分析纯。
1.2 重组人糜蛋白酶原表达与鉴定 含有重组质粒pET-hCT的BL 21(DE 3)菌株,涂布于含有50 μg/mL卡那霉素抗性的LB(0.1%蛋白胨,0.1%NaCl,0.05%酵母粉)平板,倒置培养14~16 h。挑取菌落于相同浓度抗性的30 mL LB液体培养基,37℃,200 r/min培养12 h后,以2%接种量转接二级瓶,当菌密度OD 600达0.6~0.8时,IPTG(异丙基-β-D-硫代半乳糖苷)诱导4h,离心收集菌体,超声破碎后SDS-PAGE[7]分析表达情况。
1.3 重组人糜蛋白酶的制备 按菌体:缓冲液约为1g:15 mL的比例悬浮菌体于50 mM Tris-HCl pH 8.0缓冲液中,超声破碎得上清和包涵体。将包涵体重悬于洗涤液(0.1%Triton,2 M尿素),洗涤后的包涵体溶解于8M尿素中,稀释复性[8],用重组胰蛋白酶激活[9]。
使用3 cm×30 cm层析柱,按总蛋白量确定适合的CM-FF阳离子交换树脂装柱量。配制20 mM NaAC-HAC pH 4.2缓冲液进行平衡,上柱。上样后用上述平衡液洗涤至基线,然后用不同浓度NaCl进行梯度洗脱。洗脱后,测定活性,绘制洗脱曲线,并用SDS-PAGE鉴定纯度。合并洗脱液,透析后,冻干,冻干粉于-20℃保存。
1.4 活性测定 测活底物为BTEE,酶活力单位定义[10-11]为:在25℃,pH 7.8的条件下,1个活力单位糜蛋白酶每分钟能水解1μmol BTEE。测活方法为:3.0 mL 25℃底物溶液中加入10μL酶液,在256 nm下每30 s记录1个吸光值A256,使每分钟的变化值ΔA在0.015~0.020之间为宜,空白对照为1 mM HCl。
1.5 重组人糜蛋白酶性质研究
1.5.1 pH稳定性 取纯酶液,分别在pH 3~pH 11缓冲液中稀释10倍,于25℃下温育2 h和46 h,取样测定酶活,以水浴前酶液的初始活性作为100%,计算活性残余率。缓冲液依次为 NaAc-HAc(pH 3~pH 6),Tris-HCl (pH 7~pH 8),Gly-NaOH (pH 9~pH 11),所有缓冲液均25℃配制。
1.5.2 温度稳定性 取1 mg/mL溶解于1mM HCl中的纯酶液,分别置于25℃、37℃水浴中温育,每隔一定时间测定酶活,以水浴前酶液的初始活性作为100%计算活性残余率。
1.5.3 反复冻融稳定性 取1 mg/mL纯酶液,置于-20℃下反复冻融。测定每次冻融后的酶活,以未冻融酶液的活力为100%,计算活性残余率。
1.5.4 Km和Vmax测定 以测活缓冲液(80 mM Tris HCl pH 7.8含0.05 mol/L Ca2+)溶解不同浓度BTEE底物,[S]/mol/L:1×10-5、2×10-5、5×10-5、1×10-4,1.5×10-4,2×10-4。在256 nm波长处分别测定每个底物浓度下反应2 min时的A256并按下列公式计算酶促反应速度v(μmol/min):

式中v为加入糜蛋白酶的体积(mL),df为稀释因子,0.964为BTEE在256 nm下摩尔吸光系数。
1.5.5 紫外吸收光谱 将0.5 mg/mL重组糜蛋白酶冻干粉溶解于超纯水中,在光路1 cm,波长190~300 nm范围内进行紫外光谱扫描,确定其特征吸收波长。
2 实验结果
2.1 重组人糜蛋白酶的制备 含重组质粒pET-28 ahCTRB1的E.coliBL 21(DE 3)重组菌的表达结果见SDSPAGE电泳分析(图1A)。诱导后,在30 KD附近有表达条带,与预期结果一致,超声破碎,离心后结果显示上清中基本没有目的条带,因此重组蛋白主要以包涵体形式表达。经重组胰蛋白酶和糜蛋白酶自身的切割,酶原被激活并释放了活性酶,活性酶的大小明显小于酶原形式(图1B)。
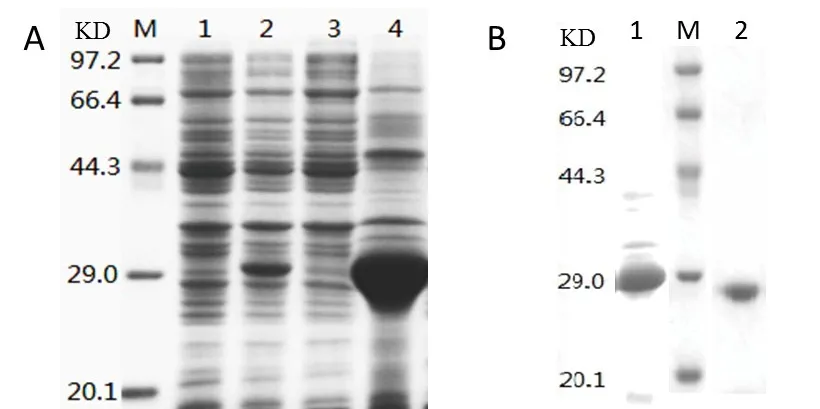
图1 重组人糜蛋白酶原表达和激活(A)酶原表达鉴定:M. 低分子量蛋白marker;1. 诱导前;2. IPTG诱导后3.诱导后上清;4. 诱导后包涵体;(B)重组人糜蛋白酶原激活:M. 低分子量蛋白marker;1. 激活前;2. 胰蛋白酶激活后Fig.1 Expression and activation of human chymotrypsinogen(A)Expression of chymotrypsinogen: M. Low molecular weight protein maker; 1. Before induction; 2. After induction with IPTG;3. Supernatant after induction; 4. Inclusion body after induction;(B)Activation of chymotrypsinogen: M. Low molecular weight protein maker;1. Before activation; 2. After activation with trypsin
重组人糜蛋白酶包涵体经复性和酶原激活后的活性酶,用20 mmol/L NaAC-HAC pH 4.2和5mmol/L CaCl2透析缓冲液,在酸性条件下透析,随后进行CM-FF阳离子交换层析,重组蛋白主要在200 mmol/L NaCl浓度下被洗脱,电泳结果如图2所示。主条带在29 KD附近,但在14.3~20.1 KD之间也有明显条带,分析该条带为在还原电泳过程中,由于二硫键被还原而形成的糜蛋白酶第二条肽链(14.4 KD)。洗脱曲线见图2和表1。

图2 重组人糜蛋白酶纯化(A)洗脱曲线;(B)纯化结果SDS-PAGE鉴定:M. 低分子量蛋白marker;1. 流穿液;2~8 试管. 200 mM NaCl 洗脱液Fig.2 CM purification of recombinant human chymotrypsin(A)Elution curve of CM-FF; (B) SDS-PAGE detection of purification:M.Low molecular weight protein maker; 1. Flow solution; 2~8 tuber. 3 to 9 of 200 mM NaCl elution

表1 重组人糜蛋白酶CM-FF纯化表Tab.1 The CM puri fi cation table of recombinant humanchymotrypsin
2.2 重组人糜蛋白酶性质研究 pH稳定研究(见图3)发现,重组人糜蛋白酶在酸性pH条件下(pH 3~5)活性相对较稳定,酶液在该条件下温育46 h任保持约90%的活性,因此在选择纯化,透析,保持的方法时应选择酸性条件,例如阳离子交换层析CM柱选择pH 4~5,透析时采用20 mmol/LNaAC-HAC pH 4.2。而相对于pH 8~pH9的条件,重组糜蛋白酶在强碱性条件(pH 10~11)下的残余活性较高,说明该酶具有一定的碱耐受性。

图3 重组人糜蛋白酶pH稳定性Fig.3 The pH stability of recombinant human chymotrypsin
温度稳定性研究(见图4)发现重组糜蛋白酶的热稳定性好,25℃下温育7 h能保留80%酶活性,因此该酶的纯化不需要在4℃下进行。37℃稳定性实验模拟人体内温度,此时糜蛋白酶的半衰期为7h左右。长期放置后,酶活力还是会有很大损失,必须注意酶的保存方法。
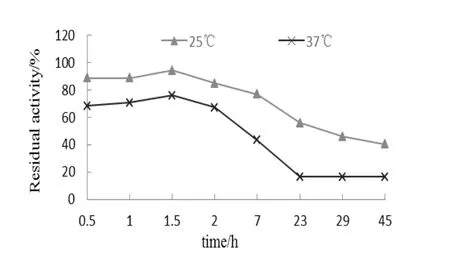
图4 重组人糜蛋白酶温度稳定性Fig.4 The temperature stability of recombinant human chymotrypsin
反复冻融稳定性研究(见图5)发现重组糜蛋白酶冻融一次后酶活力能保持100%,但从第二次冻融开始活力有明显下降,根据本实验结果能有效提高酶使用次数和应用范围。

图5 重组人糜蛋白酶反复冻融稳定性Fig.5 The Freezing stability of recombinant human chymotrypsin
重组糜蛋白酶Km和Vmax值测定结果(见图5),按双倒数作图法,以1/[S]为横坐标,1/v为纵坐标作图,经线性拟合,其曲线方程为y=0.007 x+0.104(R2=0.994)。得到直线的斜率在纵轴上的截距为1/V,横轴上的截距为-1/Km,可求得Km值为0.067 mmol/L,Vmax值为 9.6 μmol/min。Km值受 pH和温度的影响,一般只与酶的性质有关,与酶的浓度无关。不同酶有不同的Km值,Km值可以反映酶与底物的结合效率,Km值越大说明底物与酶结合率越低,Km值越小说明酶与底物的结合率越强。

图6 重组人糜蛋白酶Km和Vmax值测定Fig.6 Measurement of Km and Vmax
由于190~250 nm是蛋白分子的肽键紫外光谱吸收,最大吸收波长为228 nm因此不能作为蛋白的特征吸收峰,所以实验波长范围设定为240~300 nm,在此范围内有一个吸收峰。如图7和8所示,最大吸收波长为281 nm,该处的紫外吸收是一些芳香族氨基酸残基的吸收,并且重组酶与天然酶的最大吸收峰基本一致。

图7 重组人糜蛋白酶紫外吸收光谱Fig.7 Ultraviolet absorption spectrum assay of recombinant human chymotrypsin

图8 天然糜蛋白酶紫外吸收光谱Fig.8 Ultraviolet absorption spectrum assay of native chymotrypsin
3 讨论
大肠杆菌表达获得的蛋白通常难以获得其天然构象,而是生成不可溶的包涵体,Haibo Wang,Duoduo Yuan等[12]在大肠杆菌中表达了猪源糜蛋白酶C,并进行了复性和纯化。本研究通过原核表达载体成功表达了人源糜蛋白酶,表达形式为包涵体,经包涵体复性和酶原激活,得到了具有较高活性的重组蛋白。理想的纯化方法是提高最终糜蛋白酶活力的主要保证,常用的糜蛋白酶纯化方法有离子交换法和亲和色谱法。Rafik Balti等[13]采用Phenyl-Sepharose,Sephadex G-200,DEAE 阴离子交换柱层析对乌贼糜蛋白酶进行纯化,这些纯化方法主要是建立在天然糜蛋白酶含有其他杂蛋白酶的基础上,而对于通过复性方法得到的重组蛋白酶纯度已相对较高,大大降低了纯化的难度[14]。本实验采用CM阳离子交换层析纯化激活后的酶,活性回收率达到93.7%。
从pH、温度和反复冻融三方面基本讨论了重组人糜蛋白酶的性质:其pH稳定范围为3~5,这主要是因为在酸性条件下酶分子的活性中心被掩盖,使酶分子维持相对稳定的状态,这一性质与同一家族的重组胰蛋白酶[15]的性质相似,而与胰蛋白酶性质不同的是重组糜蛋白酶在强碱性条件(pH 10~pH 11)下温育46 h能保持40%~60%残余活性,说明该酶具有一定的碱耐受性。25℃下重组酶比较稳定,并且反复冻融需要控制在尽量少的次数内,这些研究为该酶的纯化、使用和保存提供了参考依据。Km、Vmax值测定,和紫外吸收光谱分析主要从重组酶的动力学和紫外光谱方面分析了其性质。本实验结合不同侧面探讨了重组人糜蛋白酶的表达,纯化和基本性质,为今后的进一步研究提供了有效的参考。
[1] Walter A.Chymotrypsin:Molecular and Catalytic Properties[J].Clinical biochemistry,1986,16:317-322.
[2] Satish KS,Thomas R.Activation of Bovine Chymotrypsinogen A.Isolation and Characterization of μ-andω-Chymotrypsin[J].Biochemistry,1986,16:1008-1013.
[3] Freer ST,Kraut J,Robertus JD.Chymotrypsinogen 2,5-crystal structure,comparison with α-chymotrypsin,and implications for zymogen activation[J].Biochemisty,1975,9(9):1997-2009.
[4] Kara NE,Anthony VR,Carol F.Broad specificity alkaline proteases efficiently reduce the visual scaling associated with soap-induced xerosis[J].Arch Dermatol Res,2001,293:500-507.
[5] 黄茂华,赵宪平.糜蛋白酶临床应用进展[J].医药综述,2005,10:462-463.
[6] 何秀莹,何兆衡.糜蛋白酶致过敏反应 6例[J].广东药学,2001,11(1):23.
[7] 汪家政,范明.蛋白质技术手册[M].北京科学出版社,2002,189-229.
[8] 张晓彦,李素霞,顾俊杰,等.重组羧肽酶原B的体外变复性研究[J].分子科学学报,2005,21(4):51-57.
[9] István V,László G,William JR.Expression of rat chymotrypsinogen in yeast:a study on the structural and functional significance of the chymotrysinogen propeptide[J].FEBS Letters,1996,379:139-142.
[10] Brian CW.A modified spectrophotometric determination of chymotrypsin,trypsin,and thrombin[J].Biochem,Physiol,1959,37(12):1393-1399.
[11] Rao KN,LombardiAnal B.Substrate solubilization for the Hummel alphachymotrypsin assay[J].Biochem,1975,65:548-551.
[12] Wang HB,Yuan DD,Xu R.Purification,cDNA cloning,and recombinant expression of chymotrypsin C from porcine pancreas[J].Acta Biochim Biophys Sin,2011,43:568-575.
[13] Rafik B,Faeh B,Ali B,et al.Chymotrypsin from the hepatopancreas of cuttlefish (Sepia officinalis) with high activity in the hydrolysis of long chain peptide substrates:Purification and biochemical characterisation[J].Food Chemistry,2012,130:475-484.
[14] 张洛盛,吴珊,吴倩,等.重组羧肽酶原B突变体 C 383 A的纯化与性质研究[J].食品与药品,2010(9):308-312.
[15] 纪德凯,吴倩,李素霞.重组人Ⅱ型胰蛋白酶的性质及初步应用研究[J].食品与药品,2010(12):384-388.
Study on the expression,puri fi cation and properties of recombinant human chymotrypsin
LIU Xiao,LI Su-xiaΔ
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
ObjectiveTo study the prokaryotic expression, purification and properties of recombinant human Chymotrypsin.MethodsThe protein was highly expressed in E.coliBL 21 (DE 3) as inclusion body. After refolding and activated with trypsin, the activated protein was obtained and purified with ion-exchange chromatography(CM-FF), some properties of the recombinant human chymotrypsin was investigated.ResultsThe molecular weight of chymotrypsinogen was about 30 KD in SDS-PAGE, total activity recovery rate of CM-FF purification was 93.7%. The recombinant chymotrypsin kept stable from pH 3 to pH 5, and owned good temperature stability. Km was 0.067 mmol/L with BTEE as a substrate.The UV maximum absorption wavelength was 281 nm.Conculsion The recombinant human enzyme was expressed successfully, and a feasible production method to get a high activity of the recombinant human chymotrypsin was established.
recombinant human chymotrypsin; expression; purification; properties
Q 556+.9
A
1005-1678(2014)02-0071-04
糜蛋白酶(chymotrypsin)也叫胰凝乳蛋白酶,属于丝氨酸蛋白酶家族,能专一性水解芳香族氨基酸羧基形成的肽键[1]。糜蛋白酶原由胰腺分泌,随胰液进入小肠后,在Arg 15和Ile 16之间(按Bovine chymotrypsin A序列编号)被胰蛋白酶切为通过二硫键连接的两部分,随后糜蛋白酶在Leu 13酶切去短肽Ser 14-Arg 15,在Tyr 146和Asn 148酶切去短肽Tyr 147-Asn 148,形成由二硫键相连的三条多肽链并具有生物活性[2-3]。本文主要研究重组人糜蛋白酶(human Chymotrypsin)的表达,纯化和部分性质。
糜蛋白酶与胰蛋白酶相似,能迅速分解变性蛋白质,因此在临床上可用于皮肤伤口或局部炎症[4]。目前,糜蛋白酶在临床上的应用主要为治疗腱鞘囊肿、皮肤慢性溃疡、慢性咽炎、疱疹性口炎等,由此可知该酶的主要功能是提高组织通透性、抑制炎症反应、溶解坏死组织等[5]作用。其临床给药方式主要有肌肉注射、灌注、喷雾和局部外敷,而目前临床用糜蛋白酶系自牛或猪胰中提取,异源蛋白进入人体后可能会引起免疫反应[6],增加用药风险。
刘晓,女,硕士,研究方向:生物化学与分子生物学研究,E-mail:liuxiao 4209@gmail.com;李素霞,通信作者,女,博士,副教授,研究方向:生物化学与分子生物学,酶与酶工程,重组蛋白的变性与复性机理研究,E-mail:lisuxia@ecust.edu.cn。
