重组Bowman-Birk型大豆胰蛋白酶抑制剂的性质及抑制机理
2021-06-21李素霞王之可
刘 利, 杨 帆, 李素霞, 郭 奥, 刘 晓, 王之可
(1. 华东理工大学生物反应器国家重点实验室,上海 200237;2. 上海雅心生物技术有限公司,上海 200231)
天然大豆Bowman-Birk型胰蛋白酶抑制剂(Soybean Bowman-Birk Trypsin Inhibitor, BBTI),是一种双头丝氨酸蛋白酶抑制剂,蛋白分子大小为8 kDa,空间结构支架由7对高度保守的二硫键组成[1-2],位于分子表面的两个活性位点P1(Lys16-Ser17)和P2(Leu43-Ser44)[3]可分别抑制胰蛋白酶和糜蛋白酶。有文献报道,通过分离BBTI与胰蛋白酶、BBTI与糜蛋白酶形成的二元复合物以及BBTI与这两种酶同时结合形成的三元复合物,验证了BBTI有两个不同的活性位点,而且两个活性位点可以独立特异性识别胰蛋白酶和糜蛋白酶[4]。
BBTI具有广泛的应用价值而成为研究的热点,在转基因烟草植物中导入BBTI可增加植物防御病原体和害虫的能力[5],在后来的研究中发现很多谷物种子中也存在同源性的BBTI,可以抵御害虫对种子的伤害[6],形成了种子重要的防御系统。除此之外,BBTI具有抗癌作用,饮食中摄入大量豆类的人群患前列腺癌、结肠癌、乳腺癌和皮肤癌的机率更小[7],临床实验发现BBTI可以有效治疗口腔白斑患者,且使用后没有发现副作用[8]。传统获得BBTI的方法是从大豆中提取,来源及生产成本较高,不利于BBTI的工业化生产和应用,有研究报道通过基因工程技术可将BBTI基因进行重组表达,如BBTI在枯草芽孢杆菌中实现了异源表达,但是表达的部分BBTI会降解[9]。
在本文的研究中,使BBTI以融合蛋白的形式在大肠杆菌中实现可溶性表达,经纯化后获得较高纯度的重组BBTI(rBBTI)。对比研究了BBTI和rBBTI抑制胰蛋白酶和糜蛋白酶的酶学性质和抑制机理,发现二者的酶学性质和抑制机理一致,抑制胰蛋白酶时为一种典型的反竞争性抑制剂,而在抑制糜蛋白酶时是非竞争性抑制剂。本实验室研究发现来源于大豆的库仑兹型抑制剂抑制胰蛋白酶时是非竞争性抑制剂[10]。本文利用分子对接模拟分析了来源于大豆的Bowman-Birk型抑制剂与胰蛋白酶和糜蛋白酶之间的相互作用,为其抑制这两种蛋白酶时不同的抑制效率和机理作出了合理解释。
1 材料与方法
1.1 实验材料
委托上海生工生物工程有限公司合成BBTI成熟基因序列。实验中使用的菌体大肠杆菌Escherichiacoli( BL21)来自实验室。重组胰蛋白酶和重组糜蛋白酶购自上海雅心生物技术有限公司。N-苯甲酰-L-精氨酸乙酯(BAEE)、N-乙酰基-L-酪氨酸乙酯(ATEE)、天然BBTI均购自美国Sigma公司。其他试剂均为分析纯。
1.2 实验方法
1.2.1 rBBTI的诱导表达和亲和纯化 将质粒pet-28a-UPL-BBTI转化到菌体E. coli(BL21)中,进行诱导表达鉴定和培养,再将诱导培养得到的融合蛋白UPLBBTI进行分离纯化。融合蛋白UPL-BBTI制备过程中使用的缓冲液为pH值8.0的25 mmol/L三羟甲基氨基甲烷-盐酸(Tris-HCl),镍柱亲和纯化后得到的融合蛋白UPL-BBTI,经SUMO(Small Ubiquitin-Like Mod ifier)酶酶切后,用阴离子交换树脂DEAE-FF进行阴离子层析柱分离纯化,并用pH 8.0的150 mmol/L NaCl、25 mmol/L Tris-HCl和pH 8.0的450 mmol/L NaCl、25 mmol/L Tris-HCl溶液等体积线性洗脱,分步收集洗脱液,测定rBBTI活性,且合并有活性的样品。
1.2.2 抑制剂的抑制活性测定方法 抑制剂的活性测定参照中国药典的方法[11],根据有无抑制剂时胰蛋白酶和糜蛋白酶活性的差异计算抑制剂活性。
1.2.3 抑制剂最适温度及温度稳定性 将阳性对照组U0和实验组U1,在不同温度(4、16、25、37、55 ℃)中分别孵育2 h后测定抑制剂的活性:以最适温度下抑制剂的活性为100%,计算其他温度下抑制剂的相对活性:以温度为横坐标,抑制剂的相对活性为纵坐标作图。
抑制剂的热稳定性实验,用经上述不同温度处理后的抑制剂,替换实验组U1反应体系中的抑制剂,每2 h测定一次经不同温度处理后的抑制剂活性。结果为3组平行实验平均值:规定未经处理抑制剂的活性为100%,计算经不同温度和时间处理后的抑制剂的残留活性,以温度为横坐标,以抑制剂的残留活性为纵坐标作图。
1.2.4 抑制剂最适 pH 及 pH 稳定性 将阳性对照组U0和实验组U1中的测活缓冲液分别替换为不同pH值的缓冲液,并放置于25 ℃下,2 h后测定抑制剂的活性。以最适pH值的活性为100%,计算其他pH 条件下的相对活性,以pH值为横坐标,相对活性为纵坐标作图。不同pH值缓冲溶液包括100 mmol/L HAc-NaAc(pH 3.0~6.0), 100 mmol/L Tris-HCl(pH 7.0~8.0)和100 mmol/L甘氨酸-氢氧化钠Gly-NaOH(pH 9.0~11.0)。
测定pH值对抑制剂稳定性的影响,用经不同pH值缓冲液处理12 h后的抑制剂,替换实验组U1中的抑制剂,测定抑制剂的残余活性,结果为3组平行实验平均值:未经处理抑制剂的活性为100%,以 pH 为横坐标,抑制剂的残留活性为纵坐标作图。
1.2.5 测定IC50值和抑制动力学参数 改变测活体系中抑制剂的浓度,分别测定抑制相同量的胰蛋白酶和糜蛋白酶的抑制率,将抑制胰蛋白酶或糜蛋白酶一半活性所需的量定义为抑制剂抑制该酶的IC50值。以反应体系中抑制剂的浓度为横坐标,抑制率为纵坐标作图,同时计算出IC50值。通过改变底物浓度,采用Lineweaver-Burk双倒数作图方法,测定抑制常数Ki。公式如式(1)所示:

其中:Umax和U'max分别为无抑制剂和有抑制剂时酶活性的最大值;ρ为抑制剂的质量浓度,mg/mL。
2 结果和讨论
2.1 融合蛋白UPL-BBTI的诱导表达和纯化
图1(a)示出了融合蛋白UPL-BBTI诱导表达鉴定。从图1(a)中可以看出融合蛋白UPL-BBTI在E. coli(BL21)中成功以可溶形式表达,表观分子量为28 kDa。经过两步纯化后,SDS-PAGE电泳检测显示,rBBTI所在泳道为单一条带,见图1(c),纯化效率由表1所示。相比较之前利用大肠杆菌重组系统得到rBBTI的方式[12-13],本文的方法增加了rBBTI的表达量,融合蛋白的可溶性表达形式避免了包涵体变复性操作,纯化方式简单且具有工业化生产的可行性。
2.2 最适温度和温度稳定性
图2所示为rBBTI和BBTI抑制胰蛋白酶和糜蛋白酶的最适温度。由图2可知,BBTI和rBBTI活性的最适温度一致,抑制胰蛋白酶时为25 ℃,抑制糜蛋白酶时为16 ℃。当温度超过37 ℃,抑制剂的活性明显下降,温度为55 ℃时,rBBTI的活性基本丧失,但BBTI仍有15%的活性。
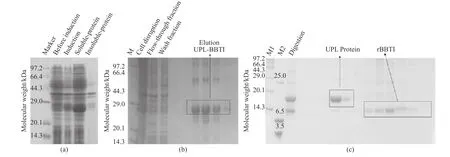
图1 融合蛋白UPL-BBTI诱导表达(a),Ni柱纯化UPL-BBTI(b)和DEAE-FF层析分离纯化rBBTI和UPL(c)Fig. 1 Induced expression of fusion protein UPL-BBTI (a), purification of UPL-BBTI with Ni column affinity chromatograph (b)and separation and purification of rBBTI and UPL with DEAE-FF anion-exchange (c)

表1 rBBTI的纯化效率Table 1 rBBTI Purification efficiency

图2 rBBTI(a)和BBTI(b)抑制胰蛋白酶和糜蛋白酶的最适温度Fig. 2 Optimal temperature of rBBTI (a) and BBTI (b) inhibiting trypsin and chymotrypsin
BBTI和rBBTI放置在4、16、25 ℃温度条件下活性均比较稳定,37、55 ℃的温度条件下放置4 h以后,活性逐渐降低。在55 ℃下放置10 h后,抑制胰蛋白酶的活性残留率为原来活性的50%左右,抑制糜蛋白酶活性残留率为原来活性的45%左右,见图3。总体而言,BBTI和rBBTI都具有较好的温度稳定性,这与以往对于BBTI的报道一致。BBTI空间结构中的7对保守的二硫键以及两个活性域中的反平行β片层结构,共同决定了BBTI较好的热稳定性特征[2,14]。
2.3 最适 pH和 pH 稳定性
图4示出了rBBTI和BBTI抑制胰蛋白酶和糜蛋白酶的最适pH。由图4可知,当pH值为8时,rBBTI和BBTI抑制胰蛋白酶的活性达到最大;当pH值为9时,rBBTI和BBTI抑制糜蛋白酶的活性达到最大;在酸性或碱性条件下,rBBTI和BBTI的活性较低。当pH值为3时,rBBTI活性全部丧失;当pH值高于10时,rBBTI和BBTI活性明显降低,见图4;相比强酸或强碱条件,pH 值在 6~10 范围内,rBBTI和BBTI抑制胰蛋白酶和糜蛋白酶效率较高。

图3 rBBTI抑制胰蛋白酶(a)、rBBTI抑制糜蛋白酶(b)、BBTI抑制胰蛋白酶(c)和BBTI抑制糜蛋白酶(d)的热稳定性Fig. 3 Thermal stability of rBBTI inhibiting trypsin (a) , rBBTI inhibiting chymotrypsin (b), BBTI inhibiting trypsin (c) and BBTI inhibiting chymotrypsin (d)

图4 rBBTI(a)和 BBTI(b)抑制胰蛋白酶和糜蛋白酶的最适pHFig. 4 Optimal pH of rBBTI (a) and rBBTI (b) inhibiting trypsin and chymotrypsin
BBTI和rBBTI在不同pH值下放置12 h后,残留的活性如图5所示,二者的活性变化趋势一致,当pH值范围在7~9时,抑制活性相对稳定。BBTI和rBBTI在pH = 8条件下,抑制胰蛋白酶的活性最稳定,在pH =7条件下,抑制糜蛋白酶的活性最稳定。
2.4 动力学参数测定
2.4.1 IC50值 BBTI和rBBTI抑制蛋白酶活性的抑制曲线如图6所示,rBBTI在抑制胰蛋白酶和糜蛋白酶的IC50值分别为0.13 mg/mL和0.8 mg/mL,显然rBBTI抑制胰蛋白酶和糜蛋白酶的抑制效率不同。BBTI抑制胰蛋白酶和糜蛋白酶的IC50值分别为0.048 mg/mL和0.05 mg/mL,在抑制胰蛋白酶和糜蛋白酶时的抑制效率差异较小。
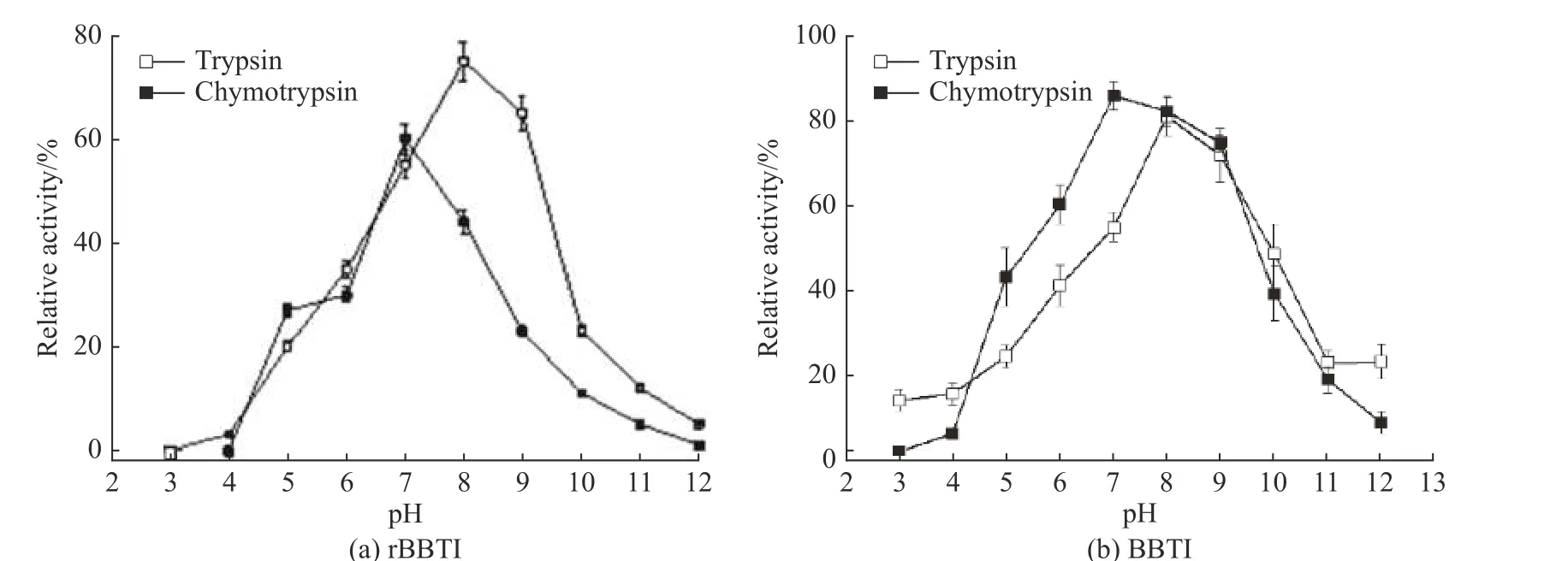
图5 rBBTI(a)和 BBTI(b)的pH稳定性Fig. 5 pH Stability of rBBTI (a) and BBTI(b)

图6 rBBTI抑制胰蛋白酶活性(a)、rBBTI抑制糜蛋白酶活性(b)、BBTI抑制胰蛋白酶活性(c)和BBTI抑制糜蛋白酶活性(d)的抑制曲线Fig. 6 Inhibition curves of rBBTI inhabiting trypsin activity (a), rBBTI inhabiting chymotrypsin activity (b), BBTI inhabiting trypsin activity(c) and BBTI inhabiting chymotrypsin activity (d)
2.4.2 抑制常数Ki值 通过Lineweavek Burk 双倒数方法作图得到图7(图中V代表反应速度,S代表底物浓度)。图7(a)反映出BBTI和rBBTI在抑制胰蛋白酶时呈现出的典型的反竞争性抑制剂的特征;而图7(b)可以表明BBTI和rBBTI在抑制糜蛋白酶时表现出了非竞争性抑制剂的特征。BBTI和rBBTI抑制胰蛋白酶和糜蛋白酶的动力学参数测定结果见表2,胰蛋白酶和BAEE反应时,米氏常数(Km)为4.9×10−5mol/L,最大反应速度(Vmax)为60 μmol/min,当加入rBBTI后,Km为2.0×10−5mol/L,Vmax为 28 μmol/min,Ki值 为4.7×10−2mol/L,当 加 入BBTI时,Km为1.0×10−5mol/L,Vmax为20 μmol/min,Ki值为7.8×10−3mol/L。对比BBTI和rBBTI的Ki值以及IC50值,发现rBBTI可以有效抑制胰蛋白酶,其抑制效率略微低于BBTI。

图7 Lineweaver-Burk双倒数法分析rBBTI和BBTI抑制胰蛋白酶(a)和糜蛋白酶(b)的动力学Fig. 7 Lineweaver-Burk plots analysis of the kinetics of rBBTI and BBTI inhibiting trypsin (a) and chymotrypsin (b)
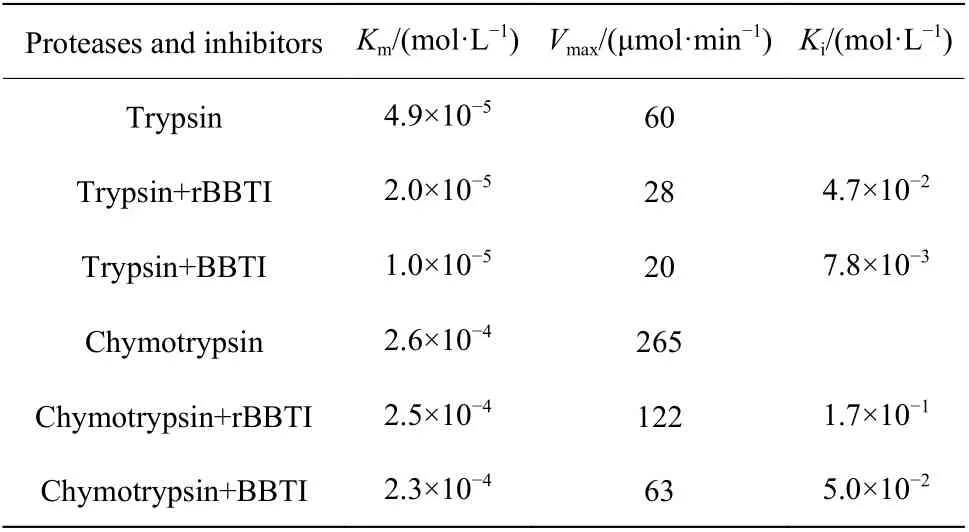
表2 rBBTI和BBTI抑制胰蛋白酶和糜蛋白酶的动力学参数Table 2 Kinetic parameters of rBBTI and BBTI to inhibit trypsin and chymotrypsin
以糜蛋白酶和ATEE为底物反应的Km为2.6×10−4mol/L,Vmax为265 μmol/min,加入rBBTI后,Km为2.5×10−4mol/L,Vmax为122 μmol/min,Ki值为1.7×10−1mol/L;当加入BBTI时,Km为2.3×10−4mol/L,Vmax为63 μmol/min,Ki值为5.0×10−2mol/L。根据BBTI和rBBTI抑制胰蛋白酶和糜蛋白酶的动力学特征参数,发现两者在抑制胰蛋白酶时是一种反竞争性抑制剂[15],抑制糜蛋白酶时是一种非竞争性抑制剂[16]。导致BBTI和rBBTI抑制效率差异的主要原因可能是BBTI的纯度比rBBTI的纯度高。
BBTI和rBBTI抑制胰蛋白酶的效率均比抑制糜蛋白酶的效率高,抑制常数Ki也表明了抑制剂与胰蛋白酶之间的亲和力强弱。已有的二元复合物的晶体结构表明BBTI与胰蛋白酶之间主要存在氢键相互作用,而且比BBTI与糜蛋白酶之间的疏水相互作用要强[17]。BBTI活性位点P1的LYS残基可与胰蛋白酶活性域的氨基酸残基形成4对氢键,首先LYS-16的羧基可分别和GLY-193、SER-195的主链氨基形成键长为2.8、2.3 nm的氢键,同时LYS-16的氨基与SER-214的羧基形成键长为2.8 nm的氢键,除此之外,ASN-18与PHE-41主链的氨基形成了键长为2.5 nm的氢键(见图8(a))。在胰蛋白酶的活性域中,ASP-189为胰蛋白酶与底物(BAEE)的结合位点[18],胰蛋白酶的催化三联体(HIS−57−ASP−102−SER−195)通过电子传递对底物进行作用,当BBTI抑制胰蛋白酶时,BBTI活性位点的LYS-16会与胰蛋白酶三联体中的SER-195形成氢键,影响胰蛋白酶催化底物时催化三联体之间的电子传递效率,使BBTI表现出能有效地抑制胰蛋白酶的特征。BBTI抑制胰蛋白酶时,BBTI和底物分别作用于胰蛋白酶的不同位点,这符合BBTI作为反竞争性抑制剂的特征,且在实验过程中发现在体系中先加入底物再加入rBBTI的抑制率,比先加入相同量rBBTI再加入底物的抑制效率更高,这恰好符合反竞争抑制剂在抑制酶活性时,反应体系中酶先与底物结合后再与抑制剂结合的特点。

图8 BBTI与胰蛋白酶之间的氢键作用(a)和BBTI与糜蛋白酶之间的疏水作用(b)Fig. 8 Hydrogen bond interaction of BBTI with trypsin (a) and hydrophobic interaction of BBTI with chymotrypsin (b)
而BBTI和糜蛋白酶之间主要存在相对较弱的疏水作用,BBTI的糜蛋白酶活性域中存在疏水链(ILE-40,PHE-50, MET-27, VAL-52)[19],当BBTI靠近糜蛋白酶的活性域时,BBTI的疏水链上残基的侧链会明显地旋转而更利于与糜蛋白酶的疏水性残基(LEU-97,ILE-95,TRP-215)形成疏水接触面[20](图8(b))。除此之外,BBTI的P2位点LEU-43残基的羧基,可与糜蛋白酶SER-195主链的氨基形成键长为2.6 nm微弱氢键,BBTI主要通过疏水作用靠近糜蛋白酶的催化位点,没有和底物竞争同一个结合位点(SER-189),这也正符合BBTI抑制糜蛋白酶为非竞争性抑制剂的实验结果。BBTI与上述两种蛋白酶之间相互作用的差异,是BBTI抑制两种酶效率不同的主要原因。
3 结 论
(1)利用新的重组表达系统成功实现了BBTI的可溶性表达,通过简单且有效的纯化方式得到了rBBTI。
(2)对比研究了天然BBTI和rBBTI的酶学性质,发现BBTI和rBBTI抑制胰蛋白酶的最适条件是pH 8,25 ℃,抑制糜蛋白酶的最适条件是pH 9,16 ℃。
(3)天然BBTI和rBBTI的抑制动力学研究表明,抑制胰蛋白酶时是一种反竞争性抑制剂,抑制糜蛋白酶时是一种非竞争性抑制剂,且两者抑制胰蛋白酶时效率更高。
