Ang Ⅱ拮抗剂对慢性肾衰大鼠肾血流量和肾内氧耗的影响
2014-08-15祝婷婷范德生杨婧周珊珊王琛严睿峻何立群
祝婷婷,范德生,杨婧,周珊珊,王琛Δ,严睿峻,何立群
(1.上海中医药大学附属曙光医院肾病科,上海市教委创新团队,上海市中医重点实验室,上海 200021;
2.上海中医药大学附属曙光医院病理科,上海 200021)
肾间质纤维化是各类慢性肾脏疾病(chronic kidney disease,CKD)进展至终末期肾脏病的共同特征[1 2]。诸多研究证据显示,慢性肾脏疾病存在肾小管间质的缺血缺氧[3,4],缺血缺氧不仅是导致肾间质纤维化的主要病理环节,而且是肾小管间质病变进展的重要机制之一[1]。本研究通过建立5/6(ablation/infarction,A/I) 肾切除大鼠缺血缺氧慢性肾功能衰竭(CRF)模型[5],探讨Ang Ⅱ拮抗剂(ACEI联合ARB)对慢性肾衰大鼠肾功能的保护机制。
1 材料与方法
1.1 实验动物
SPF级成年SD大鼠50只,雄性,8周龄,体重190~210 g,由上海西普尔-必凯实验动物有限公司提供【SCXK(沪)2008-0016】。饲养于上海曙光医院实验动物SPF中心【SYXK(沪)2009-0069】,饲养于昼夜明暗交替时间12h/12h,室温(22±2)℃,相对湿度 (55±2)% 环境下,自由饮食(饲料为市售固体饲料,饮用水为自来水)。按实验动物使用的3R原则,给予大鼠人道的关怀。
1.2 实验模型制作与干预
从50只大鼠中选取14只为假手术组(A组),其余的36只按5/6(A/I)慢性肾衰模型法制备大鼠肾衰模型[4]。造模方法:用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉大鼠,备皮后,在左侧肋弓下0.5 cm、脊柱向左旁开1 cm处切开一垂直于脊柱(长约2.5 cm)的切口。无菌条件下经腹膜后取左肾,分离肾包膜。将左肾动脉的2/3分支结扎,缝合。7 d后摘除右肾。28 d后断尾法采血,测定肾功能指标,剔除造模失败和死亡动物后,造模成功存活共计28 只,造模成功率为84%。在存活的28只大鼠中,根据血清肌酐水平分组,按Scr组间无统计学差异,随机取28只分为模型组(B组)和西药组(C组),每组14只。三组干预方法:按照大鼠药物剂量=成人标准体重( 60 kg) 常规用量×20倍灌胃。A组和B组予纯净水2 mL灌胃;C组予氯沙坦钾联合福辛普利钠药液2 mL(6.42 mg/mL)灌胃,均每日1次,连续60 d。
1.3 主要试剂及设备
氯沙坦钾(杭州默沙东制药有限公司,批号:H20030654),福辛普利钠(中美上海施贵宝制药有公司,批号:H19980197),超声波血流检测仪(美国Transonic System Inc,型号:T206U),血压仪(北京软隆科技有限公司智能无创血压计,BP- 98A),血气分析仪(i-STAT,美国Abbott Point of Care Inc),血气生化多项测试卡片(i-STAT EG7+芯片)。
1.4 模型评价
1.4.1 生化指标检测
采集大鼠血液及尿液标本经全自动生化分析仪检测Scr、BUN、Hb。用内生肌酐清除率(Ccr)代替肾小球滤过率(GFR):Ccr(mL/min)=尿肌酐 × 24 h尿量(mL)/血清肌酐 × 1440[6]。
1.4.2 肾内血流量和肾内耗氧量检测
干预60 d后测定大鼠的肾血流量:2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉大鼠后,局部备皮常规消毒,沿腹白线从剑突下切开长约7 cm的纵行切口,暴露左肾,剥离血管外包膜,分离肾动、静脉。用超声波血流检测仪的检测探头,探测肾静脉血流量,待血流稳定后,读取RBF值并记录后,取出检测探头,分离腹主动脉外血管包膜,暴露腹主动脉,用1 mL血气针分别从腹主动脉、肾静脉中抽取约0.2 mL动静脉血,采用血气分析仪的血气生化多项测试卡片分别检测腹主动脉和肾静脉的氧饱和度(O2Hb%)、氧分压(PO2)、左肾静脉压(RVpO2)。过程中注意无菌操作。腹主动脉、肾静脉氧含量计算公式:QO2(A-V)=AQO2- VQO2,AQO2=(1.39 × tHb × O2Hb% + PO2× 0.003)÷ 100,VQO2=(1.39 × tHb × O2Hb% + PO2×0.003)÷100,TNa=(FNa- UNaV),FNa=GFR × PNa。肾内氧耗应用钠吸收的氧耗(QO2/TNa)=QO2/TNa(mL/mmol)来计算。
1.4.3 病理学改变
干预60 d后,于采集血标本后摘取残肾组织,置于4%甲醛溶液中固定>24 h后,经全自动组织脱水机脱水后石蜡包埋,制成3 μm的切片。常规HE染色后,观察肾脏组织病理形态。
1.5 统计学处理
2 结果
2.1 造模后生化指标比较
与A组比较,B、C组的Scr、Bun明显升高(P<0.01), Ccr、Hb明显降低(P<0.01);与A组比较,B、C组的尾动脉SBP、DBP明显升高(P<0.01),表示造模成功。见表1、表2。
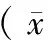
表1 造模28 d后各组大鼠各指标变化±s,n=14)

表2 造模28 d后大鼠血压值变化±s,n=10)
2.2 治疗60 d后各组指标比较
2.2.1 生化指标比较
与A组比较,B、C组的Scr、Bun明显升高(P<0.01),Ccr、Hb明显下降(P<0.01)。与B组比较,C组的Scr明显下降(P<0.01),Bun下降(P<0.05),Hb、Ccr明显上升(P<0.01)。见表3。

表3 60 d后各组大鼠各指标的变化±s,n=14)
2.2.2 各组Scr、Bun、Ccr比较
A组内比较,经模拟治疗后Scr、Bun、Ccr水平无变化(P>0.05)。B组内比较,经模拟治疗后Scr、Bun、Ccr水平无变化(P>0.05)。C组内比较,经治疗后Scr水平明显下降(P<0.01),Bun水平下降(P<0.05),Ccr水平明显升高(P<0.01)。见表4。

表4 60 d后各组大鼠Scr、Bun、Ccr前后比较±s,n=14)
2.2.3 各组RBF、RVpO2、QO2/TNa比较
与A组比较,各组RBF、RVpO2明显降低(P<0.01),肾内氧耗明显升高(P<0.01)。与B组比较,C组的RBF升高(P<0.05),RVpO2明显升高(P<0.01),肾内氧耗明显降低(P<0.01)。说明经西药治疗后,慢性肾衰模型大鼠肾内血流情况改善,肾内氧耗减少。见表5。

表5 60 d后各组大鼠RBF、RVpO2、QO2/TNa指标变化±s,n=14)
2.2.4 各组大鼠血压比较
与A组比较,B组的SBP、DBP明显升高(P<0.01),C组的SBP明显升高(P<0.01),DBP升高(P<0.05)。与B组比较,C组的SBP、DBP明显降低(P<0.01)。说明经西药治疗后,慢性肾衰模型大鼠的收缩压和舒张压降低明显。见表6。

表6 60 d后各组大鼠血压变化情况±s,n=10)
2.3 病理学观察
肾组织形态学表现:HE染色可见正常组(A组)肾小球结构正常,管腔无扩张,毛细血管基底膜呈线性,无增厚,包曼氏囊囊腔清晰,无扩张,肾间质无炎性细胞浸润,无纤维组织增生。5/6(A/I)模型组(B组)大鼠肾小球结构紊乱,呈弥漫性硬化,球囊粘连,肾小球周围纤维化,毛细血管腔严重受压闭塞,肾间质炎性细胞浸润,肾小管可见蛋白管型。西药组(C组)肾小球结构较5/6(A/I)模型组清晰,包曼氏囊存在,未见明显球囊粘连,囊腔结构较5/6(A/I)组完整,肾小球纤维化较5/6(A/I)组有所减轻,管腔无明显扩张,间质有少量炎性细胞浸润,蛋白管型较5/6(A/I)组减少。见图1(彩插15)。
3 讨论
在生理情况下,肾脏通过肾小管活跃的重吸收实现对机体内环境的调节作用,肾小管的主动重吸收需要大量氧供,而肾小管间质的氧供有限,易出现组织的缺血缺氧[1]。自Fine等[7]提出慢性缺氧假说以来,越来越多的证据显示慢性肾脏疾病存在肾小管间质的缺血缺氧[3 4]。
在病理残肾组织,肾小管间质的缺血缺氧先于其病理学改变。研究显示,肾小管毛细血管网的早期缺血缺氧与肾素-血管紧张素系统(RAS)的激活有关[3]。在各种血管活性物质中,RAS系统的局部激活尤为重要,它导致出球小动脉的收缩,肾小管周围毛细血管的低灌注,引起下游肾小管间质的缺氧[8]。缺血缺氧直接参与肾间质纤维化,而间质纤维化又进一步影响肾小管间质的血流供应和氧的弥散[1],肾小管细胞的长期缺血缺氧,严重影响其线粒体的能量代谢,最终导致细胞凋亡[8]。
RAS的激活,增加了Ang Ⅱ的水平[9]。Ang Ⅱ是RAS中最主要的效应物质[10],通过与其受体结合,从多种途径参与肾间质纤维化。Ang Ⅱ通过诱导全身和肾小球高血压,引起继发于肾内血管收缩的缺血性肾损伤,减少肾血流量,升高滤过膜通透性导致蛋白尿[11],增加管周毛细血管网的丢失,造成无效的细胞呼吸[8]等血流动力学作用促进肾小球硬化及肾间质纤维化进展。在纤维化过程中,Ang Ⅱ也作为一种促炎细胞因子存在,它激活单核细胞,增加促炎介质(细胞因子、趋化因子、粘附分子、NF-κB)[10],可能导致局部炎症[11]。Ang Ⅱ同时激活成纤维细胞[12],促使肾小管上皮细胞经上皮-间充质细胞转分化为成纤维细胞[13],刺激促纤维化细胞因子TGF-β的产生,诱导氧化应激,并刺激血管和肾小球系膜细胞的增殖和肥大[11],增加基质沉积[14]等非血流动力学作用加速病变进展。
ACEI可通过经典途径抑制血管紧张素I(Ang I)转换为Ang Ⅱ发挥作用,而对于非经典途径产生的Ang Ⅱ无能为力,出现“逃逸”现象[15]。ARB则直接阻断Ang Ⅱ与其受体结合而发挥作用[16],可以同时阻断非经典途径产生的Ang Ⅱ的作用。两者联合应用能够完全阻断Ang Ⅱ信号途径[17]。近年来,一些研究发现,ACEI和ARB联用能产生更好的肾脏保护作用[18 ,19]。
通常肾小管99%以上的钠的重吸收需要消耗细胞线粒体产生的ATP,因此肾内氧耗(QO2)主要与钠的重吸收(TNa)有着直接密切关系。本实验采用肾动-静脉之间的氧含量差与肾小管重吸收钠的比值(QO2/TNa)可衡量肾内氧耗[20, 21]。
既往研究显示,ACEI/ARB可能通过增加肾血流量,提高肾间质微血管氧分压来起到保护肾脏的作用[22 23]。ACEI/ARB不仅降低肾小球内高血压,也可能通过抑制Ang Ⅱ促炎症和血管收缩作用[12],延缓肾小管周围毛细血管管腔面积的缺氧相关性缩窄和扭曲、保护毛细血管网状结构的完整性以及管腔通畅[3],减少大分子蛋白从肾脏滤除[24],减轻因纤维化应答引起的毛细血管网闭塞[13],减轻肾小管上皮细胞的缺氧,下调缺氧反应性基因的表达,增加皮层组织氧张力[3],改善线粒体的能量代谢等途径延缓慢性肾衰进展。本实验结果表明:氯沙坦钾联合福辛普利钠能明显降低CRF大鼠的Scr、肾内氧耗(QO2/TNa)、SBP、DBP(P<0.01),降低BUN(P<0.05),显著提高Hb、Ccr、肾血流量、RVpO2(P<0.01),可验证了本研究结果与既往的研究显示不谋而合,本研究肾组织病理结果显示:与模型组相比,西药组肾组织病理变化明显减轻。
综上所述,本实验运用ACEI联合ARB治疗,可以降低慢性肾衰大鼠血压,降低肾内氧耗(QO2/TNa),增加残肾的血流量,改善肾功能,减轻残肾组织的病理改变。其肾脏保护作用机制可能与其调节细胞能量代谢,改善肾内氧耗有关。
(本文图1见彩插15。)
[1] 王海燕.肾脏病学.第三版 [M].北京:人民卫生出版社,126, 799-820.
[2] 胡安康, 朱孝荣, 袁红花.慢性肾衰竭大鼠模型的建立 [J].中国实验动物学报, 2011, 19(1):34-38.
[3] Manotham K, Tanaka T, Matsumoto M, et al.Evidence of tubular hypoxia in the early phase in the remnant kidney model [J].J Am Soc Nephrol, 2004, 15(5):1277-1288.
[4] Iseki K, Ikemiya Y, Iseki C, et al.Haematocrit and the risk of developing end-stage renal disease [J].Nephrol Dial Transplant, 2003,18:899-905.
[5] Kliem V, Johnson RJ, Alpers CE, et al.Mechanisms involved in the pathogenesis of tubulointerstitial fibrosis in 5/6-nephrectomized rats [J].Kidney Int, 1996, 49(3):666-678.
[6] 王海燕.肾脏病临床概览 [M].北京:北京大学医学出版社, 2009.12:18-19.
[7] Fine LG, Bandyopadhay D, Norman J T.Is there a common mechanism for the progression of different types of renal diseases other than proteinuria? Towards the unifying theme of chronic hypoxia [J].Kidney Int, 2000, 57:S22-S26.
[8] Nangaku M.Chronic hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure [J].J Am Soci Nephrol, 2006, 17(1):17-25.
[9] Graciano ML, de Cassia Cavaglieri R, Dellê H, et al.Intrarenal renin-angiotensin system is upregulated in experimental model of progressive renal disease induced by chronic inhibition of nitric oxide synthesis [J].J Am Soc Nephrol, 2004, 15(7):1805-1815.
[10] Koo JW.Renal interstitial fibrosis and angiotensin inhibition [J].Electrolyte Blood Press, 2006, 4(1):35-43.
[11] Long DA, Price KL, Herrera-Acosta J, et al.How does angiotensin II cause renal injury? [J].Hypertension, 2004, 43(4):722-723.
[12] Rodriguez-Iturbe B, Johnson RR, Herrera-Acosta J.Tubulointerstitial damage and progression of renal failure [J].Kidney Int, 2005, 68:S82-S86.
[13] Manotham K, Tanaka T, Matsumoto M, et al.Transdifferentiation of cultured tubular cells induced by hypoxia [J].Kidney Int, 2004, 65(3):871-880.
[14] Nangaku M.Mechanisms of tubulointerstitial injury in the kidney: final common pathways to end-stage renal failure[J].Intern Med, 2004, 43(1): 9-17.
[15] Hollenberg NK, Fisher NDL, Price DA.Pathways for angiotensin II generation in intact human tissue: evidence from comparative pharmacological interruption of the renin system [J].Hypertension, 1998, 32(3):387-392.
[16] 刘付捷, 陈贤, 黄访英, 等.中晚期慢性肾衰竭患者应用ACEI和AR1B有效性及安全性初探 [J].中国中西医结合肾病杂志, 2007, 8(6):349-350.
[17] 陈楠, 陈佳韵.ACEI和ARB的肾脏保护机制、临床研究及其应用 [J].中华医学信息导报, 2005, 20(5):14-14.
[18] Komine N, Khang S, Wead LM, et al.Effect of combining an ACE inhibitor and an angiotensin II receptor blocker on plasma and kidney tissue angiotensin II levels [J].Am J Kidney dis, 2002, 39(1):159-164.
[19] Jacobsen P, Andersen S, Rossing K, et al.Dual blockade of the renin-angiotensin system versus maximal recommended dose of ACE inhibition in diabetic nephropathy [J].Kidney Int, 2003, 63(5):1874-1880.
[20] 杨婧, 王琛, 邵命海, 等.肾衰 Ⅱ 号方对 5/6 肾切除大鼠肾血流量和肾内氧耗影响及其作用机制 [J].中国中西医结合肾病杂志, 2011, 12(7):578-581.
[21] Deng A, Tang T, Singh P, et al.Regulation of oxygen utilization by angiotensin II in chronic kidney disease [J].Kidney Int, 2009, 75(2):197-204.
[22] Norman JT, Stidwill R, Singer M, et al.Angiotensin II blockade augments renal cortical microvascular pO2indicating a novel, potentially renoprotective action [J].Nephron Physiol, 2003, 94(2): 39-46.
[23] Deng A, Tang T, Singh P, et al.Regulation of oxygen utilization by angiotensin II in chronic kidney disease [J].Kidney Int, 2009, 75(2):197-204.
[24] 李小飞, 余学清.血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂在治疗慢性肾脏疾病患者蛋白尿的临床疗效对照研究 [J].中国医药导报, 2013, 9(35): 69-70.
