无线遥测和刺激技术建立兔房颤模型的探索
2014-08-15宋磊陈颖敏张方亮罗章源张文赞何奔
宋磊,陈颖敏,张方亮,罗章源,张文赞,何奔
(上海交通大学医学院附属仁济医院,上海 200001)
随着人口的老龄化,房颤成为临床最常见的心律失常之一,房颤的主要并发症有心衰和栓塞等,其发病严重影响人群的身体健康[1]。目前公认的机制为触发机制,房颤的维持因素是电重构和结构重构[2]。房颤模型的建立不仅有利于对房颤机制的进一步研究,更有利于药物和新的治疗方法的研究。房颤动物模型的建立有多种方法[3],但是建立一种灵活简便、容易检测、持续时间较长的房颤模型并不容易[4]。早在1995年,wijffels等[5]对山羊有线程控心房电刺激,成功证实了心房颤动导致的渐进性的心房电重构和结构重构;促进了房颤本身的发生和发展。但是这种模型需限制山羊的自由活动,且易感染。针对有线程序控制电极刺激产生房颤的缺点,我们自主研发的无线植入式遥测刺激器,以符合动物生理要求,减少动物的痛苦和感染的概率,在比格犬上成功完成了心房颤动模型的实验[6]。由于兔的心房更小,连续刺激不容易产生房颤波[7],对于新西兰兔房颤模型的研究,符合实验动物福利的替代原则要求。因此,进行了植入式无线遥测和刺激技术在兔身上的探索性实验研究,主要包括对植入子的性能和结构的评估和改进以及实验方法的探索[8]。
无线刺激与遥测系统包括:带心电采集及电荷补偿的刺激、2.4G无线收发控制组成的植入子遥测刺激仪、接收及中转仪,计算机程序控制软件三部分,其工作示意图如图1(封二)所示。
植入式刺激仪器为直接植入动物腹腔内,包括植入子与腹腔环境(如肌肉、血液、体液接触的部分)和刺激电极与心脏的相接触。
接收机通过2.4G无线收发模块及其控制系统,实现对植入刺激仪的控制和信号传输,与植入刺激仪的收发距离达到2米,能满足新西兰兔刺激实验要求。
计算机程序刺激软件主要实现研究人员通过计算机输入指令信息,通过无线信号接收与控制系统发放致植入式遥测刺激器,控制和调整植入式遥测刺激器的运行,其内外控制与通讯设计如图2所示[9-12]。

图2 植入式刺激仪内外控制与通讯设计图
1 材料与方法
1.1 材料
1.1.1 试剂与仪器
杰升生物公司无线植入式遥测刺激器,无菌纱布,无菌棉球,高压蒸汽消毒锅,1 mL注射器,5 mL注射器,小动物胸廓撑开器,止血钳,小铺巾,酒精,碘伏,拉钩,带线缝针,咪达唑仑注射液,陆眠宁II注射液,青霉素钠,生理盐水。
1.1.2 实验动物
雌性新西兰兔2~2.3 kg,12周龄,来源于上海市松江区车墩实验动物良种场【SCXK(沪)2012-0008】。无菌实验在上海交通大学医学院实验动物科学部进行【SYXK(沪)2012-0050】。并按实验动物使用的3R原则给予人道关怀。
1.2 方法
根据前期在比格犬身上已经完成的房颤模型实验研究,成功诱导出持续的房颤,如图3。现用新西兰兔取代比格犬,进行优化、改良及替代的实验。
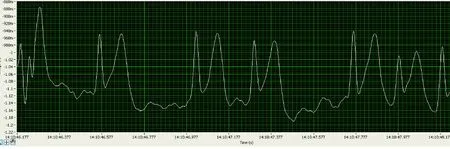
图3 犬房颤体表心电图
新西兰兔,称重,肌肉注射陆眠宁II注射液2~4 mg/kg,计数动物呼吸次数作为麻药对动物呼吸抑制的指标。用软尺测量动物瞳孔大小作为麻醉深度指标,以瞳孔变化最小为宜。待兔肌肉松弛后,耳源静脉注射咪达唑仑0.5 mg/kg,等待动物睫毛反射、角膜反射减弱,钳夹趾间组织偶而引起趾蹼反射,肌肉完全松弛,无躁动,提示进入麻醉状态[13],将动物保定于手术台上,左胸前区及右中腹部剃毛,消毒,铺巾,带无菌手套,利多卡因在切口周围局部注射形成皮丘[14]。剪开右侧中腹部皮肤至皮下层,制作皮袋,将植入子放入,右侧腋下及左侧腋下剪开小口,用止血钳将心电采集电极从皮道拉出缝合。观察正常心电图,观察心电是否平稳。剪开左侧第二三肋间皮肤逐层分离肌肉到肋间肌处,刺激电极经皮道拉至二三肋间处。钝性分离肋间肌及胸膜,用小动物肋骨撑开器撑开,提起心包剪开小口,纱布浸干心包液体,止血钳将心包提起,刺激电极缝于心房表面及心耳处。用正常心动周期0.75~0.5倍的阈上期前刺激连续刺激,观察有刺激效果则关胸缝合,青霉素40万U/d抗感染,每天开启控制系统观察。3 d后,动物手术恢复,开启程序刺激频率20 Hz,电流2 mA,脉宽1 ms 刺激2 s间隔2 s, 占空比20%。如发现房颤及时停止刺激;没有房颤则继续刺激。
2 结果
2.1 植入式遥测刺激器兔体内刺激产生房颤情况
植入式遥测刺激器植入兔体内连续工作30 d,刺激前心电信号如图4,P波QRS波及T波均清晰,基线稳定。胸前7 Hz连续期前刺激成功同步心房率,体表心电图如图5。20 Hz程序刺激(强度2 mA,脉宽1 ms,刺激2 s,暂停2 s)如图6,刺激后心率明显加快,三周程序刺激后成功出现持续性房颤,房颤时间>48 h,如图7。整个实验过程中兔均保持清醒及自由活动状态,饮食等生活习惯均未改变。
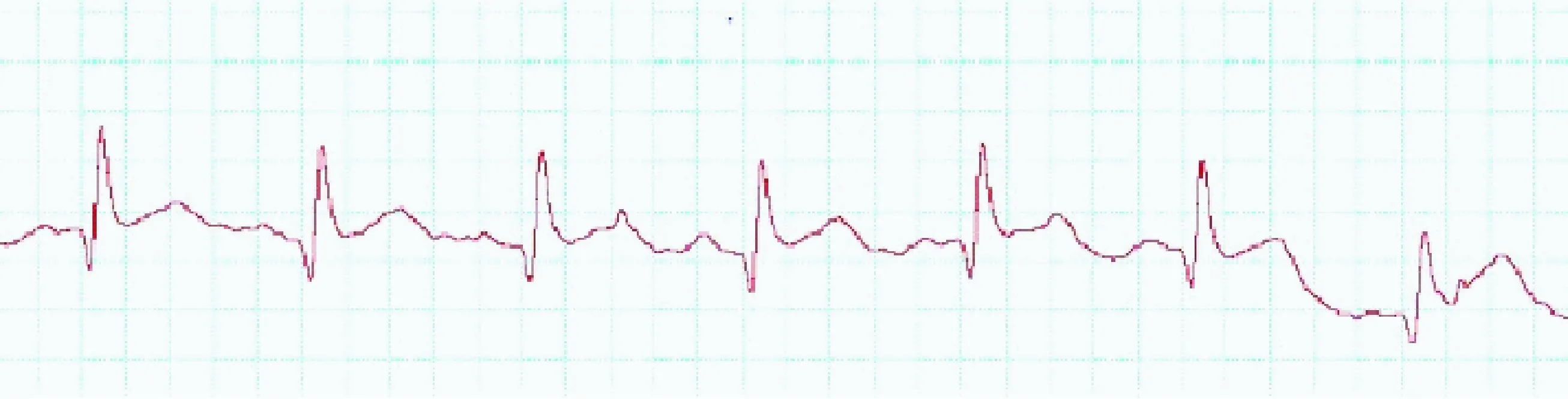
图4 程序刺激前新西兰兔心电图
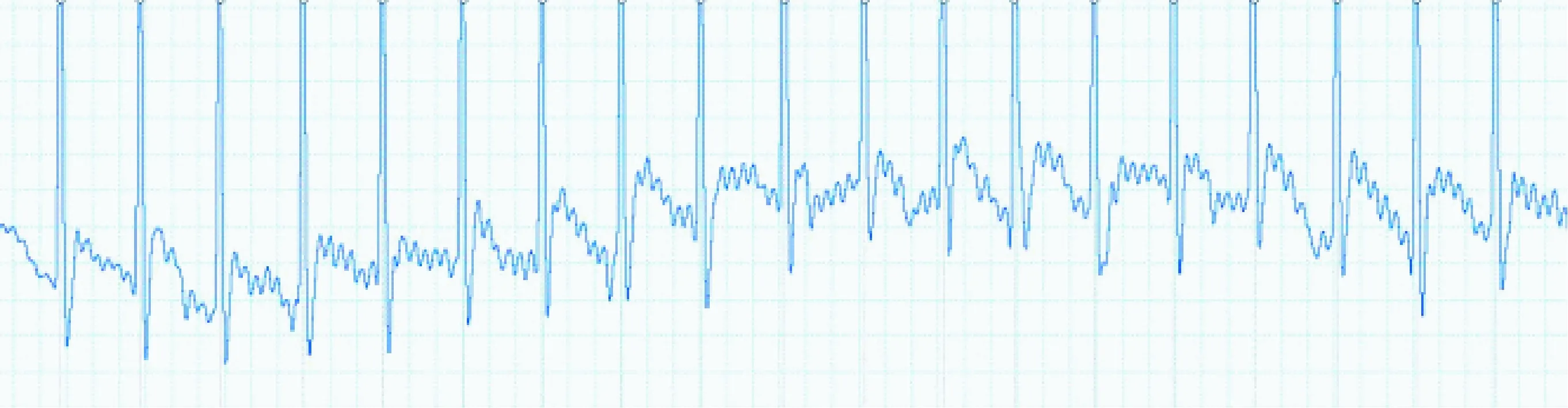
图5 7 Hz连续期前刺激
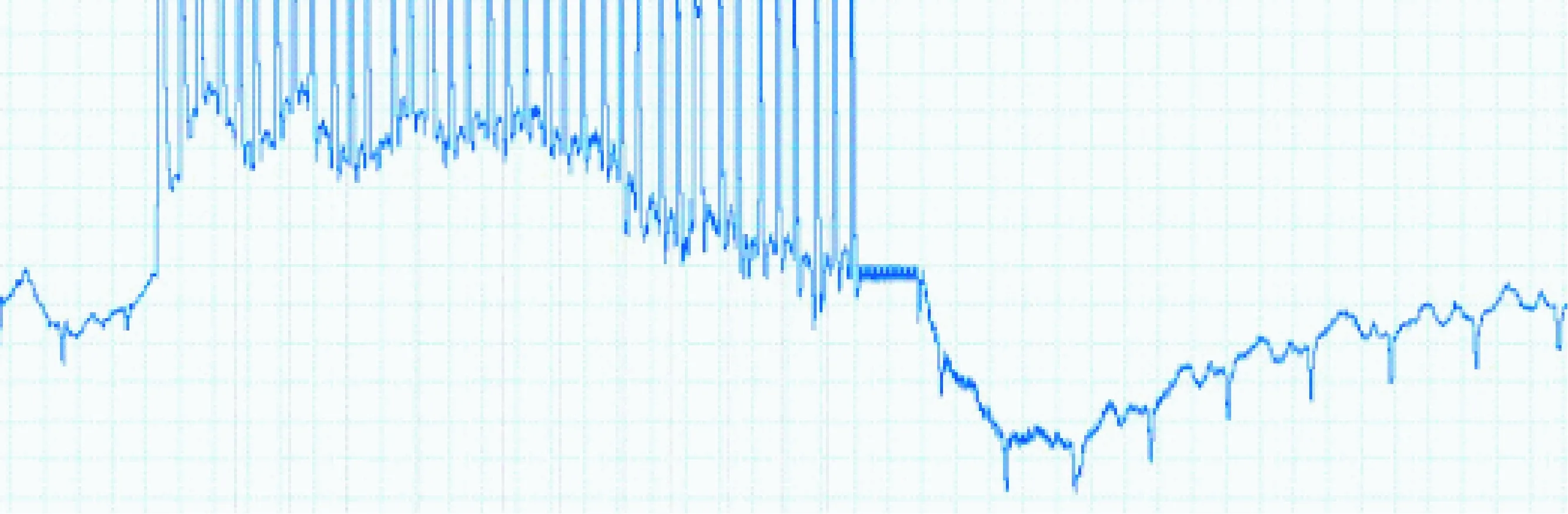
图6 20 Hz程序刺激
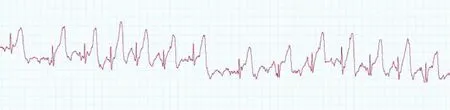
图7 兔持续房颤体表心电图
2.2 植入式遥测刺激器电极改良情况
实验中发现,心内膜与心外膜的差异导致起搏器电极无法使心房得到有效刺激。炎症水肿导致电阻增高,电流无法通过刺激无效,自主研发植入式遥测刺激器实验中电极刺激有效是房颤模型成功的关键和难点。由于心内膜与心外膜的解剖差异,起搏器电极与心外膜电极固定方法不同[15],心内膜起搏器电极为螺旋电极。兔心房壁较薄螺旋电极无法牢固固定于心房内壁,如图8-A。另外电极要求较高目前无法实现。反复实验发现,不锈钢电极和铁丝电极都无法满足试验的要求,如图8-B。铂金电极效果比较好,但片状电极无法完全接触到心房,如图8-C。改良电极刺激有效率为100%,如图8-D。直接把电极缝在心房上的方法使心房穿针部位的炎性水肿,引起电极导电能力下降,因此电极隔离硅胶片封合在电极缝合于心包膜内侧,整个电极塞入心包内,电极直接接触心房但不做缝合,这种方法避免单一位置刺激水肿血栓坏死的发生,有助于提高刺激有效率(图8见封二)。
3 问题及讨论
实验中发现频率较低的高频程序刺激产生房颤所需时间较长,但刺激耐受性较好,频率较高的高频程序刺激产生房颤,需要时间短,但动物耐受性较差。因此,我们采用间歇性刺激的方法:高频刺激2 s,间歇2 s后的方法成功的诱发出了房颤,但是这种方法诱发房颤时间较长,是否可以高频刺激3 s间歇2 s,会更快的诱发房颤,比较哪种更加容易使动物产生房颤又不导致动物死亡,用以寻找最佳刺激方案需进一步研究。最佳刺激电极位置的选择也是实验成功的一个关键因素,既要能满足刺激后心房有效应答,又要使电极容易被安置,我们选择了左心耳、左心房作为电极的安置部位。此外在体程控电极刺激和刺激阈值的关系需要探索,因为在实验中观察到新西兰兔在刺激一定时间后阈值升高,刺激电压需要加大,这就需要细化一种最佳刺激方案包括不同时间段使用不同刺激强度和频率。研发一种能够监测房颤阈值的植入系统也很必要。
实验过程中发现有动物死亡,主要由于牵拉过度,对侧气胸导致动物窒息而死。因此,实验中对胸膜的保护是防止动物死亡的关键之一;同时要求开胸部位应较远离胸骨靠近腋部。动物死亡前,呼吸频率明显下降,腹式呼吸明显增强,口部发紫。开胸注意肋骨选择的高度以及撑开的宽度,光源选择相对集中,尽量减少手术视野,同时使视野尽量清楚。
植入子电极电线埋藏于植入子的背面有利于保护电极电线。因为实验观察到:新西兰兔将植入子扒出伤口,咬断电线导致实验终止的现象比较严重。
应当研制药物涂层表面的植入子,防止植入子在皮下感染的发生。还需改进植入子的体积及导线的粗细,进一步小型化。当然电极如果能够经血管插管进入心房并牢固固定于心房内壁可以避免开胸,可以最大程度减少对动物的伤害,但是这无疑增加了对电极导线的要求,及手术操作及设备的要求以及实验成本的负担。
用新西兰兔代替比格犬建立基于无线遥测和刺激基础上的房颤模型是完全可行的。同时也体现了动物福利的优化和替代原则。
(本文图1,8见封二。)
[1] Hoogstra-Berends F1, Meijering RA, Zhang D, et al.Heat shock protein-inducing compounds as therapeutics to restore proteostasis in atrial fibrillation [J].Trends Cardiovasc Med.2012, 22(3):62-68.
[2] Heijman J1, Voigt N, Nattel S, et al.Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression [J].Circ Res.2014, 114(9):1483-1499.
[3] 陈雯雯,罗章源,陈颖敏.心房颤动动物模型建立的方法学 [J].中国心脏起搏与电生理杂志, 2010, 24(5):390-393
[4] Butters TD1, Aslanidi OV2, Zhao J3, et al.A novel computational sheep atria model for the study of atrial fibrillation [J].Interface Focus.2013, 3(2):416-423.
[5] Wijffels MC, Kirchhof CJ, Dorland R, et al.Atrial fibrillation begets atrial fibrillation.A study in awake chronically instrumented goats [J].Circulation, 1995, 92:1954-1968.
[6] 陈雯雯, 陈颖敏, 徐瑾, 等.基于无线刺激与遥测系统的心房颤动动物模型 [J].中国心脏起搏与电生理杂志, 2012, 26(3):241-245.
[7] Zhang DX, Ren K, Guan Y, et al.Protective effects of apocynin on atrial electrical remodeling and oxidative stress in a rabbit rapid atrial pacing model [J].Chin J Physiol.2014, 57(2):76-82.
[8] 贺争鸣,邢瑞昌,方喜业,等.论实验动物福利、动物实验与动物实验替代方法[J].实验动物科学与管理,2005, 22(1):62-64.
[9] Luo Z,Sonkusale SS.A novel BPSK demodulator for biological implants [J].IEEE Tans Circuits Syst I, 2008, 55(6):1478.
[10] Lee HM,Ghovanloo M.A high frequency active voltage doubler in standard CMOS using offset-controlled comparators for indutive power transmission [J].IEEE Trans Biomed Circuits Syst, 2013; 7(3): 213-224.
[11] Liang CK, Chen JJ, Chung CL.A wideband wireless neural stimulation platform for high-density microelectrode arrays [J].Conf Proc IEEE Eng Med Biol Soc.2006,1:4404-4407.
[12] Donaldson ND, Zhou L, Perkins TA, et al.Implantable telemeter for long-term electmneurographie recordings in animals and humans [J].Med Biol Eng Comp,2003, 41:654-664.
[13] 郑桂银,唐晶晶.外科动物实验应用安定麻醉144例家兔效果观察.实验动物科学[J].2008, 25(6):64.
[14] 何艳梅, 李亚洁.2%利多卡因局部麻醉皮肤擦伤伤口对减轻清创时疼痛的效果观察,现代临床护理[J].2012, 11(4):15-17.
[15] Lin G, Nishimura RA, Connolly HM, et al.Severe symptomatic tricuspid valve regurgitation due to permanent pacemakeror implantable cardioverter-defibrillator leads [J].Am Coll Cardiol,2005, 45(10):1672-1675.
