改进的TTC染色法显示大鼠心肌缺血再灌注损伤
2014-08-15李粮辉陈文华郑宏
李粮辉,陈文华,郑宏
(1.福建医科大学附属协和医院麻醉科,福州 350001;2.南京军区福州总医院麻醉科,福州 350025)
心肌缺血再灌注损伤是近十几年来医学界研究的热点之一,其重要的病理特征之一是出现心肌梗死区。而心肌梗死面积是评价心肌缺血再灌注损伤的一个重要指标[1-3]。2,3,5-氯化三苯基四氮(2,3,5-triphenyltetrazolium chloride,TTC)染色法常用于估计心肌梗死面积[4]。传统经典的TTC心肌染色方法是在心肌取材后进行离体心肌的TTC染色,但因受体外各种条件的影响较大,染色结果常不尽如人意[5]。我们在实验过程中,对传统TTC染色方法进行了改进,本研究通过改进后的TTC染色方法和传统TTC染色方法的比较来探讨TTC染色方法的改进是否对于大鼠缺血再灌注心肌梗死区的识别度有所提高,以期得到更好的TTC染色方法。
1 材料和方法
1.1 动物及分组
清洁级SD大鼠20只,雄性,8周龄,体重250~300 g,由上海斯莱克实验动物有限责任公司提供【SCXK(沪)2012-0005],实验在福建医科大学附属协和医院心血管内科实验室。按随机数字表法将大鼠分为两组,每组10只,A组:传统TTC染色法组,B组:改进后的TTC染色法组。
1.2 实验材料和器材
10%水合氯醛注射液(福建医科大学附属第一医院试剂,批号:120419);37%~40%甲醛溶液(上海天莲精细化工有限公司,批号:20090610);磷酸盐(PBS)缓冲液(福州中杉金桥生物技术有限公司,批号:20120918);Evans blue粉剂(美国Sigma公司,批号:00281342);2,3,5-氯化三苯基四氮唑(TTC)粉剂(美国Amersco 公司,批号:00332543);手术器械一套(上海医疗器械厂);小动物呼吸机(TKR-200C型,江西特力麻醉呼吸设备公司);图形分析软件 Image Pro Plus V 6.0 (美国 Media Cybernetics 公司);数码摄像机(LX5型,松下电器(中国)有限公司)。
1.3 大鼠心肌缺血再灌注损伤模型的建立
用10%水合氯醛溶液3.5 mL/kg腹腔注射麻醉,取仰卧体位固定四肢和牙齿。参考文献[6-8]的方法,将5个电极针分别插入大鼠的四肢皮下和胸骨体下缘平面与腋前线交汇处皮下,温控探头监测大鼠肛温,术中重点观察V5、I、II、III导联心电图。并行股静脉和颈动脉置管。参考文献[9,10]的方法并改进,用20G静脉留置针充当气管导管在大鼠气管环甲膜处行环甲膜穿刺置套管外接小动物呼吸机,行机械通气(通气频率为60次/分,吸呼比为1∶1.5)。取左侧第四肋间开胸,剥离心包,在左心耳下方约2 mm处用眼科小圆针5/0线穿过左冠状动脉前降支(LAD)下方,可逆性结扎左冠状动脉前降支(LAD),肢体导联或胸导联心电图出现ST段抬高0.2 mV以上或者出现增高增宽的QRS波,说明结扎LAD成功。心肌缺血45 min后松开结扎线恢复灌注,逐层缝合、拔除股静脉和颈动脉处置管,待大鼠开始苏醒后拔除气管留置套管,大鼠放归清洁新笼舍。
1.4 血清CtnI测定
24 h后为再灌注结束时间,大鼠10%水合氯醛溶液3.5 mL/kg腹腔注射麻醉,剪开腹腔,用2 mL注射器从下腔静脉抽取约2 mL血液,装入离心管,低温高速离心机离心15 min,转速3000 r/min。将离心分离后的血清分装入新的离心管内,密封,标记,采用全自动生化仪(Beckman DxC800)检测血清CtnI浓度。
1.5 染色方法
1.5.1 A组参考文献[11]按照传统染色方法染色
大鼠心肌缺血再灌注结束时开胸,由下腔静脉取血2 mL后重新原位结扎大鼠LAD,从大鼠下腔静脉注射1%伊文思蓝溶液2 mL,取出心脏,经-70℃冰箱速冻15 min后取出,垂直心脏长轴切取5片厚度约1 mm心肌片,立即用二片玻片夹住,轻轻展平以防止皱缩,将5片心肌切片一起放入1% TTC-PBS溶液中37℃恒温避光水浴15 min,随后放入4%甲醛溶液中固定12 h。
1.5.2 B组采用改进后的染色方法
大鼠心肌缺血再灌注结束时开胸,由下腔静脉取血2 mL后从大鼠下腔静脉处缓慢注射1% TTC溶液共计1 mL,然后原位结扎大鼠LAD,再从大鼠下腔静脉注射1%伊文思蓝溶液2 mL,当大鼠口唇变蓝时,取出心脏,用生理盐水冲洗多余染料,用吸水滤纸吸干多余水分,经-70℃冰箱速冻15 min后取出。快速以垂直心脏长轴的角度,从心尖到结扎结处平行切取心肌,心尖端的一点心肌弃之不用,剩下部分均匀切成5片,每片厚度约1 mm。不进行TTC溶液水浴和甲醛溶液固定。
1.6 心肌梗死面积测定
染色完成后,数码相机拍摄心肌切片图像,经过Image-pro Plus V6.0图像处理软件分析计算出梗死区面积(Infact size, IS)和缺血区(Area at risk, AAR)的比值,即可计算出心肌梗死面积百分比(IS/AAR%)。
1.7 统计学分析

2 实验结果
2.1 心肌梗死面积百分比(IS/AAR%)
A组心肌切片染色色泽对比度较低,心肌非梗死缺血区染色多呈灰红色,梗死区多呈现灰黄色,心肌非梗死缺血区和梗死区区分度较差,不便于计算机图形软件识别处理计算(图1A)。B组心肌切片染色色泽对比度较高,心肌非梗死缺血区染色多呈明显的砖红色,梗死区多呈现黄白色,心肌非梗死缺血区和梗死区区分度较好,便于计算机图形软件识别处理计算(图1B)。A组心肌梗死面积(48.69±5.37)%,B组心肌梗死面积(47.41±3.28)%;二组心肌梗死面积无统计学差异(P>0.05)。见图2所示。图1见彩插13。
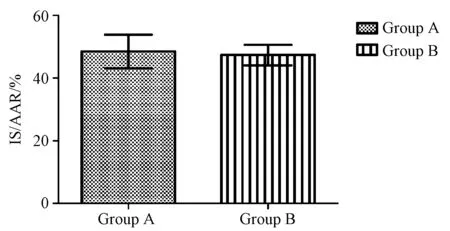
图2 心肌梗死面积百分比
2.2 血清cTnI浓度
A组血清cTnI浓度为(4.51±0.88)ng/mL,B组血清cTnI浓度为(4.70±0.71)ng/mL;二组血清cTnI浓度差异无统计学意义(P>0.05)。见图3。
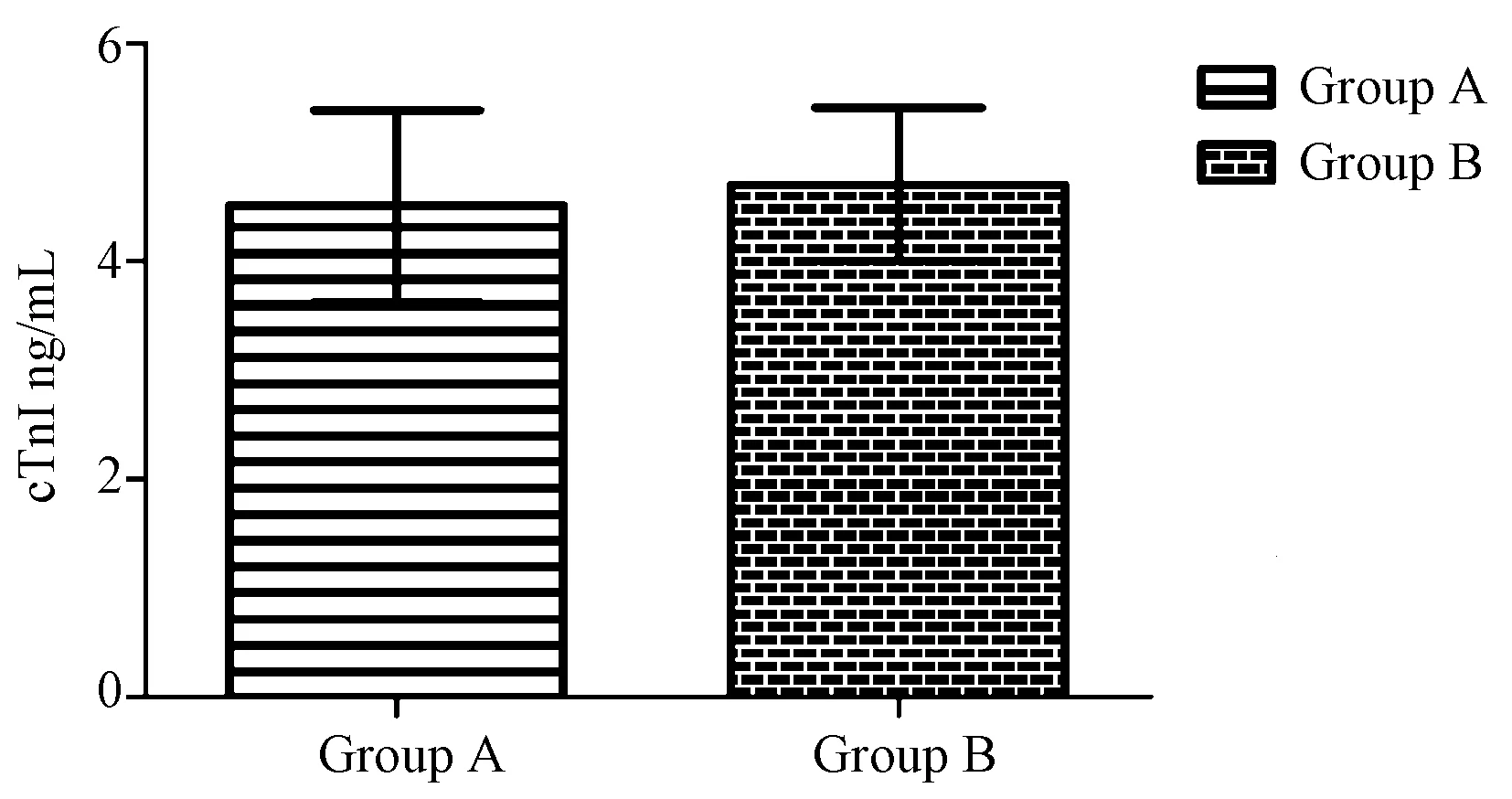
图3 大鼠血清cTnI浓度
3 讨论
氯化三苯基四氮唑(TTC) 染色是一种用来检测实验动物心脏梗死面积最常见的染色方法[12]。因其染色后颜色较易观察且灵敏性高而被广泛用于狗、大鼠、猫、猪的心肌或脑组织缺血模型梗死面积的评估[13-18]。其原理是TTC (2,3,5-氯化三苯基四氮唑)是生物呼吸链中吡啶核苷结核酶系统的质子受体,它与非梗死组织中的脱氢酶反应产生红色的甲臜(fromazan)[19],而梗死组织内脱氢酶活性下降,不能反应,故不会产生变化呈苍白色[20-21]。
以往文献[5,22]中的TTC心肌染色法通常为传统的染色法,其大致步骤为先进行Evans blue的心肌非缺血区染色并心肌取材,后在冰箱里速冻,然后再进行心肌切片,接着在37℃恒温的水浴箱内进行TTC染色,最后在放入甲醛溶液中固定。改进后的TTC染色方法则是先进行大鼠在体的心肌TTC染色,然后再进行Evans blue的染色,直接取心脏冷冻后切片,无需水浴步骤和甲醛固定。前者步骤为Evans blue染色—取心脏—心肌冷冻后切片—水浴和TTC染色—甲醛固定,而后者步骤为在体TTC染色和Evans blue染色—取心脏—心肌冷冻后切片,显然后者简单方便。
传统的染色法是利用37℃水浴模拟动物存活时的体温进行TTC染色。但是,水浴温度无法完全等同于动物存活时的体温,而且,在进行TTC染色前需要经过Evans blue染色和心肌速冻,可能使心肌中的脱氢酶部分失活,导致体外环境中脱氢酶活性通常难以达到在体的水平;另外,水浴只能通过TTC渗透心肌切片表面来反应,反应相对较慢,TTC染色过程容易受到已染的Evans blue染色剂的影响,还需要甲醛固定来增加染色对比度;此外,在冰冻后水浴过程中,心肌组织往往会过度皱缩导致不够平整。这些因素都影响了TTC染色的效果。改进后的TTC染色采用的是在体TTC染色,反应温度恒定,而且,先在体TTC染色后Evans blue染色和心肌速冻,不影响脱氢酶的水平和活性,TTC通过血液循环迅速地与活体心肌中的脱氢酶起反应,不受Evans blue染色剂的影响,提高了染色效果,也节约了大量的实验时间。本研究中可见,A组心肌切片染色色泽对比度较低,心肌非梗死缺血区染色多呈灰红色,梗死区多呈现灰黄色,心肌非梗死缺血区和梗死区区分度较差; B组心肌切片染色色泽对比度较高,心肌非梗死缺血区染色多呈明显的砖红色,梗死区多呈现黄白色,心肌非梗死缺血区和梗死区区分度较好。动物的心肌缺血再灌注实验往往会涉及到具有心肌保护作用的药物,而使用心肌保护药物处理后的动物,心肌梗死面积往往缩小,而且不同药物浓度梯度的亚组间梗死面积往往也有所不同但差异比较小。如果此时仍然采用传统TTC染色,往往因为染色效果不佳而影响各个药物亚组间的对比,增加实验误差,所以采用改进后的TTC染色法,可以提高药物各亚组染色效果,进一步减少实验误差。
血清cTnI是衡量大鼠心肌损伤的敏感性指标。本研究比较了A组和B组的血清cTnI,显示两组之间血清cTnI差异无统计学意义。可见改进后的TTC染色方法对大鼠的心肌损伤不影响,也间接说明了不同的TTC染色方法因其染色效果的好坏可以影响到实验结果的判定,甚至可能导致实验误差增大。
传统TTC染色由于需要进行心肌切片的浸没后的TTC水浴,所以通常需要10~20 mL的TTC溶液,而改进后的TTC染色法只要在体注射非常少量的TTC溶液即可,节约了TTC用量进而节约实验经费。
综上所述,改进后的心肌TTC染色法操作简便,节省了实验时间和经费,提高了染色效果,能更准确地反映心肌缺血再灌注损伤的程度,是一种经济、简便、快捷、高效的染色方法。
(本文图1见彩插13。)
[1] Musiolik J,van Caster P,Skyschally A,et al.Reduction of infarct size by gentle reperfusion without activation of reperfusion injury salvage kinases in pigs [J].Cardiovasc Res, 2010, 85(1):110-117.
[2] Ostadal B.The past, the present and the future of experimental research on myocardial ischemia and protection [J].Pharmacol Rep, 2009, 61(1):3-12.
[3] Gonon AT, Widegren U, Bulhak A, et al.Adiponectin protects against myocardial ischaemia-reperfusion injury via AMP-activated protein kinase, Akt, and nitric oxide [J].Cardiovasc Res, 2008, 78(1):116-122.
[4] Holmbom B, Naslund U, Eriksson A, et al.Comparison of triphenyltetrazolium chloride (TTC) staining versus detection of fibronectin in experimental myocardial infarction [J].Histochemistry, 1993, 99(4):265-275.
[5] 王波,李庆志, 阎德民, 等.不同2,3,5-氯化三苯基四氮唑染色方式对心肌梗死面积检测的对比 [J].中国胸心血管外科临床杂志, 2011,18(2):179-180.
[6] 刘丹妮, 马芹芹, 黄秀兰.健康大鼠及急性心肌缺血大鼠心电图表现 [J].医学研究杂志, 2010, 39(3):11-14.
[7] 何涛, 李海霄.健康大鼠胸导联心电图分析 [J].实用心电学杂志, 2010, 19(2):86-88.
[8] 王卓璎, 张雯, 李晓珍, 等.两种测定大鼠心肌缺血再灌注损伤后梗死面积方法的比较 [J].南京医科大学学报:自然科学版, 2011, 31(8):1101-1105.
[9] Zhan LY, Xia ZY, Xia F, et al.Effect of radix paeoniae rubra on expression of p38 MAPK/iNOS/HO-1 in rats with lipopolysaccharide-induced acute lung injury [J].Chin J Traumatol (Engl), 2007, 10(5):269-274.
[10] Yang J,Marden JJ,Chenguang Fan, et al.Genetic redox preconditioning differentially modulates AP-1 ad NFkappaB responses following cardiac ischemia/reperfusion injury and protects against necrosis and apoptosis [J].Mol Ther, 2003, 7(3): 341-353.
[11] 王燕, 胡慧媛, 赵美眯,等.TTC染色评价豚鼠离体心脏缺血/再灌注损伤梗死面积的适宜观察时间及计算方法 [J].中国医科大学学报, 2013, 42(2):160-164.
[12] Kakimoto Y, Tsuruyama T, Miyao M, et al.The effectiveness and limitations of triphenyl-tetrazolium chloride to detect acute myocardial infarction at forensic autopsy [J].Am J Forensic Med Pathol, 2013, 34(3):242-247.
[13] Dos Santos L, Mello AF,Antonio EL, et al.Determination of myocardial infarction size in rats by echocardiography and tetrazolium staining: correlation, agreements, and simplifications [J].Braz J Med Bid Res, 2008, 41(3):199-201.
[14] Xing YQ, Zhang Y,Li DQ, et al.Comparison of the veracity of real-time perfusion, harmonic angio, and ultraharmonic mocardial contrast imaging modes in evaluation of acute myocardial infarction area [J].Chin Med J (Engl), 2006, 119(3):179-184.
[15] Mdzinarishvili A, Geldenhuys WJ,Abbruscato TJ, et al.NGP1-01, a lipophilic polycyclic cage amine, is neuroprotective in focal ischemia [J].Neurosci Lett, 2005, 383(1-2):49-53.
[16] Veeravalli KK, Akula A, Kota MK, et al.Nitric oxide- and prostaglandin-mediated cardioprotection by bradykinin in myocardial ischemia and reperfusion injury [J].Pol J Pharmacol, 2003,55(6):1021-1029.
[17] Khalil PN, Siebeck M, Huss R, et al.Histochemical assessment of early myocardial infarction using 2,3,5- triphenyltetrazolium chloride in blood-perfused porcine hearts [J].J Pharmacol Toxicol Methods, 2006, 54(3):307-312.
[18] Okuno S, Nakase H, Sakaki T, et al.Comparative study of 2,3,5- triphenyltetrazolium chloride (TTC) and hematoxylin-eosin staining for quantification of early brain ischemic injury in cats [J].Neurol Res, 2001, 23(6):657-661.
[19] 师恩祎,江晓菁,白菡,等.吗啡预处理的晚期心肌保护作用及其与诱导型一氧化氮合酶的关系 [J].中华医学杂志, 2004, 84(11):891-895.
[20] Ferrera R, Benhabbooche S, Bopassa JC, et al.One hour reperfusion is enough to assess function and infarct size with 1rrC staining in Langendorff rat model [J].Cardiovasc Drugs Ther, 2009, 23(4):327-331.
[21] Bacaksiz A, Teker ME, Buyukpinarbasili N, et al.Does pantoprazole protect against reperfusion injury following myocardial ischemia in rats? [J].Eur Rev Med Pharmacol Sci,2013,17 :269-275.
