不同干预方法对去卵巢骨质疏松大鼠子宫GSK-3β蛋白表达的影响
2014-08-15郭盖卜淑敏韩天雨
郭盖,卜淑敏,韩天雨
(首都体育学院,北京 100191)
随着世界老龄化人口的增加,骨质疏松逐渐成为一个公众健康问题[1]。骨质疏松的特点是骨形成和骨吸收不平衡,不仅能引起骨质疏松性骨折,而且能引起慢性和急性背痛,结果使老年女性身心发生障碍、生活质量下降[2,3]。临床上通常采用的治疗绝经后骨质疏松的方法是激素替代疗法,但由于激素替代疗法具有增加患者患子宫内膜癌和血栓的副作用[4],迫使患者想采用其他副作用小的有效疗法。已知金雀异黄酮[5,6]、运动[7,8]和全身振动[9-14]等是近年来备受医务人员和患者青睐的几种抗骨质疏松方法,但就我们查阅文献所知,目前对这些治疗方法的副作用还了解较少。为了解全身垂直振动、跑台运动和金雀异黄酮等不同干预方法在防治绝经后骨质疏松的同时,所表现出的雌激素样副作用如何?本文在建立去卵巢骨质疏松大鼠模型的基础上,观察了跑台运动、全身振动、金雀异黄酮对去卵巢骨质疏松大鼠子宫重量指数、组织形态学和糖原合成激酶3β(GSK-3β)蛋白表达的影响,旨在为丰富绝经后骨质疏松的临床防治知识提供理论参考依据。
1 材料与方法
1.1 主要试剂和仪器
Genistein (Sigma, G-6649):17β-estradiol (Sigma, E-2758);Rabbit-P-GSK-3β抗体(#9336S:美国 Cell Signaling Technology);Rabbit-GSK-3β抗体(#9315S:美国 Cell Signaling Technology);马抗小鼠IgG/碱磷酶标记二抗、山羊抗兔Ig/G碱磷酶标记二抗和碱磷酶底物BCIP/NBT显色浓缩液:中杉金桥生物技术有限公司;RIPA蛋白裂解液和SDS-PAGE蛋白上样缓冲液:P0015,碧云天;DSPT-202振动台:北京雅士林生产;Kitman-T24型台式冷冻离心机:日本TOM公司;电泳仪:DYY-7C型,北京六一仪器厂。
1.2 实验动物手术与分组
3月龄雌性未孕SD大鼠72只,体重(260±12)g,由北京维通利华实验动物中心提供[SCXK (京)2011-0012]。自由饮水及进食,标准啮齿类动物饲料,分笼饲养。大鼠适应性喂养1周后,按体重分层后随机分为假手术(12只)和去卵巢手术(60只)两组。手术前,两组大鼠均禁食12~18 h, 腹腔注射10%水合氯醛(3 mL/kg)麻醉,手术组从背部切除双侧卵巢,假手术组不切除卵巢,而将卵巢旁与卵巢等大的脂肪组织切除。无菌手术在北京大学医学部实验动物科学部进行[SYXK(京)2011-0039],并按实验动物使用的3R原则给予人道的关怀。术后自由进食水,10周后按体重分层后将去卵巢手术组大鼠又随机分为去卵巢组(11只)、振动组(9只)、跑台组(9只)、金雀异黄酮组(10只)和雌激素组(9只)。实验过程中,去卵巢组12只因腹部粘连而于术后不同时间死亡。
1.3 不同干预方法处理方案
去卵巢11周时,各组大鼠先适应性处理1周,然后振动组大鼠每天进行2次15 min、频率90 Hz/min、7 次/周的振动治疗;跑台组大鼠每周进行4次45 min、速度18 m/min、跑道倾角5°的跑台训练;金雀异黄酮组每天按体重灌胃1次金雀异黄酮,剂量为1 mg/kg体重;雌激素组每周按体重颈部皮下注射3次17β-雌二醇,剂量为25 μg/kg体重。
1.4 组织样品的收集和处理
干预处理8周时,于末次处理结束36~48 h内,腹主动脉取血处死各组大鼠,用电子天平称量大鼠子宫的重量后,将左侧子宫投入4%的多聚甲醛溶液中固定,将右侧子宫在液氮中速冻后转入-80℃冰箱中。
1.5 HE染色
将固定好的子宫投入梯度酒精中脱水,常规石蜡包埋,进行组织切片(5 μm)。切片经二甲苯脱蜡、各级乙醇脱水、常规苏木素-伊红染色、中性树脂封片后,在显微镜下观察拍照。
1.6 Western blot
将提取的蛋白样品40 μg上样,以80 V电压,在10%的SDS-聚丙烯酰胺凝胶中分离约2 h后,以80 V电压转移2 h。在质量分数为5%脱脂奶粉室温封闭2 h,将PVDF膜与一抗4℃过夜,次日TBST洗3×10 min,分别加碱磷酶标记的二抗室温孵育2 h,TBST洗3×10 min,在BCIP/NBT显色液中显色至蓝色条带出现,放入水中终止显色,拍照,用Quantity One软件对各蛋白条带照片进行扫描,计算目的带灰度值与β-actin灰度值之比,作为该蛋白表达的相对值。
1.7 统计学处理
实验数据采用SPSS 19.0软件进行统计,结果以均值±标准差表示,进行单因素方差分析。P<0.05为差异有显著性。
2 结果
2.1 不同干预方法对去卵巢骨质疏松大鼠第5腰椎游离骨密度的影响
由图1可知,大鼠去卵巢后,第5腰椎游离骨密度显著下降,经雌激素和跑台运动处理后,第5腰椎游离骨密度显著增加,而经金雀异黄酮和全身垂直振动处理后,第5腰椎游离骨密度虽有所增加,但差异不显著。
2.2 不同干预方法对去卵巢骨质疏松大鼠体重和子宫重量指数的影响
由图2可知,大鼠去卵巢后,体重显著增加,经雌激素、金雀异黄酮、跑台和全身垂直振动处理后,体重均显著下降。
由图3可知,大鼠去卵巢后,子宫重量和子宫重量指数显著下降;经雌激素处理后,去卵巢大鼠子宫重量和子宫重量指数显著增加,而其他处理后均无显著变化。
2.3 不同干预手段对去卵巢骨质疏松大鼠子宫组织形态学的影响
由图4(彩插9)可知,与假手术组大鼠比较,去卵巢组大鼠子宫直径变细;与去卵巢大鼠比较,雌激素组大鼠子宫直径变粗,而金雀异黄酮、跑台组和振动组无显著变化。
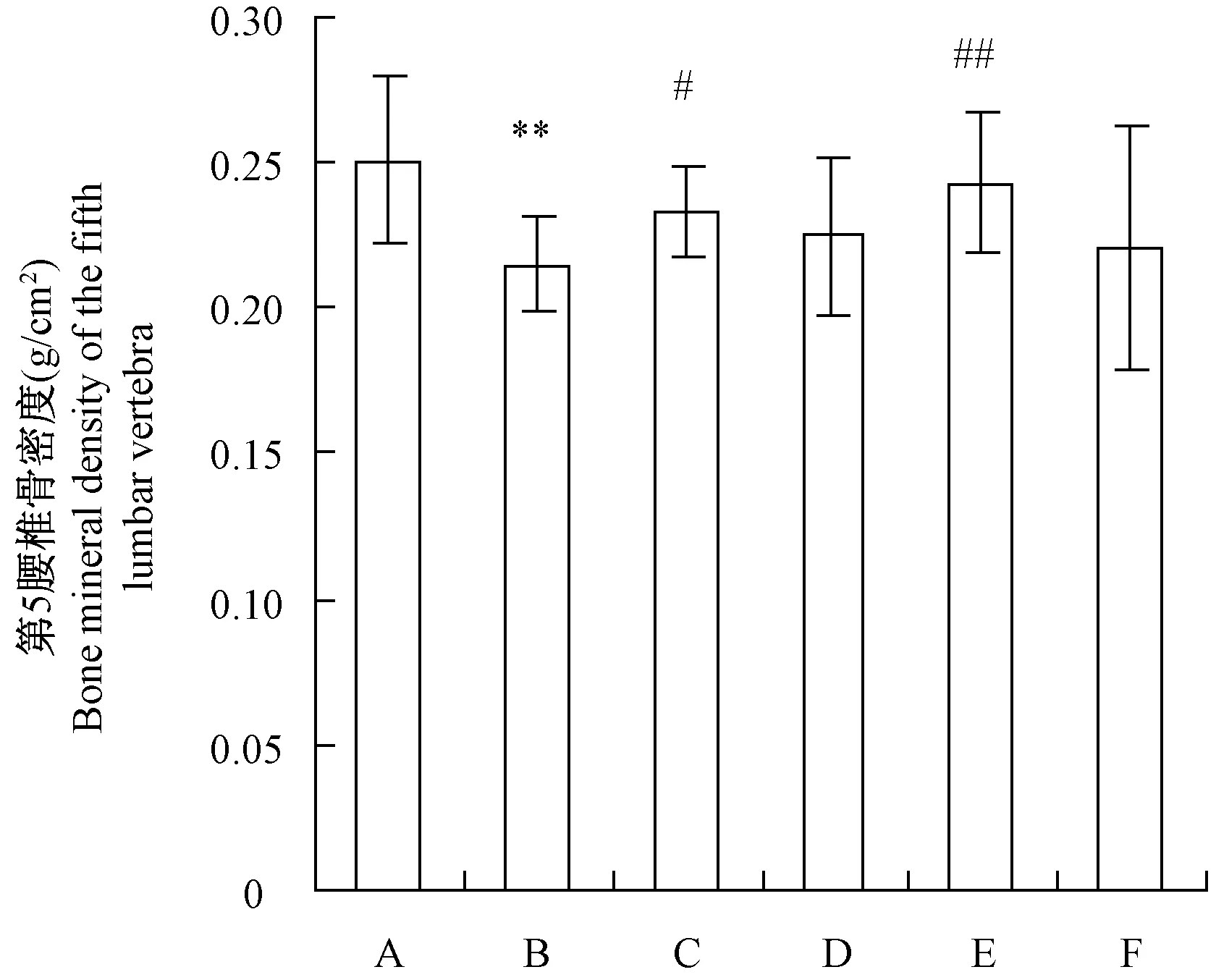
注:A,假手术组;B,去卵巢组;C,雌激素组;D,金雀异黄酮组;E,跑台组;F,振动组。下同。*P<0.05, **P<0.01与假手术组比较; #P<0.05, # #P<0.01与去卵巢组比较。
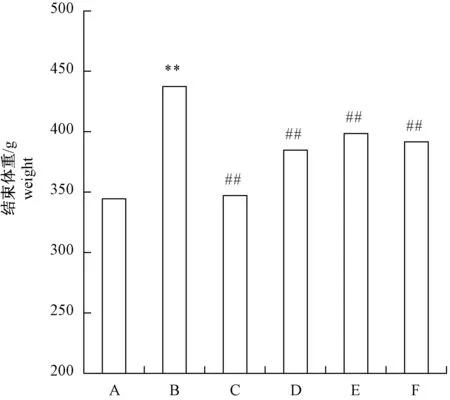
注:*P<0.05, **P<0.01与假手术组比较; #P<0.05, ##P<0.01与去卵巢组比较。
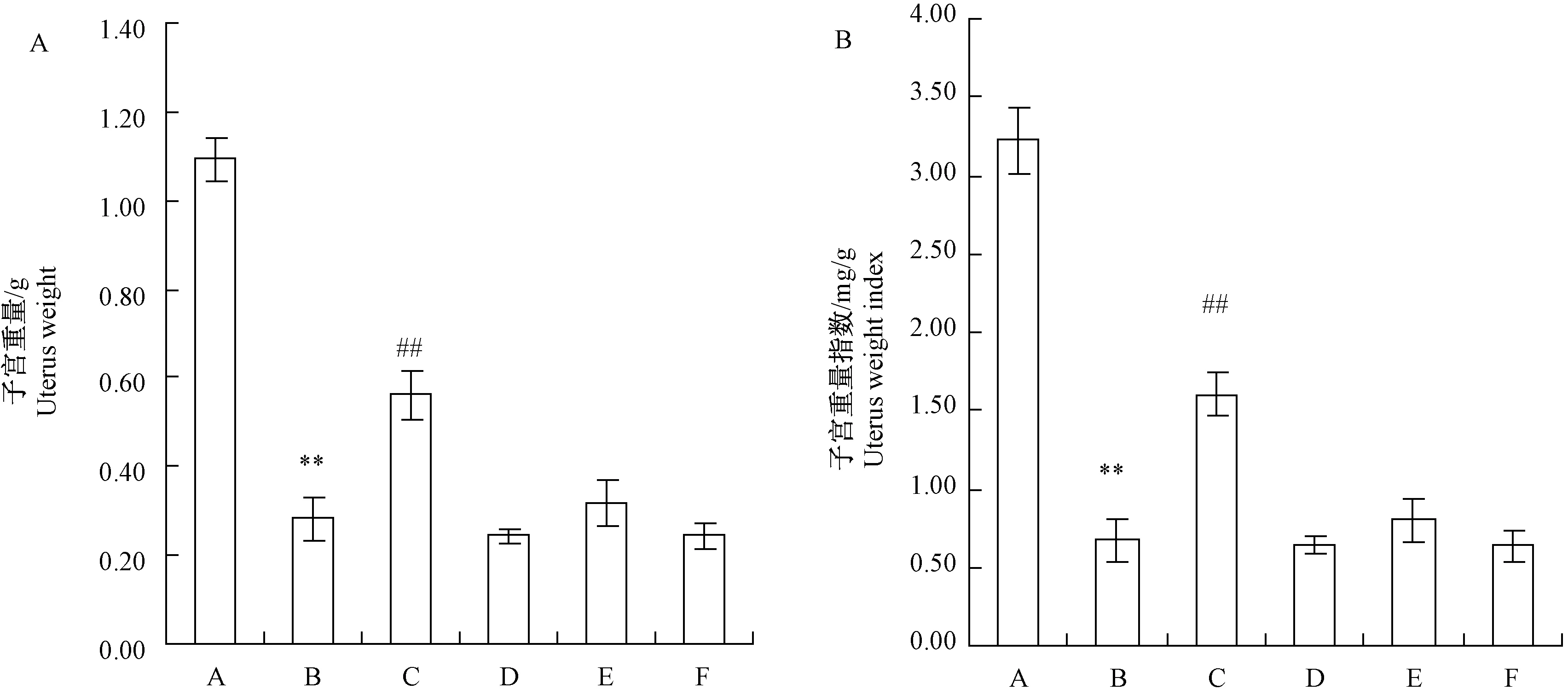
注:*P<0.05, **P<0.01与假手术组比较; #P<0.05, # #P<0.01与去卵巢组比较。A:子宫重量;B:子宫重量指数。
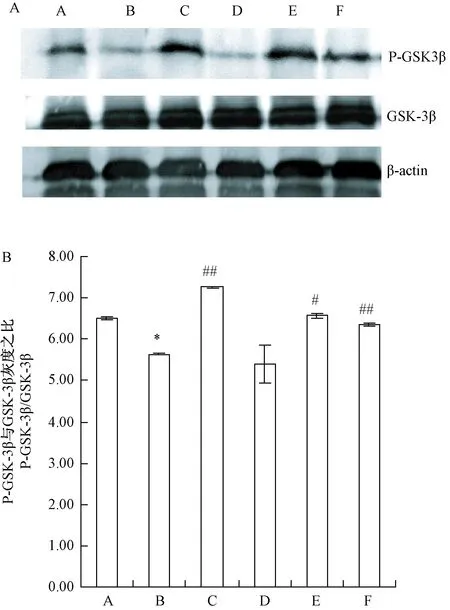
注:*P<0.05, **P<0.01与假手术组比较; # P<0.05,##P<0.01与去卵巢组比较。A: Western blot结果,β-actin作为内参;B: 6组样品P-GSK-3β/GSK-3β蛋白的相对表达量分析。
2.4 不同干预手段对去卵巢骨质疏松大鼠子宫GSK-3β蛋白表达的影响
由图5可知,大鼠去卵巢后,子宫P-GSK-3β/GSK-3β蛋白表达水平的比值显著下降。经雌激素、跑台和全身垂直振动处理后,去卵巢大鼠子宫P-GSK-3β/GSK-3β蛋白表达水平的比值显著增加,而经金雀异黄酮处理后,无显著变化。
3 讨论
女性绝经后,雌激素水平的下降会代偿性地引发向心性肥胖。本研究中,大鼠去卵巢后,体重显著增加,经雌激素、金雀异黄酮、跑台运动和全身垂直振动处理后,体重均显著下降。结果提示,雌激素、金雀异黄酮、跑台和振动处理均能显著抑制去卵巢大鼠体重的增加。提示,本实验选择的几种处理方案均具有降低去卵巢大鼠体重的效应,可见各种干预方法在体重干预方面是可行的。此外,本研究的结果还表明,金雀异黄酮降低去卵巢大鼠体重的效应要高于跑台运动和振动,但低于雌激素。
金雀异黄酮是大豆产物中的主要生理雌激素,逐渐增加的体内外研究表明[15],口服金雀异黄酮和骨健康正相关。金雀异黄酮不仅具有抗骨质疏松效应,而且具有雌激素样作用,是一种潜在的骨质疏松治疗药物方法。近年来,低强全身振动训练已成为一种新的有效的骨质疏松治疗方法[9]。很多研究已表明[10-15],经全身振动的机械刺激有益于骨量的维持和增加。更有Florencio-Silva等报道[16],机械振动提高骨质量的效应要高于大豆异黄酮。本研究中,大鼠去卵巢后,第5腰椎游离骨密度显著下降,经雌激素和跑台运动处理后,第5腰椎游离骨密度显著增加,而经金雀异黄酮和全身垂直振动处理后,第5腰椎游离骨密度虽有所增加,但差异不显著。结果提示,跑台运动减缓去卵巢大鼠第5腰椎骨密度下降的效应要高于全身垂直振动。这可能与两种处理方式施加于大鼠的力学负荷不同有关。因为大鼠在跑台上跑步时,腰部肌肉的主动运动可直接牵拉腰椎,而大鼠在振动台上接受被动振动刺激时,振动刺激是通过四肢传到腰部,可能腰椎受到的机械刺激要小于四肢。可见,如果骨质疏松患者想要改善腰部骨量时,最好选用跑台运动。此外,本研究的金雀异黄酮不能改善去卵巢骨质疏松大鼠腰椎骨量的结果与Turner等[17]报道得结果相似,即每天口服1次金雀异黄酮不能改善绝经后骨量丢失大鼠模型胫骨的骨量。
金雀异黄酮是很多细胞的调节因子。Matsukura等[18]报道,金雀异黄酮能促进大鼠子宫内膜细胞的增殖。本研究中,大鼠去卵巢后,子宫重量和子宫重量指数显著下降,子宫直径变细;经雌激素处理后,子宫重量显著增加,子宫直径变粗,而经金雀异黄酮、跑台和振动处理后,不仅子宫重量和子宫重量指数无显著增加,而且子宫直径也未发生显著变化。结果提示,本研究选择的金雀异黄酮、跑台和全身振动处理方案,均不具有雌激素处理的增加去卵巢大鼠子宫重量和增大子宫直径的副作用。
在妇女,导致无节制的雌激素刺激的状态与月经不调以及子宫内膜增生和子宫内膜癌有关[19]。GSK-3β是一种丝氨酸/苏氨酸激酶,依据不同底物能精确调控多个信号路, 参与调节正常细胞的生存及肿瘤发生与发展。虽然GSK-3β是众多恶性肿瘤中的关键激酶,但其作用究竟是抑癌还是促癌,目前仍然存在争议[20]。GSK-3β在通常情况下是持续有活性的,是许多信号通路的关键成员。但当GSK-3β磷酸化后,能抑制其自身激酶活性[21]。Teixeira等[22]报道,大豆异黄酮能增加去卵巢大鼠子宫的抗氧化状态,抑制其氧化应激。Francisco等[23]报道,大豆异黄酮具有营养去卵巢大鼠子宫的效应。我们前期的研究表明[24],不像雌激素处理,跑台运动不能刺激去卵巢大鼠子宫GSK-3β的磷酸化。本研究中,大鼠去卵巢之后,子宫P-GSK-3β/GSK-3β蛋白表达比值显著下降。经雌激素、跑台、振动处理后,去卵巢大鼠子宫P-GSK-3β/GSK-3β蛋白表达比值均显著增加,而经金雀异黄酮处理后,P-GSK-3β/GSK-3β蛋白表达比值无显著变化。结果提示,雌激素、跑台和振动干预可以刺激去卵巢大鼠子宫GSK-3β蛋白的磷酸化,而金雀异黄酮处理无此效应。可见,和雌激素处理相似,跑台和振动干预能抑制去卵巢大鼠子宫GSK-3β的活性,而金雀异黄酮却不能。和前期研究相比,前期实验设计为大鼠去卵巢后静养1周就开始进行跑台运动处理,而本研究是在静养10周后才进行跑台运动处理,这是否是两次研究得出的结果不一致的原因,还有待实验进一步证实。此外,至于金雀异黄酮处理是没有刺激去卵巢大鼠子宫GSK-3β蛋白的磷酸化效应呢?还是给予的剂量不合适呢?也有待实验进一步探讨。
本研究的结果表明,金雀异黄酮降低去卵巢大鼠体重的效应大于跑台运动和全身振动,但其对去卵巢大鼠骨量的改善效应和对GSK-3β的磷酸化效应要低于跑台运动。另外,跑台运动降低去卵巢大鼠骨量的效应要大于全身垂直振动。金雀异黄酮、跑台运动和全身振动处理均没有雌激素处理增加去卵巢大鼠子宫重量的副作用。
(本文图4见彩插9)。
[1] Rosales-Aujang E, Muoz-Enciso JM, Arias-Ulloa R.Prevalence of osteopenia and osteoporosis in postmenopausal women and its relation to risk factors [J].Ginecol Obstet Mex.2014, 82 (4): 223-228.
[2] Reid IR.Should we prescribe calcium supplements for osteoporosis prevention?[J] J Bone MeTab.2014, 21 (1): 21-28.
[3] de Waure C, Specchia ML, Cadeddu C, et al.The prevention of postmenopausal osteoporotic fractures: results of the health technology assessment of a new antiosteoporotic drug [J].Biomed Res Int.2014, 975927.16 pages.
[4] Sanders S1, Geraci SA.Osteoporosis in postmenopausal women: considerations in prevention and treatment: (women′s health series) [J].South Med J, 2013, 106(12):698-706.
[5] Atteritano M, Mazzaferro S, Bitto A, et al.Genistein effects on quality of life and depression symptoms in osteopenic postmenopausal women: a 2-year randomized, double-blind, controlled study [J].Osteoporos Int.2014, 25 (3):1123-1129.
[6] Miao Q1, Li JG, Miao S, et al.The Bone-protective effect of genistein in the animal model of bilateral ovariectomy: roles of phytoestrogens and PTH/PTHR1 against post-menopausal osteoporosis [J].Int J Mol Sci.2012, 13(1):56-70.
[7] Roghani T, Torkaman G, Movasseghe S, et al.Effects of short-term aerobic exercise with and without external loading on bone metabolism and balance in postmenopausal women with osteoporosis [J].Rheumatol Int, 2013, 33(2):291-298.
[8] Bu S, Chen Y, Wang S, et al.Treadmill training regulates β-catenin signaling through phosphorylation of GSK-3β in lumbar vertebrae of ovariectomized rats [J].Eur J Appl Physiol, 2012, 112 (9):3295-3304.
[9] Rubin C, Judex S, Qin YX.Low-level mechanical signals and their potential as a non-pharmacological intervention for osteoporosis [J].Age Ageing, 2006, 35:ii32-ii36.
[10] Rubin C, Recker R, Cullen D, et al.Prevention of postmenopausal bone loss by a low-magnitude, high-frequency mechanical stimuli: A clinical trial assessing compliance, efficacy, and safety [J].J Bone Miner Res, 2004, 19:343-351.
[11] Gilsanz V, Wren TA, Sanchez M, et al.Low-level, high-frequency mechanical signals enhance musculoskeletal development of young females with low BMD [J].J Bone Miner Res, 2006, 21:1464-1474.
[12] Chen GX, Zheng S, Qin S, et al.Effect of low-magnitude whole-body vibration combined with alendronate in ovariectomized rats: a random controlled osteoporosis prevention study [J].PLoS ONE, 2014, 9(5):e96181.
[13] Kotel′nikov GP, Piatin VF, Bulgakova SV, et al.Whole body vibration (acceleration) training increases bone mineral density and serum levels of osteocalcin in elderly women [J].Adv Gerontol, 2010, 23(2):257-262.
[14] Turner S, Torode M, Climstein M, et al.A randomized controlled trial of whole body vibration exposure on markers of bone turnover in postmenopausal women [J].J Osteoporos, 2011, 2011:710387.
[15] Miao Q1, Li JG, Miao S, et al.The bone-protective effect of genistein in the animal model of bilateral ovariectomy: roles of phytoestrogens and PTH/PTHR1 against post-menopausal osteoporosis[J].Int J Mol Sci.2012, 13 (1): 56-70.
[16] Florencio-Silva R, Santos MA, de Medeiros VP, et al.Effects of soy isoflavones and mechanical vibration on rat bone tissue [J].Climacteric, 2013, 16(6):709-717.
[17] Turner RT, Iwaniec UT, Andrade JE, et al.Genistein administered as a once-daily oral supplement had no beneficial effect on the tibia in rat models for postmenopausal bone loss [J].Menopause, 2013, 20 (6):677-686.
[18] Matsukura H, Aisaki K, Igarashi K, et al.Genistein promotes DNA demethylation of the steroidogenic factor 1 (SF-1) promoter in endometrial stromal cells [J].Biochem Biophys Res Commun, 2011, 412 (2):366-372.
[19] 梁家仪, 李长东, 张为远.Wnt/β-连环蛋白信号通路的激活/抑制对小鼠在位子宫内膜及子宫内膜异位症模型的影响.中华医学杂志 2012, 92 (19):1352-1356.
[20] Zeng J, Liu D, Qiu Z, et al.GSK3β overexpression indicates poor prognosis and its inhibition reduces cell proliferation and survival of non-small cell lung cancer cells [J].PLos ONE, 2014, 9(3):e91231.
[21] Jope RS, Johnson GV.The glamour and gloom of glycogen synthase kinase-3 [J].Trends Biochem Sci, 2004, 29:95-102.
[22] Teixeira CP, Simões RS, Santos MA, et al.Soybean concentrated extract counteracts oxidative stress in the uterus of rats [J].Climacteric, 2014, 17(4):402-409.
[23] Francisco AM, Carbonel AF, Simões RS, et al.Do extracts of oral soybean augment the trophic effect of estrogen on the rat uterus? [J].Climacteric, 2013,16(1):161-168.
[24] Bu S, Chen Y, Wang S, et al.Treadmill training regulates β-catenin signaling through phosphorylation of GSK-3β in lumbar vertebrae of ovariectomized rats [J].Eur J Appl Physiol, 2012, 112 (9):3295-3304.
