抑制T细胞增殖的抗CD45单克隆抗体的建立
2014-08-15苏泽红李亚林谭翔文余坚刘鑫袁月亲练高建
苏泽红,李亚林,谭翔文,余坚,刘鑫,袁月亲,练高建
(1.南华大学实验动物学部, 湖南 衡阳 421001;
2.南华大学药学与生物科学学院,湖南 衡阳 421001)
CD45,又可称之为B220、CD45R、CD45RA、CD45RB、CD45RC、EC3.1.3.48、LCA、T200、Ly5和PTPRC。 Trowbridge等[1]研究表明CD45 CD45RO是白细胞表面共同抗原(leukocyte common antigen,LCA),在所有白细胞上都有表达,并且已经证实在各种不同的哺乳动物,鸡、鲨鱼及红鳍东方豚中,都有CD45同系物存在。CD45是一种表达在所有有核造血细胞及其前体表面均有表达的I型转膜分子。Fellberg等[2,4]研究证实,CD45参与多种免疫功能,尤其对细胞信号转导、淋巴细胞生长、发育和活化具有重要的调节作用。Johnson等[3,5]研究证实,CD45是细胞膜上信号传导的关键分子,在淋巴细胞的发育成熟,功能调节及信号传递中具有重要意义。但CD45是否在T细胞增殖过程中发挥作用,迄今未见相关报道。
我们使用来源于BALB/c小鼠骨髓的树突状细胞对大鼠进行免疫,然后得到许多可以识别T细胞或树突状细胞的杂交瘤细胞,其中一株杂交瘤细胞分泌的抗体对CD4+和CD8+T细胞增殖有最强的抑制作用。对其进行的更进一步的分析,表明该杂交瘤所分泌的抗体的目标分子是CD45。T细胞的异常增殖在自身免疫性疾病如1型糖尿病、类风湿性关节炎等的发生发展中起着重要的作用。基于此,有必要深入研究抗CD45单克隆抗体是否能预防治疗一些与T细胞异常增殖诱导的相关疾病。
1 材料与方法
1.1 动物及细胞
6~8周龄BALB/c小鼠10只,南华大学实验动物学部自繁自养【SCXK(湘)2010-0004】;6~8周龄Wistar 大鼠9只,购自南方医科大学实验动物中心【SCXK(粤)2011-0015】,均为雌性,饲养于南华大学SPF级动物房【SYXK(湘)2010-0006】。SP2/0骨髓瘤细胞系,293T细胞系,均购自武汉博士德生物工程有限公司。
1.2 试剂
完全及不完全RPMI-1640培养液,聚乙二醇(PEG1500),HAT培养液,均购自Sigma公司。小鼠抗大鼠IgG抗体,蛋白G琼脂糖,银染试剂盒,均购自武汉博士德生物工程有限公司。
1.3 免疫程序及融合
参见参考文献[9]。
1.4 增殖反应实验
收集BALB/c小鼠脾脏制备细胞悬液。离心后加入CFSE溶液(9000倍稀释)于37℃水浴锅遮光培养15 min,1500 r/min 4℃离心5min,然后用PBS 1500 r/min 4℃离心5 min,清洗2次,最后加入RPMI培养液和抗CD3单克隆抗体(1∶1000),并将细胞转移至24孔培养板,CO2培养箱培养3 d,收集细胞,流式细胞仪检测结果。
1.5 Western blot
从BALB/c小鼠收集脾细胞,加入裂解缓冲液作用约15 min,然后离心收集上清,经10% SDS聚丙烯酰胺凝胶电泳90 min,再以150 mA电流持续转膜60 min,将凝胶上的蛋白质转移到PVDF膜上。加封闭液封闭1 h后加入一抗(1∶10),4℃孵育过夜。过夜后复温至室温,0.1% PBST缓冲液洗膜5 min × 3次,加入二抗(1∶1000),37℃孵育45 min,再用0.1% PBST缓冲液洗膜5 min × 3次,最后用PBS洗15 min。加入等比例的化学发光试剂A和B后,直接在成像仪进行显影与采图。
1.6 免疫共沉淀实验
参见参考文献[9]。
1.7 细胞转染实验
使用GeneJuice (Merck公司)转染试剂,分别将pcDNA3.1空白载体或pcDNA3.1装载小鼠CD45cDNA后转染293T细胞,然后用博来霉素处理得到稳定的CD45表达细胞。
本文中所有实验均重复3次以上。
2 结果
2.1 建立有效抑制CD4+和CD8+ T细胞增殖的单克隆抗体
收集纯化BALB/c小鼠骨髓树突状细胞,腹腔注射免疫Wistar大鼠,获得大量能够识别小鼠树突状细胞或T细胞的杂交瘤细胞系。细胞增殖反应实验得到很多株具有抑制CD4+和CD8+T细胞增殖效果的杂交瘤细胞系,其中一株对CD4+和CD8+T细胞增殖具有最强的抑制效果(图1,彩插3),我们将其命名为F3-6,对其进行深入研究揭示其目标分子。
2.2 Western blot 检测F3-6识别的目标蛋白
如图2所示,与F3-6反应的泳道内在约250×103处出现一条特异性的蛋白条带,而对照抗体Rat IgG的泳道内则没有出现蛋白条带。

图2 F3-6 识别的目标蛋白位于约250×103处(C:对照IgG抗体)
2.3 单克隆抗体识别的目标分子
将从BALB/c小鼠收集的全脾细胞的裂解液与F3-6单克隆抗体进行免疫共沉淀反应,然后将其转移到凝胶上进行电泳。电泳后的凝胶进行银染,结果表明,目标带位于约250×103(图3A)。对切割后的目标带进行液相色谱质谱联用技术分析,显示F3-6单克隆抗体识别的目标分子为CD45;为进一步验证F3-6单克隆抗体识别CD45分子,我们分别用空白载体或装载有小鼠CD45的cDNA的载体转染293T细胞,然后与我们制备的F3-6单克隆抗体进行反应,再与PE-连接的抗大鼠IgG抗体反应,流式细胞仪检测结果显示,在过表达CD45的293T细胞系中,出现与F3-6反应的阳性结果(图3B)。上述结果表明,F3-6单克隆抗体识别小鼠CD45。
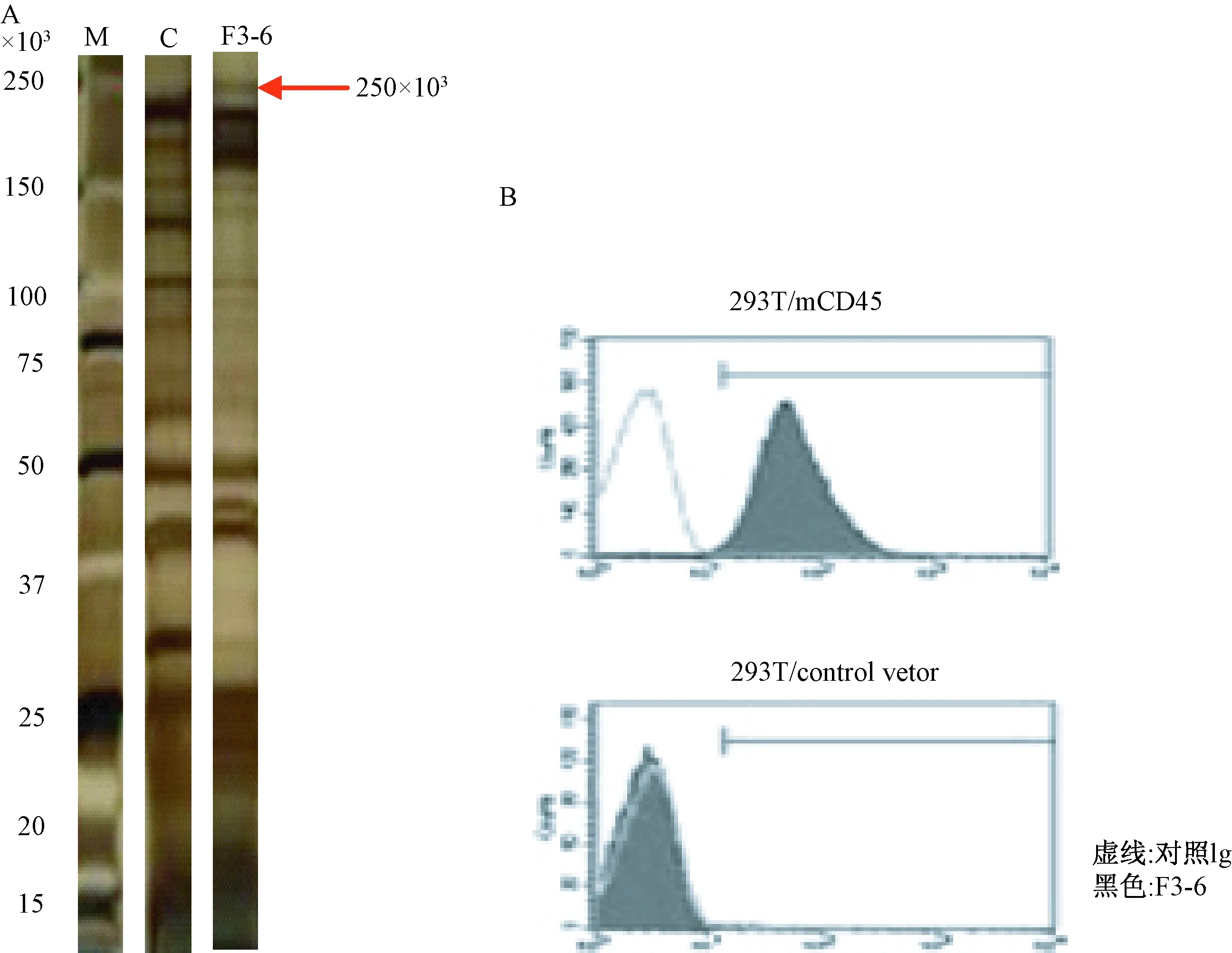
图3 F3-6识别CD45(目标带位于约250×103处)(C:对照IgG抗体)
3 讨论
CD45,又可称之为B220、CD45R、CD45RA、CD45RB、CD45RC、CD45RO、EC3.1.3.48、LCA、T200、Ly5和PTPRC。 是白细胞表面共同抗原(leukocyte common antigen, LCA),在所有白细胞上都有表达,并且已经证实在各种不同的哺乳动物、鸡、鲨鱼及红鳍东方豚中,都有CD45同系物存在。Thomas等[6]的研究表明CD45是一种在所有有核造血细胞及其前体表面均有表达的I型转膜分子。Trowbridge等[1]研究证实,在各种不同的哺乳动物、鸡、鲨鱼及红鳍东方豚中,都有CD45同系物存在。还有研究表明,在T细胞及B细胞中,多达10%的细胞表面区域由CD45组成。CD45参与多种免疫功能,尤其对细胞信号转导、淋巴细胞生长、发育和活化具有重要的调节作用。Byth等[13-16]在应用CD45突变细胞系和CD45缺陷小鼠所做的实验中证实, 在淋巴细胞活化所必需的T细胞抗原受体(TCR)和B细胞抗原受体(BCR)所介导的信号通路中, CD45起着关键的正调节作用。CD45由一类结构相似,分子量较大的跨膜蛋白组成,广泛存在于白细胞表面,是细胞膜上信号传导的关键分子,在淋巴细胞的发育成熟,功能调节及信号传递中具有重要意义[2-4]。Western blot和免疫共沉淀结果表明,我们所构建的单克隆抗体,目标带位于约250×103处。液相色谱质谱联用技术分析及细胞转染结果表明其目标分子为CD45。同时,细胞增殖实验表明,抗CD45单克隆抗体能有效抑制CD4+和CD8+T细胞增殖,提示CD45在T细胞的增殖过程中发挥关键作用,但CD45究竟以何种方式经何种途径对T细胞的增殖发挥有效抑制作用仍需进行进一步的研究予以阐明。
很多实验结果证实,以T细胞介导为主的自身免疫性疾病中,如自身免疫性甲状腺病,类风湿性关节炎等,自身反应性T细胞直接参与其中,作为效应细胞识别和攻击带有特异自身抗原的靶细胞所引发[7,8]。T细胞表面表达有大量的共刺激分子,如CD3、CD98等,对T细胞的增殖、功能分化及存活起着正调或负调作用[9]。大量的研究证实[10,11]对这些共刺激分子的作用进行修饰可以有效的调节T细胞功能,并且研究人员已经从这些实验研究中开发出大量的试剂,比如以共刺激分子受体或配基为作用目标的单克隆抗体或者重组的可溶性配基,用于T细胞介导的自身免疫性疾病的治疗。
本文所构建的抗CD45单克隆抗体,能有效地抑制CD4+和CD8+T细胞增殖,我们将对其进行更深入的研究,探索其对T细胞介导的自身免疫性疾病的预防和治疗作用,为将来的临床应用打下坚实的基础。
(本文图1见彩插3。)
[1] Trowbridge IS, Thomas ML.CD45: an emergeing role as a protein tyrosine phosphatase required for lymphocyte activation and development [J].Annu Rev Immunol.1994, 12:85-116.
[2] Fellberg J, Johnson P.Characterization of recombinant CD45 cytoplasmic domain proteins.Evidence for intramolecular and intermolecular interactions [J].J Biol Chem.1998, 273:17839-17845.
[3] Johnson P, Fellberg J.CD45: a key regulator of Lck and T cell activation [J].Mod Asp Immunolbiol.2001, 1:147-151.
[4] Yanagi, S, Sugawara H, Kurosaki M, et al.CD45 modulates phosphorylation of both autophosphorylation and negative regulatory tyrosines of Lyn in B cells [J].J Biol Chem.1996, 271:30487-30492.
[5] Veillette A, Bookman MA, Horak EM, et al.The CD4 and CD8 T cell surface antigens are associated with the internal membrane tyrosine-protein kinase p56lck [J].Cell, 1988, 55:301-308.
[6] Thomas ML.The leukocyte common antigen family [J].Annu Rev Immunol.1989, 7:339-369.
[7] Hu C, Ding H, Zhang X, et al.Combination treatment with anti-CD20 and oral anti-CD3 prevents and reverses autoimmune diabetes [J].Diabetes, 2013, 62(8):2849-2858.
[8] Chung DT, Richard J, Ruzek M, et al.Anti-thymocyte globulin (ATG) prevents autoimmune encephalomyelitis by expanding myelin antigen-specific Foxp3+regulatory T cells [J].Int Immunol.2007, 19:1003-1010.
[9] 练高建, 吴端生, 苏泽红, 等.抑制T细胞增殖的抗CD98重链单克隆抗体的建立 [J].中国实验动物学报, 2013, 21(2):64-67.
[10] Wang H, Hosiawa KA, Garcia B, et al.Attenuation of acute xenograft rejection by short-term treatment with LF15-0195 and monoclonal antibody against CD45RB in a rat-to-mouse cardiac transplantation model [J].Transplantation, 2003, 75(9):1475-1481.
[11] Lian G, Arimochi H, Kitamura A, et al.Manipulation of CD98 resolves type 1 diabetes in nonobese diabetic mice [J]. J Immunol, 2012, 188(5):2227-2234.
