大孔树脂纯化榛子壳棕色素粗提液的研究
2014-07-25姚丽敏王金玲
姚丽敏,旷 慧,张 龙,常 晨,龙 雪,王金玲,王 萍,赵 鑫
(东北林业大学林学院,黑龙江哈尔滨 150040)
榛子是著名的四大坚果之一。在我国东北、华北、西南横断山及西北、内蒙古均有大量野生榛林分布。近几年,人工栽培面积不断扩大,仅辽宁省铁岭市2008年就栽植人工榛林70多万亩。目前东北地区榛子的年产量1亿公斤左右,其中大于80%的榛子作为辅料被广泛用于巧克力、焙烤等食品行业。其加工、食用后的废弃物——榛子壳除少部分作为制造活性炭的原料以外[1-2],并没有得到充分的利用[3]。榛子壳中富含类黄酮棕色素[4],具有抗衰老、降脂、美容、养颜等重要的生理活性功能[5-8],备受食品、药品、化妆品等行业青睐,是国内外公认作为替代合成色素的资源。近年来,对榛子壳棕色素的提取、稳定性及抗氧化性的研究已有报道[9-11],但对于榛子壳棕色素的纯化工艺方面研究较少。
本文旨在通过研究大孔树脂对榛子壳棕色素的纯化,筛选出最佳树脂及得出最佳纯化工艺,为榛子壳棕色素开发生产提供了一定的参考,为不断壮大的榛子加工业提供棕色素纯化工艺和新的发展方向。
1 材料与方法
1.1 材料与仪器
榛子 购自伊春市五营林业局;手工去仁 榛子壳烘干粉碎,备用;无水乙醇、氢氧化钠、盐酸 均为国产分析纯;大孔树脂:D101、D4020、AB-8、X-5、NKA-9 购自哈尔滨盛达生化仪器公司。
ALC-1104分析天平 北京赛利多斯仪器系统有限公司;恒温水浴锅 上海博迅实业有限公司医疗设备厂;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;UV-1200紫外可见分光光度计 上海精密科学仪器有限公司;FWl00万能粉碎机 天津泰斯特仪器有限公司;DFC-6053真空干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 榛子壳棕色素粗提液的制备 参照文献[12]制得榛子壳棕色素粗提液。
1.2.2 色素吸收波长的确定 根据分光光度法,将色素的粗提液在200~500nm区间进行扫描,确定色素吸收波长。
1.2.3 最佳树脂的筛选
1.2.3.1 静态吸附效果比较 分别称取2g预处理[13]后的D101(非极性)、D4020(非极性)、X-5(弱极性)、AB-8(弱极性)、NKA-9(极性)树脂于250mL锥形瓶中,加入5mL色素粗提液。每隔30min测定其上层溶液的吸光值,绘制不同型号树脂对榛子壳棕色素的吸附曲线。
1.2.3.2 静态解吸效果比较 分别称取2g预处理后的D101、D4020、AB-8、X-5、NKA-9树脂于250mL锥形瓶中,加入5mL色素粗提液,振荡使其充分吸附。吸附饱和后,弃去上层溶液,加入5mL 70%乙醇[14]溶液,每隔30min测定其上层溶液的吸光值,绘制不同型号树脂对榛子壳棕色素的解吸曲线。
1.2.4 D101树脂静态实验
1.2.4.1 样液pH对吸附效果的影响 称取7份质量为2.0g的树脂于250mL锥形瓶中,分别添加pH=2、3、4、5、6、7、8的榛子壳棕色素粗提液5mL,每隔30min测定其上层溶液的吸光值,绘制D101对不同pH的榛子壳棕色素粗提液的吸附曲线,计算其吸附率[15-16],公式如下:
吸附率(%)=[A0(吸附前)-A(吸附后)]/A0(吸附前)×100
1.2.4.2 样液稀释倍数对吸附效果的影响 称取6份质量为2.0g的树脂于250mL锥形瓶中,分别添加稀释倍数为5、10、15、20、25、30倍的榛子壳棕色素粗提液5mL(原样液浓度为750mg/mL),每隔20min测定其上层溶液的吸光值,绘制D101对不同稀释倍数的样液的吸附曲线并计算其吸附率。
1.2.4.3 乙醇浓度对解吸效果的影响 称取5份质量为2.0g的树脂于250mL锥形瓶中,加入5mL浓度为30mg/mL的样液,待其吸附饱和后,弃去上层溶液;分别加入5mL浓度为50%、60%、70%、80%、90%乙醇溶液,将其放入摇床中振荡24h,使其充分解吸,测定其吸光值,比较其解吸效果。
1.2.5 D101树脂动态实验
1.2.5.1 上样流速对吸附效果的影响 用充分活化的树脂装柱(3cm×50cm)于26cm处,将100mL浓度为30mg/mL榛子壳棕色素粗提液分别以1.0、1.5、2.0、2.5、3.0mL/min的流速上样。收集流出液,每管5mL,直至流出液吸光值为上柱液的10%(泄漏点)[17-18],即认为树脂吸附饱和,绘制树脂在不同上样流速下对榛子壳棕色素粗提液的吸附曲线。
1.2.5.2 上样体积对吸附效果的影响 用充分活化的树脂装柱(3cm×50cm)于26cm处,以2mL/min分别加入70、90、110、130、150mL浓度为30mg/mL色素粗提液,小管收集流出液,每管5mL,直至流出液吸光值为上柱液的10%(泄漏点),即认为树脂吸附饱和,绘制树脂对色素的吸附曲线。
1.2.5.3 洗脱流速对解吸效果的影响 用充分活化的树脂装柱(3cm×50cm)于26cm处,将110mL浓度为30mg/mL的样液以2mL/min的流速上样。待树脂吸附饱和后,用70%的乙醇溶液分别以流速1.0、1.5、2.0、2.5、3.0mL/min进行解吸,绘制解吸曲线。
1.2.6 色价的测定 将纯化前后的色素浓缩液分别于50℃[19]烘箱中干燥,得到粉末状的榛子壳棕色素。测定色素的色价,公式如下[20]:

式中,A为吸光度;W为100mL被测溶液中所含样品的质量(g);R为100mL溶液稀释至上机测试的稀释倍数表示样品浓度为1%,1cm比色皿测得的色价值。
1.2.7 洗脱率的计算 洗脱率计算公式如下[21]:洗脱率(%)=C×V(/C0×V0)×100。
式中,C和V分别为洗脱液中榛子壳棕色素的质量浓度(mg/mL)和体积(mL);C0和V0分别为吸附前溶液中榛子壳棕色素的质量浓度(mg/mL)和体积(mL)。
1.2.8 数据处理与分析 每个实验3次重复,数据以平均值±标准差显示,数据采用Excel软件进行分析处理。
2 结果与分析
2.1 榛子壳棕色素吸收波长的测定
波长扫描曲线如图1所示。

图1 光谱扫描曲线Fig.1 The curve of spectral scanning
在200~500nm的波长范围内对提取液进行扫描,在235nm处有最大吸收,因此本实验选择235nm为测定波长。
2.2 最佳树脂的筛选
2.2.1 不同型号树脂对榛子壳棕色素的静态吸附 考察不同型号树脂在不同时间段对榛子壳棕色素的静态吸附的影响,其结果见图2。
由图2可知,在120min时,D4020对榛子壳棕色素的吸附趋于饱和,在200min时,树脂AB-8和X-5对榛子壳棕色素的吸附趋于饱和,在240min时,树脂NKA-9及D101对榛子壳棕色素的吸附趋于饱和。在200min之后,上清液的吸光值大小顺序为:X-5>NKA-9>D4020>D101>AB-8,由此可见,AB-8大孔树脂对榛子壳棕色素的吸附效果最好,D101次之。
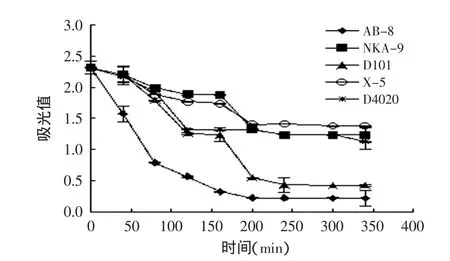
图2 5种不同大孔树脂的吸附曲线Fig.2 Absorption curves of five different macro-porous resins
2.2.2 不同型号树脂对榛子壳棕色素的静态解吸 考察不同型号树脂在不同时间段对榛子壳棕色素的静态解吸的影响,其结果见图3。

图3 5种不同大孔树脂的解吸曲线Fig.3 Desorption curves of five different macro-porous resins
由图3可知,在160min以后,不同型号树脂对榛子壳棕色素的解吸达到平衡,而上清液的吸光值的大小顺序为:D4020>D101>X-5>AB-8>NKA-9。
结合图2和图3可知,虽然AB-8对榛子壳棕色素的吸附效果最好,但由于其与榛子壳棕色素结合过于紧密,使其解吸比较困难。因此,综合考虑不同型号树脂对榛子壳棕色素吸附和解吸的影响,树脂D101为分离纯化榛子壳棕色素的最佳树脂。
2.3 D101树脂静态实验
2.3.1 样液pH对吸附效果的影响 样液pH对吸附效果的影响如图4和表1所示。

图4 样液pH对静态吸附的影响Fig.4 The effect of different pH of sample solution on static absorption
由图4可知,在吸附了20min之后,榛子壳棕色素溶液的吸光值都有了较大程度的下降,在200min时基本达到吸附饱和。

表1 样液pH对树脂静态吸附的影响Table 1 The effect of different pH of sample solution on static absorption
由表1可知,随着pH的增大,色素吸附率逐渐增大,pH=4时色素吸附率达到最大,并且颜色也最佳,在pH<4时,榛子壳棕色素溶液的颜色变浅,这是由于氢离子浓度的不同对发色基团的结构产生了影响[22]。之后随着pH增大色素吸附率降低很快,pH=5后基本上趋于稳定。
2.3.2 样液稀释倍数对吸附效果的影响 样液稀释倍数对吸附效果的影响如图5和表2所示。

图5 不同稀释倍数对吸附的影响Fig.5 The effect of different dilution of sample solution on absorption
由图5所示,在80min之后D101树脂对各浓度的溶液基本上都吸附饱和,所以样液的稀释倍数对吸附饱和的时间基本上没有太大的影响。
由表2可知,随着稀释倍数的增加,即随着样液浓度的降低,吸附率逐渐增大,在稀释到25倍时,吸附率达到最大,即达到80.1%。之后随着稀释倍数的增加,吸附率又逐渐下降,因此样液应经过适当稀释后应用于实验。上官新晨等[23]利用大孔树脂对紫红薯色素吸附和解吸的特性研究中也给了同样的结论,即适当的降低样液浓度,更有利于吸附,也有报道认为样液浓度越大越有利于吸附[24-25],还有报道认为样液浓度对树脂吸附性能影响不大[26],这可能是各实验所选样液浓度范围差异和色素性质差异所致。在本实验中25倍为最佳稀释倍数,即最佳上样浓度为30mg/mL。
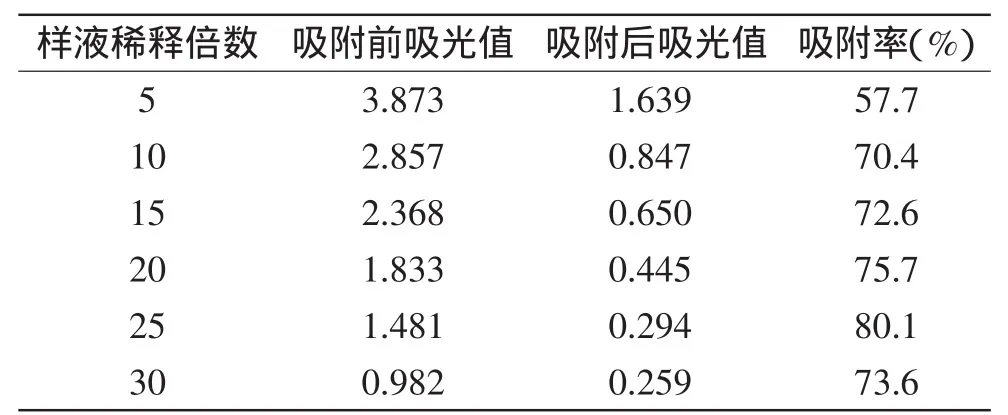
表2 不同稀释倍数对静态吸附的影响Table 2 The effect of different dilution of sample solution on absorption
2.3.3 乙醇浓度对解吸效果的影响 乙醇浓度对解吸效果的影响如表3所示。

表3 不同浓度的乙醇解吸液的吸光值Table 3 Absorbency of different alcohol desorption concentration
由表3可知,随着乙醇浓度的增加,解吸效果逐渐变好,在乙醇浓度达到70%后,解吸液吸光值趋于稳定,由实验结果可得乙醇浓度为70%是最佳的选择,既可以将色素很好地解吸出来,又避免了乙醇的浪费。
2.4 D101树脂动态实验
2.4.1 上样流速对吸附效果的影响 上样流速对吸附效果的影响如图6所示。

图6 不同上样流速对吸附的影响Fig.6 The effect of different velocity of flow on absorption
由图6可知,色素溶液上样的流速对吸附能力的影响比较大,大孔树脂柱层析是一种动态吸附过程,色素溶液上样流速的变化直接影响色素在树脂内部的扩散,从而影响吸附效果。流速过快,溶质分子还来不及扩散到树脂内表面,就会发生泄漏现象,如当上样流速为3.0mL/min时,当管号为21时就已经到达泄露点,色素溶液与树脂接触时间短,这不利于树脂很好地吸附色素,吸附效率大大下降,也造成了物料的浪费;流速过慢,操作时间长,也降低了工作效率。因此,样液上样流速控制在1.5~2.0mL/min效果最佳。
2.4.2 上样体积对吸附效果的影响 上样体积对吸附效果的影响如图7所示。

图7 上样体积对吸附效果的影响Fig.7 The effect of sample volume on absorption
由图7可知,上样体积为70mL时,树脂没有吸附饱和,降低了纯化效率;而当上样体积为130mL和150mL时,泄露点过早到达,造成资源浪费;当上样体积为90mL和110mL时,达到泄露点的时间相近,考虑到纯化效率,本实验最佳的上样体积为110mL。
2.4.3 洗脱流速对解吸效果影响 洗脱流速对解吸效果的影响如图8所示。
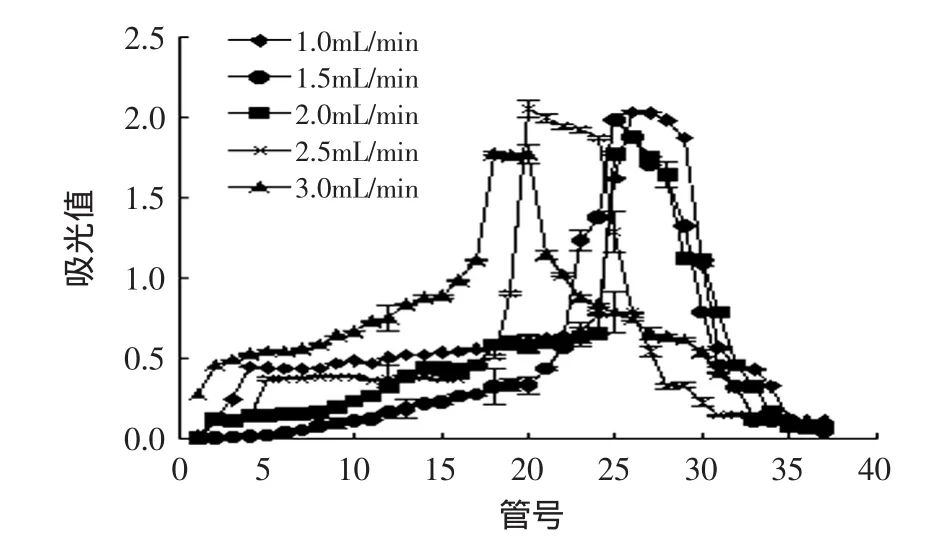
图8 洗脱流速对解吸效果的影响Fig.8 The effect of velocity of flow on desorption
由图8可知,随着洗脱的进行,流出液中榛子壳棕色素的浓度升高到最大以后,又迅速降低,此时已收集到大部分色素,当流出液为无色时,说明洗脱已完成。当洗脱流速过大时,如2.5~3.0mL/min,对洗脱出的色素溶液富集效果较差,而且流速为1.0、2.5、3.0mL/min时基线吸收较高,也不利于富集,同时有一定的拖尾现象。当洗脱流速为1.0mL/min时,工作效率过低,而当洗脱流速为1.5~2.0mL/min时,不仅对榛子壳棕色素有富集效果,也无拖尾现象,因此,洗脱流速为1.5~2.0mL/min时,洗脱效果最佳。
2.5 榛子壳棕色素纯化前后的色价比较
榛子壳中棕色素的含量较为丰富,用上述实验所确定的最佳纯化条件对榛子壳棕色素进行分离纯化,进行纯化前后光谱扫描,结果如图9所示。
由图9可知,纯化后的色素溶液在240~300nm的范围内吸收大大降低,可见除去了一部分杂质。对比纯化前后光谱扫描曲线可知,纯化后的榛子壳棕色素的纯度有了一定程度的提高。根据公式=A×R/W计算可知,色价由22.3提高到了46.8,洗脱率为83.4%。

图9 光谱扫描曲线Fig.9 The curve of spectral scanning
3 结论
在所选的5种树脂中,D101对榛子壳棕色素有较好的吸附和解吸能力,适用于榛子壳棕色素的分离纯化。结合D101静态实验和动态实验结果,D101树脂分离纯化榛子壳棕色素的最佳条件为:样液pH=4.0,上样浓度为30mg/mL,上样体积为110mL,上样流速为1.5~2.0mL/min;洗脱剂为70%的乙醇,洗脱流速为1.5~2.0mL/min为最佳纯化条件。经D101纯化的色素,色价从22.3提高到了46.8,洗脱率可达83.4%。
作为食品着色剂,榛子壳棕色素可广泛用于饮料、果冻、冰淇淋等加工工业中;还可用于化妆品,染料等工业。作为一种新兴的天然食品着色剂,榛子壳棕色素必定会有很好的发展前景。
[1]Dogan M,Abak H,Alkan M.Adsorption of methylene blue onto hazelnut shell:Kinetics,mechanism and activation parameters[J].Journal of Hazardous Materials,2009,164(1):172-181.
[2]Demirbas O,Karadag A,Alkan M,et al.Removal of copper ions from aqueous solutions by hazelnut shell[J].Journal of Hazardous Materials,2008,153(1-2):677-684.
[3]徐清海,明霞,李秉超.榛子壳棕色素的提取及稳定性研究[J].沈阳农业大学学报,2009,40(1):58-61.
[4]王静.榛子壳色素提取、纯化及性质研究[D].哈尔滨:东北林业大学,2010.
[5]李德海,刘荣,孙常雁,等.提取条件对榛子壳提取物抗氧化活性的影响[J].中国酿造,2011(12):126-129.
[6]孙志慧.类黄酮物质对心血管疾病的保护作用[J].中国老年学杂志,2008,28(1):98-99.
[7]张岩,徐玉娟,王萍.沙姜类黄酮物质的功能研究进展[J].广东农业科学,2009(1):73-74.
[8]Singh S,Kaur R,Sharma S K.An updated review on the Oenothera genus[J].Journal of Chinese Integrative Medicine,2012,10(7):717-720.
[9]赵玉红,王静,金秀明.超声波辅助酶法提取榛子壳色素工艺条件的研究[J].中国调味品,2010,35(4):110-113.
[10]王金玲,博伟,王振宇,等.化学预处理法提取榛壳棕色素条件的响应面优化[J].东北农业大学学报,2010,41(8):110-114.
[11]赵玉红,金秀明,韩龙华,等.微波辅助提取榛子壳棕色素工艺条件及其抗氧化活性[J].中国调味品,2010(8):110-112.
[12]王振宇,王金玲.一种榛子壳棕色素的制备方法:中国,201010102780.2[P].2010-08-11.
[13]耿明江,华远照,袁建梅.大孔吸附树脂分离纯化桃花红色素的研究[J].食品研究与开发,2008,29(3):40-41.
[14]肖凯军,熊璞.金樱子棕色素的提取纯化新工艺的研究[J].食品工业科技,2010(1):242-243.
[15]梁华正,廖夫生,乐长高.大孔树脂分离纯化栀子黄色素的研究[J].广州食品工业科技,2004(2):9-10.
[16]戴富才,赵娣,毛国庭,等.大孔树脂吸附纯化茄皮紫色素的研究[J].廊坊师范学院学报,2010,10(5):63-66.
[17]滕学峰,徐雅琴.大孔树脂纯化黑大豆皮色素工艺的研究[J].食品工业科技,2007,28(9):176-177.
[18]尹忠平,洪艳平,徐明生.大孔树脂吸附纯化粗提玫瑰茄红色素研究[J].江西农业大学学报,2007,29(6):1026-1028.
[19]黄文,王宁,刁海鹏,等.荸荠皮棕色素的提取及稳定性研究[J].中国酿造,2005(10):18-19.
[20]陈冠林,胡坤,邓晓婷,等.红肉火龙果果皮色素的纯化及稳定性的研究[J].中国农学通报,2012,28(27):277-282.
[21]张玉超,李娜,乔东东,等.D-101大孔树脂分离纯化葛根异黄酮的工艺探讨[J].西北农林科技大学学报:自然科学版,2009,37(11):163-164.
[22]赵玉红,金秀明,韩龙华,等.微波辅助提取榛子壳棕色素工艺条件及其抗氧化活性[J].中国调味品,2010,35(8):110-113.
[23]上官新晨,沈勇根,徐明生,等.大孔树脂对紫红薯色素吸附和解吸的特性研究[J].食品科技,2006,31(7):119-120.
[24]邹阳,张秀玲,石岳.AB-8大孔吸附树脂对蓝莓色素吸附和解吸的特性研究[J].中国食品添加剂,2007(1):81-82.
[25]陈智理,杨昌鹏,廖贵珍,等.大孔树脂法分离纯化杨梅红色素的研究[J].科技信息,2011(20):3-4.
[26]韩永斌,范龚健,顾振新,等.大孔树脂对紫甘薯色素的静态吸附参数研究[J].南京农业大学学报,2006,29(4):115-118.
