AB-8型大孔吸附树脂分离纯化了哥王总黄酮
2012-12-03李姣姣李超王乃馨郑义王卫东
李姣姣,李超,王乃馨,郑义,王卫东
(徐州工程学院食品工程学院,江苏 徐州 221008)
了哥王[Wikstroemiaindica(L.)C.A.Mey.]始载于《岭南采药录》,为瑞香料荛花属植物,苦寒、微辛、有毒,清热解毒、化痰散结、通经利水,可用于治疗扁桃体炎、腮腺炎、淋巴结炎、支气管炎、哮喘、肺炎、风湿性关节炎、跌打损伤、麻风、闭经、水肿等疾病,其主要含有黄酮类化合物等有效成分[1-6]。大孔吸附树脂是一类不溶于酸、碱及各种有机溶剂且有较好吸附性能的有机高聚物吸附剂,近年来广泛被应用于医药、环保和食品等领域[7],在中草药研究方面也较广泛,尤其在黄酮类化合物中:如红树莓总黄酮[8],银杏叶总黄酮[9]和杭白菊总黄酮[10]等及其他各类成分均有采用大孔吸附树脂法进行分离纯化的研究。而应用于了哥王总黄酮分离纯化方面鲜见报道,故本研究对AB-8型大孔吸附树脂纯化了哥王总黄酮的工艺进行研究,为该资源的进一步开发提供科学的理论依据。
1 材料与方法
1.1 原料与试剂
了哥王购自安徽亳州药材市场,经江南大学食品学院高献礼博士鉴定;芦丁标准品:南京替斯艾么中药研究所,批号:TCM027-090316;AB-8型大孔吸附树脂:安徽三星树脂有限公司;其他均为分析纯。
1.2 仪器与设备
CW-2000型超声-微波协同萃取仪:上海新拓分析仪器科技有限公司;SBS数控记滴自动部分收集器:上海沪西分析仪器厂;pHS-3C型酸度计:上海雷磁仪器厂;7230G可见分光光度计:上海精密科学仪器有限公司;LGJ-10冷冻干燥机:北京四环科学仪器厂。
1.3 方法
1.3.1 样品溶液的制备方法
精确称取1.4 g原料于100 mL特制三角瓶中,然后加入70%乙醇42 mL、在微波功率400 W的条件下提取时间120 s后,抽滤、定容于100 mL、测定。
1.3.2 标准曲线的制备
以芦丁为对照品,采用亚硝酸钠-硝酸铝比色法[11]。精确称取芦丁20 mg置于250 mL容量瓶中,加60%乙醇稀释至刻度,摇匀,配成0.08 mg/mL的对照品储备液。精确量取对照品储备液 0、1.0、2.0、3.0、4.0、5.0 mL,分别置于10 mL具塞刻度试管中,先依次分别加60%乙醇 5.0、4.0、3.0、2.0、1.0、0 mL,再加入 0.3 mL 5%NaNO2摇匀后静置6 min,再加入0.3 mL 10%Al(NO3)3摇匀后静置6 min,最后加入4 mL 1 mol/L NaOH后用60%乙醇定容至刻度,摇匀后静置10 min,以60%乙醇为空白参比,于波长510 nm处测定吸光度。以芦丁浓度为横坐标,吸光度值为纵坐标,得回归方程:A=11.688C-0.0301,R2=0.9990,结果表明在 0.008 mg/mL~0.040 mg/mL之间线性良好。
1.3.3 大孔吸附树脂的预处理[12]
按文献[12]方法稍加修改:将准备装柱的新树脂先用适量的乙醇浸泡充分溶胀,然后装柱,以4 BV/h~5 BV/h的流速使5倍~8倍的乙醇通过树脂层,洗至流出液加适量的水无白色浑浊现象,再以8 BV/h~10 BV/h的流速使双蒸水通过树脂层,洗尽醇,最后转入酸碱处理,即用200 mL的5%HCl溶液,以5 BV/h的流速通过树脂层,并浸泡3 h,而后用双蒸水以同样流速洗至出水pH为中性,再用200 mL的5%NaOH溶液,以5 BV/h的流速通过树脂层,并浸泡3 h,而后用双蒸水以同样流速洗至出水pH中性。
1.3.4 静态吸附试验
取大孔吸附树脂6.0800 g(用滤纸吸干后称重,干重1.3848 g),装入250 mL具塞磨口三角瓶中,精密加入30 mL浓度为0.493 mg/mL的样液,避光密封,并置恒温振荡器中,在30℃下,以120 r/min振荡24 h(其中在前8小时内,每小时各取1mL;在第24小时取1mL,共9个1 mL),测定这9个1 mL的总黄酮浓度,绘制静态吸附曲线。
1.3.5 动态吸附洗脱试验
首先将预处理好的树脂湿法装入(1.6 cm×20 cm,1 BV为30 mL)玻璃层析柱中,然后将了哥王总黄酮提取液上柱,待样品溶液全部通过树脂柱后用去离子水洗至流出液无色,最后洗脱,收集洗脱液。通过测定总黄酮含量考察各因素对树脂性能的影响,确定最佳工艺条件。
1.3.6 吸附容量和吸附率的测定

式中:R 为吸附容量,(mg/g);C0为吸附液初始浓度,(mg/mL);C1为吸附液平衡浓度,(mg/mL);V1为吸附液体积,mL;W为树脂干重,g。
假设吸附前后吸附液体积不变,可由下列公式计算吸附率。

式中:S为吸附率;C0为吸附液初始浓度,(mg/mL);C1为吸附液平衡浓度,(mg/mL)。
1.3.7 洗脱率的测定

式中:T为洗脱率;C0为吸附液初始浓度,(mg/mL);C1为吸附液平衡浓度,(mg/mL);V1为吸附液体积,mL;C2为洗脱液浓度,(mg/mL);V2为洗脱液体积,mL。
1.3.8 纯度的测定
分别将提取液和洗脱液用旋转蒸发器回收乙醇后冷冻干燥,得到粉状产品,再分别准确称取总黄酮提取物和纯化物粉末0.02 g,70%乙醇定容,摇匀,测定,计算总黄酮纯度。
2 结果与分析
2.1 静态吸附洗脱试验
2.1.1 吸附容量、吸附率及洗脱率
吸附容量、吸附率及洗脱率见表1。

表1 吸附容量、吸附率及洗脱率Table 1 Adsorption capacity,adsorption rate and elution rate
由表1可以看出,AB-8型大孔吸附树脂不仅有较大的吸附率,还有较高的洗脱率。
2.1.2 静态吸附曲线
仅仅以大孔吸附树脂的静态吸附率来评价其吸附性是不全面的,合适的吸附树脂除了具有较大的吸附容量、吸附率和洗脱率外,同时还要有较快的吸附效果,故将AB-8大孔吸附树脂进行吸附动力学试验,结果如图1所示。
从图1可知,AB-8型大孔吸附树脂对了哥王总黄酮的吸附为快速平衡型,起始阶段的总黄酮浓度较大,在1 h后基本达到平衡,AB-8型大孔吸附树脂对了哥王总黄酮具有良好的吸附动力学特性。综上分析可知,该树脂对了哥王总黄酮具有良好的吸附洗脱特性,适合了哥王总黄酮的分离纯化。

图1 静态吸附曲线Fig.1 Static absorption curve
2.2 动态吸附洗脱试验
2.2.1 上样液浓度对吸附效果的影响
在上样液流速2 BV/h和上样液pH 5.4的条件下,考察不同上样液浓度对树脂吸附效果的影响,结果见图2。
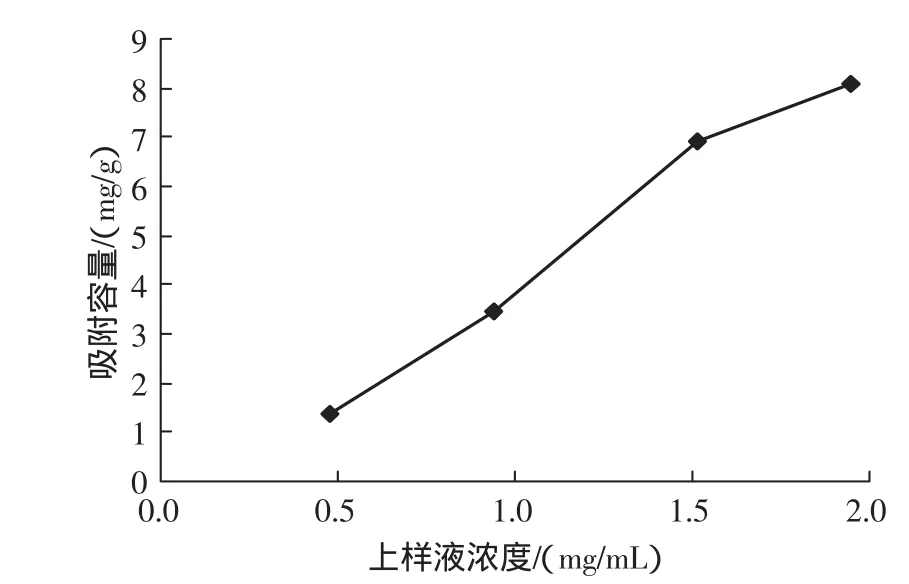
图2 上样液浓度的影响Fig.2 Effects of concentrations of sample solution
由图2可知,低浓度不利于总黄酮的吸附,因为上样液浓度偏低,吸附不充分;高浓度(2 mg/mL)时,了哥王水溶液易发生沉淀现象;当以1.5 mg/mL上柱时,吸附率较大,所以在此选择上样液浓度为1.5 mg/mL。
2.2.2 上样液流速对吸附效果的影响
在上样液浓度1.5 mg/mL和上样液pH 5.4的条件下,通过调节恒流泵的转速对上样液进行吸附流速的选择,考察不同上样液流速对树脂吸附效果的影响,结果见图3。
由图3可知,随着上样液流速的增加,吸附量先稍微增加而后降低。上样液流速低,较利于总黄酮的吸附,但循环周期长;当以2 BV/h上柱时,吸附量最大;上样液流速大于2 BV/h时,由于流速过快,树脂还未来得及吸附,样液就已流出。所以在此选择上样液流速为2 BV/h。

图3 上样液流速的影响Fig.3 Effects of velocity of sample solution
2.2.3 上样液pH对吸附效果的影响
上样液pH对吸附、分离效果的影响是十分重要的。根据化合物的结构特点调整上样液pH,可达到较好的吸附效果。在上样液浓度1.5 mg/mL和上样液流速2 BV/h的条件下,考察不同上样液pH对树脂吸附效果的影响,结果见图4。

图4 上样液pH的影响Fig.4 Effects of pH values of sample solution
由图4可知,从吸附量上考虑,pH 5.4的条件进行吸附比较合适。这是因为黄酮类化合物含多羟基,呈弱酸性。故要达到较好的吸附效果,吸附需在pH 5.4条件下进行。
2.2.4 动态吸附曲线
在上样液浓度为1.5 mg/mL、上样液流速2 BV/h和上样液pH 5.4的条件下通过已处理好的树脂柱,进行动态吸附,结果见图5。

图5 动态吸附曲线Fig.5 Dynamic absorption curve
从图5可知,上样液体积达到32 mL时树脂基本不再吸附总黄酮(此时吸附量为30.234 mg/g,吸附率为89.62%)。动态吸附曲线进一步说明AB-8型大孔吸附树脂对总黄酮有较大的吸附量,适用于纯化了哥王总黄酮。
2.2.5 洗脱液浓度对洗脱效果的影响
洗脱流速过快,洗脱性能差,洗脱带宽,而且脱尾严重,洗脱不完全;但是流速过慢,则会延长生产周期,通常情况下控制洗脱流速为吸附流速的1/3~1/2[13]。本实验固定洗脱流速为吸附流速的1/2来考察不同洗脱液浓度对洗脱效果的影响(其他条件为上样液浓度为1.5 mg/mL、上样液流速 2 BV/h、上样液 pH5.4),结果见图6。

图6 洗脱液浓度的影响Fig.6 Effects of concentrations of desorption solution
由图6可知,70%乙醇的洗脱率和90%乙醇的洗脱率差不多,考虑到成本问题,所以选择洗脱液浓度为70%。
2.2.6 动态洗脱曲线
在上样液浓度为1.5mg/mL、上样液流速2BV/h、上样液pH5.4、洗脱液浓度为70%和洗脱液流速1 BV/h的条件下,进行动态洗脱,结果见图7。

图7 动态洗脱曲线Fig.7 Dynamic elution curve
由图7可知,70%乙醇通过约30 mL时总黄酮开始被洗脱下来,之后在40 mL附近时迅速达到高峰,通过80 mL后,吸附在树脂上的总黄酮基本被洗脱下来,洗脱曲线出峰快,仅稍有拖尾现象。
2.3 纯度测定结果
纯度测定结果见表2。

表2 总黄酮的纯度Table 2 Purity of total flavonoids %
由表2可知,经纯化后,纯度由原来的8.05%提高到了20.60%,提高了1.56倍。
3 结论
1)AB-8型大孔吸附树脂为理想的了哥王总黄酮分离纯化的树脂,它的吸附率为74.84%,洗脱率为79.68%。
2)AB-8型大孔吸附树脂分离纯化了哥王总黄酮的吸附的最佳工艺参数为上样液浓度1.5 mg/mL、上样液流速2 BV/h和上样液pH 5.4,洗脱的最佳工艺参数为洗脱液浓度70%乙醇、洗脱液流速1 BV/h和洗脱剂用量为80 mL;在最佳工艺参数条件下了哥王纯化产品中总黄酮的纯度由8.05%提高到20.60%,提高了1.56倍,由此可以看出AB-8型大孔吸附树脂可以有效地分离纯化了哥王总黄酮。
[1]谢宗万.全国中草药汇编(上册)[M].2版.北京:人民出版社,1996:10-12
[2]国家中医药管理局.中华本草(第五册)[M].上海:上海科学技术出版社,1999:423-425
[3]朱雅敏,胡敏灿.了哥王的药理研究和临床应用[J].浙江中医杂志,2004(2):42-43
[4]江苏新医学院.中药大辞典(上册)[M].上海:上海科技出版社,1992:51-53
[5]陈爽,邵曼莉,杨振宇,等.正交试验优选了哥王的提取工艺[J].中草药,2007,38(2):208-210
[6]李艳敏,姜建国,余进峰.了哥王总黄酮提取工艺的优化研究[J].现代食品科技,2009,25(6):653-655,624
[7]朱英,何远,李丽.大孔树脂对地锦草、金银花叶与杭白菊总黄酮吸附分离性能研究[J].医学研究杂志,2007,36(1):56-59
[8]杨国伟,白立敏,苏东海,等.大孔吸附树脂纯化红树莓总黄酮的研究[J].西北农业学报,2008,17(2):147-150,154
[9]李月,陈莹.大孔吸附树脂分离纯化银杏叶总黄酮的研究[J].化学与生物工程,2009,26(7):55-57
[10]闫克玉,于静.大孔吸附树脂法纯化杭白菊总黄酮[J].现代食品科技,2008,24(1):35-38
[11]陈健,姚成.野马追中总黄酮的测定[J].南京师范大学学报,2004,4(2):16-18
[12]蔡正云,李莉,何建国.槲寄生中黄酮类化合物纯化工艺研究[J].食品研究与开发,2009,30(3):40-44
[13]张晴,陈勇.AB-8大孔吸附树脂对紫苏色素的吸附性能的研究—pH=3.0时吸附等温线和吸附流出曲线的测定[J].食品与发酵工业,1999,25(3):18-21
