利用纤维素原料生产柠檬酸菌株的筛选
2014-07-25叶生梅丁叶强张国庆
叶生梅,丁叶强,张国庆
(1.安徽工程大学生物与化学工程学院,安徽芜湖 241000;2.安徽省农科院农业工程研究所,安徽合肥 230041)
当今利用微生物(黑曲霉)发酵生产柠檬酸的主要原料是含淀粉量高的粮食(如薯类、谷类、糖蜜等)。我国科研工作者通过精心选育得到了利用淀粉质原料生产柠檬酸的高产菌种。世界人口的增长和粮食的匮乏制约乙醇、柠檬酸等以粮食为原料的工业的发展。我国有丰富的秸秆资源,近年来,随着我国农村生活能源结构的变化,秸秆逐渐由传统的做饭、取暖的原料变成了无用的负担物。秸秆的就地焚烧产生的烟雾已成为影响空气质量和公共安全的公害。如何以秸秆等纤维素为原料,用微生物发酵生产燃料(如乙醇、沼气等)及有机化工产品(如柠檬酸等)成为秸秆综合利用的重要课题。可再生性的秸秆资源的高值化利用,对解决我国的秸秆焚烧、“三农”问题、能源问题和农业可持续发展具有现实意义。
纤维素燃料乙醇的生物转化是近来的研究热点,而纤维素原料发酵生产有机酸(如柠檬酸)的研究较少[1-4]。本文通过对一株黑曲霉S的纤维素酶发酵特性和产酸驯化筛选研究,以期获得具有利用纤维素原料产酸的菌种。
1 材料与方法
1.1 材料与仪器
柠檬酸、蔗糖、草酸、NH4NO3、(NH4)2SO4、KH2PO4、MgSO47H2O、HCl、CaCl2、NaOH等 均为国药集团化学试剂有限公司产品,分析纯;CMC-Na(CP)、山芋淀粉、麸皮 市售;稻草、玉米秸秆、稻壳 采自芜湖市东郊农村;黑曲霉S(Aspergillus niger S)从土壤中分离,本校微生物实验室保藏;斜面培养基 PDA;初筛培养基 PDA培养基中添加0.02%溴甲酚绿指示剂;驯化筛选培养基 高柠檬酸-高渗察氏平板;酸性薯干粉水解平板[6];种子培养基(%) 葡萄糖3,麸皮2,(NH4)2SO40.2,KH2PO40.2,MgSO47H2O 0.05;以预处理稻草等纤维素为基质的发酵培养基(%) 预处理纤维素原料3,麸皮2,葡萄糖2,(NH4)2SO40.2,KH2PO40.2,MgSO4·7H2O 0.05;产柠檬酸发酵培养基500mL蒸馏水于水浴锅中加热至50℃,加入60g山芋淀粉,搅拌均匀后加淀粉酶(6U/g原料)50℃保温10min,1℃/min升温至95℃,保温20min,然后迅速升至沸腾并维持20min,约5min内降温至60℃,加营养盐(KH2PO41g,NH4NO31g,MgSO4·7H2O 0.12g,MnSO40.01g)加水保持原体积。
HH-6型电热恒温水浴锅 金坛市杰瑞尔电器有限公司;QHZ-123B型全温振荡培养箱 太仓市华美生化仪器厂;SW-CJ-2FD型双人单面超净工作台 苏州净化设备有限公司;722型分光光度计、PHSJ-5型实验室pH计 上海精密科学仪器有限公司;DSX-280B型高压蒸汽灭菌锅 上海申安医疗器械厂;PYX-DHS型隔水式电热恒温培养箱 上海跃进医疗器械厂。
1.2 实验方法
1.2.1 稻草秸秆、玉米秸秆、稻壳的预处理采用文献[4]中的方法 秸秆切成1~2cm的小段与3%氢氧化钠溶液(固液比w/v为1∶5)混匀,置于高压蒸汽灭菌锅中0.15MPa保温5min,立即放气。预处理后用水洗至pH7.5,50℃烘干后粉碎备用。
1.2.2 黑曲霉孢子悬液的制备 用无菌生理盐水将活化的斜面菌种孢子刮下,转入带玻璃珠的三角瓶并振荡,再用灭菌脱脂棉过滤到另一灭菌三角瓶得单孢子悬液,调整孢子数105~106个/mL。
1.2.3 黑曲霉S的产酸驯化筛选[6]黑曲霉S的孢子悬液稀释后涂布于高柠檬酸-高渗察氏平皿35℃培养5d,选择生长快和孢子头大的转接于酸性薯干粉水解液平板35℃培养7d,挑选酸性薯干粉水解液平板上不长孢子的菌落转接于含0.02%溴甲酚绿的PDA选择性平皿,35℃培养5d,选取10个黄色变色圈与菌落直径比较大的菌落,保持于PDA斜面。
1.2.4 种子培养及发酵 接种1mL/瓶黑曲霉孢子悬液于种子培养基,30℃,150r/min培养24h。以10%的接种量接种种子液于纤维素基质发酵,发酵条件30℃,200r/min培养24h后以35℃,250r/min培养。每个发酵三重复。
以糖化山芋淀粉为基质的柠檬酸发酵:直接用黑曲霉孢子悬液接种,1mL/瓶,35℃,200r/min,培养4d。每个发酵三重复。
1.2.5 分析测试方法 酸度的测定—NaOH滴定法[7]:发酵液经滤纸过滤后,用0.1429mol/L的NaOH溶液滴定,0.5%酚酞做指示剂,每毫升发酵液消耗NaOH的毫升数即为发酵液中柠檬酸的百分比含量(g/100mL)。
还原糖的测定:DNS法[8]。
pH的测定:酸度计或精密pH试纸。
孢子计数:血球计数板直接计数法[5]。
纤维素酶活力测定[8]:CMC酶活力测定:25mL具塞试管中加入1.5mL以0.2mol/L pH5.0 HAc NaAc缓冲液配制的1%CMC-Na溶液,置于50℃水浴中预热5min。加1.0mL适当稀释的酶液,摇匀,50℃准确反应30min,之后加入DNS试剂1.5mL,放入沸水浴显色5min,取出后立即置于冰水中冷却至室温,定容至25mL,摇匀。以相同条件下沸水浴灭活5min的酶液为空白,在波长540nm条件下测定吸光度值。按DNS法测定还原糖含量。酶活单位的定义:上述反应条件下,每分钟催化纤维素水解生成1μg葡萄糖的酶量为1个酶活力单位,用U/mL表示。
滤纸酶活力测定:取柠檬酸缓冲液(pH5.0)1.5mL,加入新华定量滤纸1条(1cm×6cm、(50±1)mg),再加入粗酶液1.0mL,50℃恒温水浴保持1h,加入DNS试剂1.5mL,于沸水浴中放置5min,冷却,定容至25mL,以相同条件下沸水浴灭活5min的酶液为空白,于540nm处测定其吸光度值,按DNS法测定还原糖含量。在上述条件下,每分钟催化水解底物生成1μg葡萄糖的酶量定义为1个酶活单位,用U/mL表示。
发酵后固形物质量的测定:滤渣用100mL蒸馏水洗涤后置80℃烘干至恒重,称重(g)。
固形物的变化量(g)=发酵后固形物的质量(g)-发酵前预处理稻草的质量(g)。
黑曲霉利用预处理稻草发酵产酸率(%)=M总酸(g)/原料(g)×100。
纸层析法鉴定酸成分以1%草酸、1%柠檬酸为标准品,发酵上清液为待测样品,展开剂为正丁醇∶冰醋酸∶水=12∶3∶5(v/v/v),室温上行展层9h,70~80℃烘干4h,冷却后喷上溴酚蓝显色剂。计算Rf值。Rf=d1/d2式中,d1为各显色点中心到点样点的距离(cm);d2为点样点到溶剂前沿的距离(cm)。
2 结果与分析
2.1 菌株S的形态观察
菌落形态:在PDA平板上气生菌丝短,呈绒毛状,圆形,幼时略显黄色,孢子成熟后菌丝白色,菌落背面无色,有褶皱,孢子黑色(见图1左,放大倍数16×10)。菌株显微形态:普通光学显微镜下观察菌丝有隔.(见图1右,放大倍数16×40),孢子梗顶部膨大呈球形,球形表面着生小梗呈辐射状排列,分生孢子串生于小梗顶部,分生孢子黑色(见图1中,放大倍数16×40)。

图1 菌株S的菌落特征及显微形态Fig.1 Characteristics of colony and microscopic form on the strain S
2.2 菌株纤维素原料发酵实验
2.2.1 菌株利用CMC-Na发酵特性 以10%的接种量接种种子液于CMC-Na基质发酵,分别在不同时间取样测定CMC酶活力、pH,测定结果如表1所示。

表1 菌株S利用CMC-Na发酵特性Table 1 Characteristics of fermentation with CMC-Na on the strain S
由表1可看出,发酵12h时CMC酶活力达到201.1U/mL,随着发酵时间的延长,菌株产酸使发酵液pH下降很快,纤维素酶活力也下降很快。发酵46h纤维素酶未检出,酸度达到0.9%。从发酵结果看该菌株具有纤维素酶系基因,有利用CMC-Na为原料产酸的能力。
2.2.2 以不同纤维素原料为基质发酵产纤维素酶、产酸特性 鉴于该菌株具有较高的CMCase酶活力且产酸,以CMC-Na为对照,进一步考察以预处理的稻草、玉米秸秆、稻壳为碳源该菌株的纤维素酶活力、产酸性能。分别在12、24h取样测定CMCase酶、滤纸酶(FPase酶)活力。发酵48h后,各发酵瓶中菌丝结成小球,发酵液透明易过滤,测定滤液的酸度、pH,测定结果如表2所示。

表2 以纤维素原料为基质发酵产纤维素酶、产酸比较Table 2 The compare of producing cellulase and acid with cellulose raw material on the strain S
由表2可见,菌株以三种秸秆类纤维素原料发酵具有以CMC-Na同样的特点,即在发酵12h酶活力高,随着发酵的进行CMCase酶、滤纸酶(FPase酶)酶活力下降,到24h时CMCase酶活降到约为12h时的四分之一,24h时以稻草为基质的滤纸酶(FPase酶)活力降为12h时的二分之一,另外几种原料的下降更快。从三种预处理原料看,以预处理稻草为碳源,发酵12h、24h的CMC酶活力、滤纸酶活力均最高;发酵48h时测定酸度,以稻草为基质的发酵产酸也最高,而玉米秸秆和稻壳为原料的发酵纤维素酶活及产酸都不及稻草,可能与原料的组成有关,预处理稻草为其产纤维素酶、产酸的适宜碳源。
2.3 黑曲霉S产酸的驯化筛选
通过驯化筛选,选取10个黄色变色圈与菌落直径比较大的菌落,保存于PDA斜面,并用柠檬酸发酵培养基复筛,培养4d测定酸度,筛选结果如表3所示,菌株S6产酸水平略高,其余菌株产酸水平相当,选取菌株S6作为后续实验用菌种。
2.4 黑曲霉S6产酸发酵产物鉴定及菌株产酸稳定性检验
用黑曲霉S6孢子悬液接种于产酸培养基培养4d。过滤,取滤液测定酸度、纸上层析法鉴定产酸成分,根据进行比较。从层析结果看,发酵液样品的黄色斑点与柠檬酸标准品的Rf基本一致,柠檬酸标样(Rf=0.52)与发酵上清液样品(Rf=0.49)且发酵液的草酸斑点几乎看不出,表明该菌株产酸发酵产物较纯,主要为柠檬酸。将菌株连续传代发酵5批,发酵产酸结果如表4所示,从表4可见,菌株S6产酸性能稳定。

表3 菌株S产酸复筛结果Table 3 The rescreening results of acid-producing of the strain S

表4 菌株S6产酸稳定性检验Table 4 The stability of acid-producing on the strain S6
2.5 黑曲霉S6以预处理稻草为基质产柠檬酸实验
以10%的接种量接种种子液于发酵培养基,每隔12h取样,发酵液过滤,滤液测定pH、酸度、还原糖;滤渣用100mL蒸馏水洗涤后置80℃烘干,测定发酵过程中固形物(草料+生物量)的变化、纤维素和半纤维素含量的变化。
发酵液的性状:培养24h时,观察到发酵液中的菌球较少,到36h时发酵液中的菌丝球细小而密,发酵液颜色变浅,气味香甜。发酵48、60h时发酵瓶中的性状如36h时。但到72h后菌丝球似有溶解,发酵液过滤速度变慢。

图2 发酵过程还原糖、pH的变化Fig.2 The fermentation process of changes profile of reduced suger utilization and pH
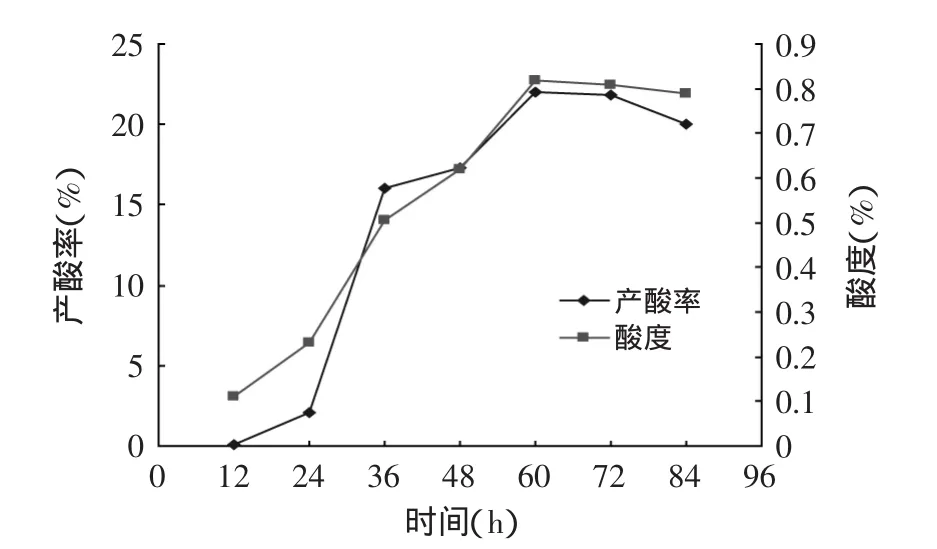
图3 发酵过程中酸度和产酸率的变化Fig.3 The fermentation process of changes of the concentration of citric acid and acid production rate
从图2发酵过程中pH、还原糖的变化看出,发酵12~48h发酵液中还原糖下降迅速,说明菌种处于对数生长期,培养基中草料及其他基质被利用。菌种生物量增长且产酸,发酵液的pH下降。60h后,发酵过程基本结束。pH也趋于稳定在2.5左右。从图3可见,发酵过程中酸度、产酸率在12~60h之间增加较快,到60h后产酸不再增加,也说明到60h时发酵趋于结束。产酸达0.82%。稻草纤维素的产酸转化率达22%。
通过测定发酵原料和残渣中纤维素和半纤维素的含量发现,由于发酵过程中菌体生物量的增加,发酵过程纤维素、半纤维素的变化不能反映发酵液中草料的变化(数据未列出)。但通过测定发酵过程中固形物与原料中草料的质量差(即固形物的变化)如图4可知,发酵开始阶段草料的利用大于菌体的生长,固形物的变化为负;随着菌体的生长,生物量的增加大于草料的利用,固形物的变化为正;到48h后,菌体的对数生长期转入稳定期;从72~84h菌体已到衰亡期,固形物的变化有所降低。

图4 发酵过程中固形物的变化Fig.4 The fermentation process of changes of change in solids
从实验结果看,发酵过程菌体生长迅速,发酵过程纤维素草料利用快。直接利用菌株S6的纤维素酶系和产酸酶系分解纤维素原料产酸,纤维素酶解和产酸进行偶联,省去了纤维素原料糖化过程[9-10],节约了秸秆类纤维素利用的成本。因此,菌株S6有进一步研究和开发的价值。
3 结论与讨论
有关用淀粉质以外的原料产柠檬酸的研究中,有报道用甘蔗渣[11]、苹果渣[12]、纤维素水解液[9-10]等产柠檬酸的研究。由于目前的纤维素酶活力不高,使纤维素酶解糖化的成本高,限制了纤维素原料的高值化工业应用。本文利用驯化筛选的黑曲霉S6对直接利用纤维素原料产柠檬酸进行了初步研究,结果表明,菌株S6能利用纤维素原料产酸,且预处理稻草为产酸的适宜碳源。以预处理稻草为碳源,发酵12h CMC酶活力达218.4U/mL,滤纸酶活力44.1U/mL,发酵60h产酸率达22%。酶解和产酸偶联进行,省去了将纤维素酶解的步骤,节约了成本。此外,发酵提取柠檬酸后的残渣(菌体+未利用的秸秆成分)可作为动物饲料,因为发酵过程增加了残渣的蛋白质含量,降低了原料中难以消化吸收的物质等。
研究中发现,菌株S的纤维素酶不耐酸,纤维素酶失活快。如何提高菌株S的纤维素酶酶活力、产酸率;特别是如何提高纤维素酶耐酸能力保持其在低pH下的活力是具有挑战性的课题,有待进一步研究探索。
[1]方诩,秦玉琪,李雪芝,等.纤维素酶与木质纤维素生物转化的研究进展[J].生物工程学报,2010,26(7):864-869.
[2]Namita B,Chetna J,Rupinder T,et al.Highly Thermostable and pH-Stable Cellulases fromAspergillus nigerNS-2:Properties and Application for Cellulose Hydrolysis[J].ApplBiochem Biotechnol,2014,172:141-156.
[3]盛晓晓,周如金,唐玉斌.纤维素原料制取燃料酒精的研究概述[J].食品与发酵工业,2012,38(1):138-142.
[4]叶生梅,许盼吉,汪江林.稻草秸秆的预处理及发酵乙醇的实验研究[J].中国粮油学报,2009,24(6):133-136.
[5]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:51-52.
[6]王博彦,金其荣.发酵有机酸与应用手册[M].北京:中国轻工业出版社,2000:49-50:72-73.
[7]王德培,周婷,张灵燕,等.氮离子注入和微波复合诱变选育高产柠檬酸的黑曲霉研究[J].中国酿造,2012,31(5):123-127.
[8]甄静,王继雯,谢宝恩,等.一株纤维素降解真菌的筛选、鉴定及酶学性质分析[J].微生物学通报,2011,38(5):709-714.
[9]谢慧君,卢利方,陈建,等.纤维素热解后用于柠檬酸发酵的研究[J].食品工业科技,2005,26(11):149-150.
[10]刘毅,袁月华.稻草纤维素糖化液发酵柠檬酸的条件研究[J].广东农业科学,2012(15):86-89.
[11]Masoud Y,Adel H,Seyed A,et al.Citric Acid Production from Sugarcane Bagasse through Solid State Fermentation Method usingAspergillus nigerMold and Optimization of Citric Acid Production by Taguchi Method[J].Jundishapur J Microbiol,2013 6(9):e7625.
[12]吴怡莹,张苓花,明静文,等.以苹果渣为原料固体发酵生产柠檬酸的研究[J].大连轻工业学院学报,1994,13(2):72-77.
