甲基吡喃花色苷的制备优化及H P L C-MS/MS分析
2014-07-25邝敏杰齐敏玉何静仁李书艺
邝敏杰,吴 闹,齐敏玉,何静仁,2,*,李书艺,邓 莉,2,陈 轩,2
(1.武汉轻工大学食品科学与工程学院,湖北省农产品加工与转化重点实验室,湖北武汉 430023;2.武汉轻工大学粮油食品质量检验测试中心,湖北武汉 430023)
花色苷(anthocyanins)是一类广泛存在于果蔬类植物中的水溶性天然色素,属类黄酮多酚化合物,具有重要生物活性和生理功能[1-3]。大部分天然花色苷由于其本身结构的不稳定性而极大限制其在产品加工和贮藏过程中的直接应用[4]。花色苷衍生物(Anthocyanin derivatives)是近些年发现于花色苷果蔬的加工产品如葡萄酒和饮料或某些特殊类的植物中[4-5],由花色苷在发酵和陈酿过程中经一系列生物和化学反应形成的,或在植物体内经生物代谢形成的一系列较稳定的花色苷天然衍生物。因此,花色苷衍生物家族的形成及其在食品加工中的重要性已越来越引起科研人员的兴趣和重视。
甲基吡喃花色苷(methyl-pyranoanthocyanins)是花色苷衍生物家族的一种。它的基本结构是在原花色苷结构的基础上,在花色苷的C4位与C5位的羟基之间经环加合反应形成另外的第四个吡喃环D[5-6](结构如图1)。目前,国内外对甲基吡喃花色苷的研究较少,2000年Lu等在黑醋栗种子的70%丙酮提取液中发现了甲基吡喃花色苷[7]。2006年He等在陈酿葡萄酒中发现甲基吡喃花色苷,并经质谱和核磁鉴定首次证实了葡萄花色苷与乙酰乙酸反应形成甲基吡喃花色苷[8]的机制。本文拟采用葡萄皮红色素提取物(含大量锦葵花色苷malvidin-3-glucoside)在丙酮介质中反应合成甲基吡喃花色苷的技术路线,正交实验优化反应条件以methyl-pyranoMv的生成量为指标,高效液相色谱监测反应过程,高效液相色谱-二极管阵列检测-串联离子阱多级质谱法(HPLC-PDA-MS/MS)对其结构进行分析和确认,为甲基吡喃花色苷的高效制备、花色苷的分子修饰及理化性质和功能特性评价的深入研究提供物质基础。
1 材料与方法
1.1 材料与设备
葡萄皮红色素提取物(色价30) 购于云南通海杨氏天然产物有限公司;甲基吡喃锦葵花色苷标准品(纯度≥99%) 波尔图大学(University of Porto)化学学院;聚酰胺树脂(60-100目) 上海摩速科学器材有限公司;乙腈、甲酸、甲醇等 均为高效液相色谱纯,国药集团化学试剂有限公司;乙醇、丙酮、盐酸、氢氧化钠等 均为分析纯,天津市永太化学试剂有限公司。
LTQ-XL超高效液相色谱-质谱联用仪 美国Thermo公司;SSI Series1500高效液相色谱仪(配有二极管阵列检测器) SSI公司;Lambda 25紫外/可见分光光度计 北京谱朋科技有限公司;电子天平 梅特勒-托利多AL204;旋转蒸发器 瑞士Buchi R-3;冷冻干燥机 CHRIST ALPHA 2-4;超纯水机 成都品成科技有限公司;水浴锅。
1.2 实验方法
1.2.1 甲基吡喃花色苷合成反应机制 葡萄皮花色苷与丙酮在一定温度和pH条件下反应生成甲基吡喃花色苷,反应机制见图1。丙酮在一定的弱酸性pH条件下,β位碳先与α位碳发生烯醇化,随后具有不同电荷特性的α位和β位碳与花色苷的C4位及C5位的羟基之间发生环加成反应,经脱水,氧化和脱羧,生成具有另外一个吡喃环的花色苷氧鎓离子[8]。
1.2.2 葡萄皮红色素提取物中总花色苷的测定 采用pH示差法测定[9-11]花色苷含量。

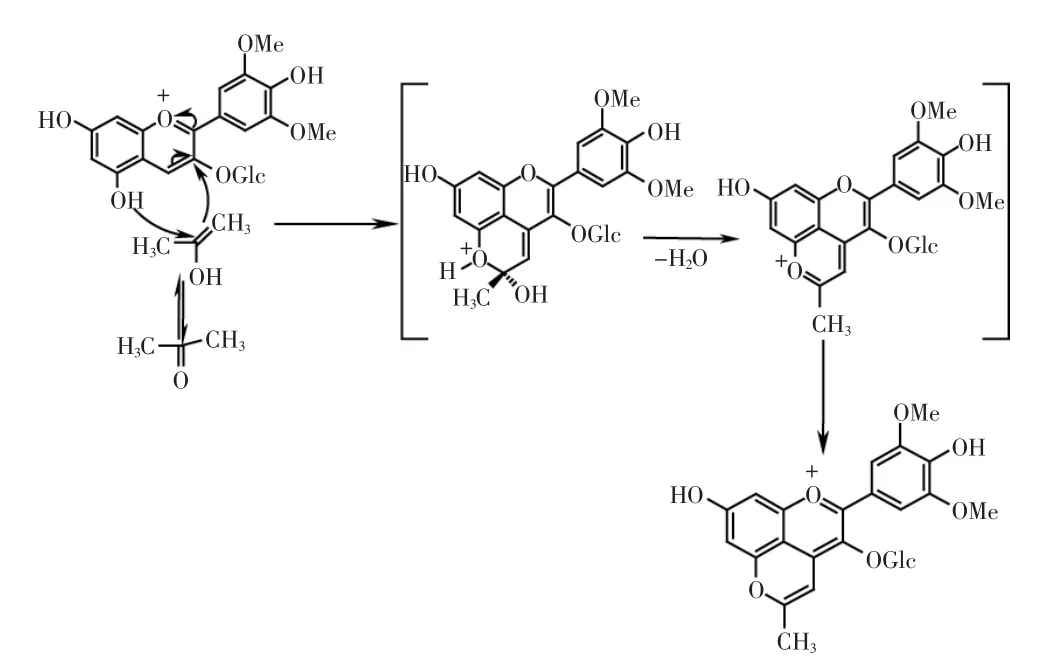
图1 甲基吡喃花色苷的形成机制Fig.1 The proposed formation mechanism of methyl pyranoanthocyanins
其中:A—在pH为1.0和pH为4.5处吸光度的差值;MW—cy-3-glu(矢车菊-3-葡萄糖苷)的相对分子质量(449.4);DF—稀释倍数;ε—cy-3-glu的消光系数(26900);l—比色皿光程1cm。
根据pH示差法测得的葡萄皮红色素提取物中总花色苷的含量为102.99mg/g。
1.2.3 反应产物中甲基吡喃花色苷含量及得率计算
利用高效液相色谱测定反应产物中甲基吡喃花色苷的含量。

式中,X—样品中甲基吡喃的浓度(mg/mL);S1—样品峰面积;C—甲基吡喃花色苷标准品的浓度(mg/mL);S2—甲基吡喃花色苷标准品的峰面积
甲基吡喃花色苷得率(%)=实际生成量(mg)/理论生成量(mg)×100[12]
1.2.4 甲基吡喃花色苷合成反应的实验设计 选择反应时间、葡萄皮红色素提取物浓度、反应溶液pH、反应温度、反应物比例进行单因素实验,考察不同条件对甲基吡喃花色苷合成效果的影响,以甲基吡喃花色苷得率为考察指标。
1.2.4.1 反应时间单因素实验 葡萄皮红色素提取物浓度为2.0mg/mL,葡萄皮红色素提取物(mg)与丙酮(mL)的比例为20∶1,温度45℃,pH为3.2,考察反应时间为6、7、8、9、10d时对甲基吡喃花色苷合成效果的影响。
1.2.4.2 葡萄皮红色素提取物浓度单因素实验 葡萄皮红色素提取物(mg)与丙酮(mL)的比例为20∶1,温度45℃,pH为3.2,考察葡萄皮红色素提取物浓度分别为1.0、1.5、2.0、2.5、3.0mg/mL时对甲基吡喃花色苷合成效果的影响。
1.2.4.3 pH单因素实验 葡萄皮红色素提取物浓度为2.0mg/mL,葡萄皮红色素提取物(mg)与丙酮(mL)的比例为20∶1,温度45℃,考察不同pH(2.6、2.8、3.0、3.2、3.6)对甲基吡喃花色苷合成效果的影响。
1.2.4.4 温度单因素实验 葡萄皮红色素提取物浓度为2.0mg/mL,葡萄皮红色素提取物(mg)与丙酮(mL)的比例为20∶1,pH3.2,考察不同温度(30、35、40、45、50℃)对甲基吡喃花色苷合成效果的影响。
1.2.4.5 反应物比例单因素实验 葡萄皮红色素提取物浓度为2.0mg/mL,温度45℃,pH为3.2,考察葡萄皮红色素提取物(mg)与丙酮(mL)的比例为10∶1、15∶1、20∶1、25∶1、30∶1时甲基吡喃花色苷的合成效果。
正交实验:在单因素实验的基础上,采用4因素3水平,按L9(34)正交表排列进行正交实验,因素水平表设计如表1所示,每组设定3个重复组,优化葡萄皮红色素提取物与丙酮反应合成甲基吡喃花色苷的参数。

表1 正交设计因素水平表Table 1 Levels and factors table of orthogonal experiment
1.2.5 甲基吡喃花色苷的光谱特征 配制一定浓度的甲基吡喃花色苷水溶液,在300~700nm波长范围内进行紫外可见全扫描,从而得出甲基吡喃花色苷色素的最大吸收波长。
1.2.6 甲基吡喃花色苷高效液相色谱分析[8]取产物溶液用SSI Series1500高效液相色谱检测,色谱参考条件:LiChrospher RP-C18柱,250mm×4.6mm,5μm色谱柱。二极管阵列检测器。流动相:A为甲酸∶水(1∶9,v/v),B为乙腈∶甲酸∶水(8∶1∶1,v/v/v)。检测波长:478nm。进样量:20μL。流速:1mL/min。洗脱梯度:0~70min,B从15%线性增加到35%,70~75min,B增加到80%,之后冲洗系统10min。
1.2.7 甲基吡喃花色苷高效液相色谱串联质谱分析花色苷与丙酮反应液经聚酰胺树脂纯化(Ø30×600mm,洗脱流速为1倍柱体积/小时),取10%酸化乙醇洗脱液洗脱出来的溶液进行HPLC-MS测定。
HPLC参数:色谱柱:赛默反相C18色谱柱,100mm×2.1mm内径,1.9μm粒径;检测器:DAD检测器;柱温:25℃;流速:0.2mL/min;进样量:10μL;检测波长:478nm。流动相A:0.3%甲酸水溶液;流动相B:甲酸-乙腈-水(0.3∶80∶19.7);洗脱梯度:0min,10%B;30min,20%B;35min,,100%B;45min,10%B。
MS设定的参数如下:ESI离子源;毛细管温度为350℃;毛细管电压为47V;N2:流速为30L/min,离子扫描范围为100~1500(m/z),目标离子531(m/z)。采用正离子扫描模式。
2 结果与分析
2.1 影响甲基吡喃花色苷产物得率的单因素分析
2.1.1 反应时间对甲基吡喃花色苷合成反应的影响在葡萄皮红色素提取物浓度为2.0mg/mL,温度45℃,pH为3.2,提取物与丙酮的比例为20∶1条件下,反应时间对甲基吡喃花色苷产率的影响结果如图2所示。由图2可知,随着反应时间的增加,甲基吡喃花色苷的生成量也逐渐增加,第9d时甲基吡喃花色苷生成量达最大值,随后甲基吡喃花色苷含量开始略微下降,可能是由于反应物花色苷或生成物甲基吡喃花色苷在45℃下随时间降解的原因。因此,最佳反应时间为9d。

图2 反应时间对甲基吡喃花色苷产率的影响Fig.2 Effect of reaction time on the yield of methyl pyranoanthocyanins
2.1.2 葡萄皮红色素提取物浓度对甲基吡喃花色苷合成反应的影响 花色苷反应物浓度是影响合成反应的关键因素,花色苷反应物浓度对甲基吡喃花色苷的产率有显著影响。不同浓度葡萄皮红色素提取物对甲基吡喃花色苷产率的影响结果如图3所示。当提取物浓度由1mg/mL增加到2.5mg/mL时,随着浓度的增加甲基吡喃花色苷的产率也逐渐增加。当浓度继续增大时,甲基吡喃花色苷的产率无增加趋势甚至略微下降,故最适宜葡萄皮红色素提取物浓度在2.5mg/mL左右。
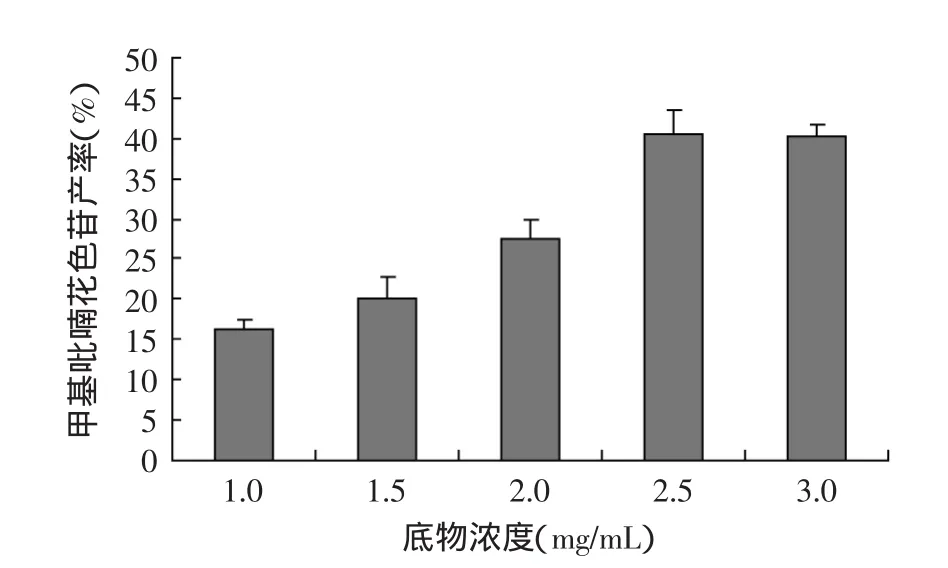
图3 葡萄皮红色素提取物浓度对甲基吡喃花色苷产率的影响Fig.3 Effect of concentration of extracts of red grape skins on the yield of methyl pyranoanthocyanins
2.1.3 pH对甲基吡喃花色苷合成反应的影响 反应体系的pH对甲基吡喃花色苷产率的影响结果如图4所示。由图4可知,pH对甲基吡喃花色苷合成反应的影响非常显著,当pH由2.6增大到3.0左右时,甲基吡喃花色苷的产率先缓慢减小然后迅速增加,到3.0时达到最高点。随着pH的继续增大甲基吡喃花色苷的产率随之减小,当pH大于3.6时,反应几乎不能进行,产率接近于零。在溶液介质中,花色苷随pH的变化而发生结构上的转变[13],这种转变影响烯醇化的丙酮与花色苷的C4位及C5位的羟基之间发生环加成反应。由此可知,制备甲基吡喃花色苷的最佳反应体系pH在3.0左右。
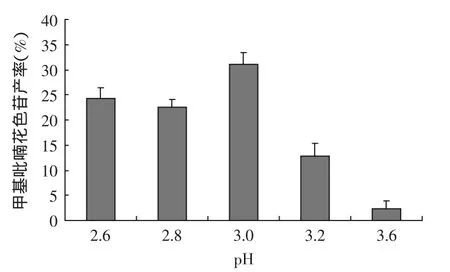
图4 pH对甲基吡喃花色苷产率的影响Fig.4 Effect of pH value on the yield of methyl pyranoanthocyanins
2.1.4 温度对甲基吡喃花色苷合成反应的影响 温度与甲基吡喃花色苷的产率有密切关系,不同温度对甲基吡喃花色苷产率的影响见图5。由图5可知,反应温度从30℃升高到35℃时甲基吡喃花色苷产率呈直线上升,随后,随着温度的升高产率缓慢增加,45℃时到达最大。温度继续上升时产率降低,可能是由于温度过高引起花色苷的部分降解。因此选取温度45℃为反应的最佳温度。

图5 温度对甲基吡喃花色苷的产率影响Fig.5 Effect of temperature on the yield of methyl pyranoanthocyanins
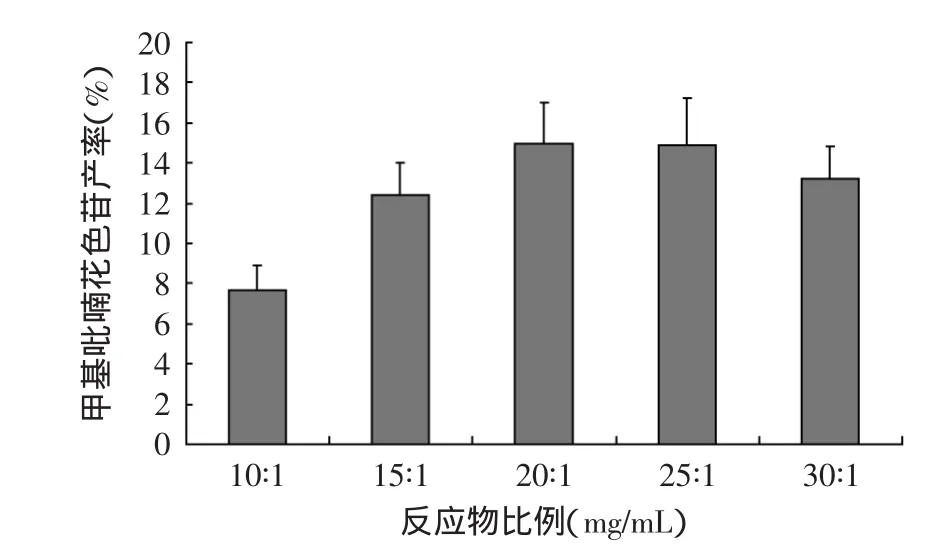
图6 反应物比例对甲基吡喃花色苷的产率影响Fig.6 Effect of material-to-lipid ratio on the yield of methyl pyranoanthocyanins
2.1.5 反应物比例对甲基吡喃花色苷合成反应的影响 不同反应物比例(葡萄皮红色素提取物mg∶丙酮mL)对甲基吡喃花色苷产率的影响结果如图6所示。当反应物比例由10∶1增加到20∶1时,甲基吡喃花色苷的产率逐渐增加,继续增加反应物的比例时,甲基吡喃花色苷的产率呈下降趋势。由此可知,制备甲基吡喃花色苷的最佳反应物比例为20∶1。
2.2 正交实验结果
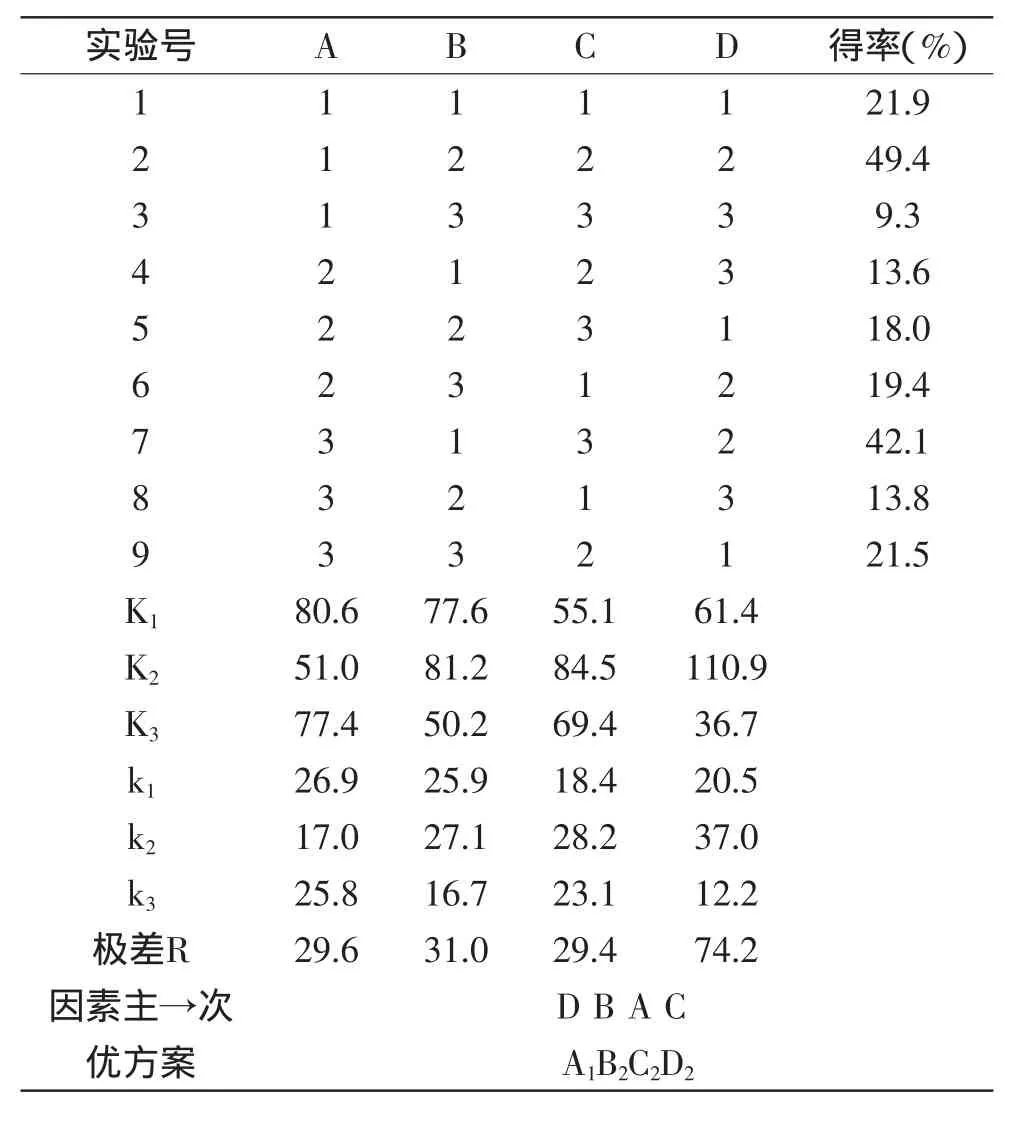
表2 正交实验安排及结果Table 2 Orthogonal experiment arrangement and results
正交实验结果如表2所示,以甲基吡喃花色苷的得率为指标,由直观分析法知:各因素从主到次的顺序为:(D)pH、(B)葡萄皮红色素提取物浓度、(A)反应物比例、(C)温度,最优方案为:A1B2C2D2,即反应物比例为15∶1,底物浓度为2.5mg/mL,温度为45℃,pH为3.0。由理论分析得到的优化方案和正交表中的结果是一致的。在该反应条件下甲基吡喃花色苷的得率为49.4%,高于表2中其他组实验结果。因此,A1B2C2D2为制备甲基吡喃花色苷的最佳反应条件。
2.3 甲基吡喃花色苷的光谱特征

图7 甲基吡喃花色苷色素的特征吸收光谱Fig.7 Visible absorption spectrum of the methyl-pyranoMv
甲基吡喃花色苷的紫外可见光谱如图7所示,由图7可知,甲基吡喃花色苷在478nm左右有一强吸收峰,与原花色苷最大吸收峰(524nm左右)相比,甲基吡喃花色苷的最大吸收波长明显发生了蓝移,呈现黄色色泽。
2.4 反应产物的高效液相色谱分析

图8 花色苷反应产物的高效液相色谱图(530和478nm)Fig.8 HPLC chromatograms recorded at 530 and 478 nm of the reaction mixture of the anthocyanin-acetone adducts
图8为高效液相色谱分析葡萄皮红花色苷反应生成甲基吡喃花色苷的色谱图。由图8可知,当检测波长从530nm(花色苷的特征吸收波长)变为478nm时,保留时间23min处出现一新色谱峰A(如图8峰A),结合其特征吸收光谱的扫描结果,初步判定峰A物质为锦葵花色苷反应形成的甲基吡喃花色苷。色谱图还表明,在表2色谱分离条件下花色苷和甲基吡喃花色苷30min内达到显著的分离效果。
2.5 反应主要产物高效液相色谱串联质谱分析结果
高效液相色谱-二极管阵列检测-串联离子阱多级质谱对初步纯化后的反应产物进行分析,其总离子流色谱图(a)和主要目标化合物的一级(b)、二级(c)质谱图如图9所示。
由图9可知,峰1的保留时间为32.26min,其最大吸收波长为478nm,分子离子m/z为531,二级质谱显示分子离子m/z 531有一碎片离子m/z 369,它是失去一分子葡萄糖[M-162]+获得,此结果与He等[8]的结果一致。Hayasaka等[14]曾对分子离子m/z 531的三级质谱进行分析,根据失去的原子质量分别为16、32、44、61、89amu可得出分子离子m/z 531的物质为锦葵花色苷衍生物。Jingren he等[8]于2006年利用HPLC-MS及NMR等技术手段证实了锦葵花色苷与乙酰乙酸反应生成的锦葵花色苷衍生物的结构,即为甲基吡喃花色苷。综上所述,根据特征吸收光谱表征和多级质谱结构分析,确认峰1物质为锦葵花色苷与丙酮反应生成的甲基吡喃花色苷。
3 结论
采用正交实验法优化了制备甲基吡喃花色苷的最佳反应条件,影响产物得率的主要因素依次是pH、葡萄皮红色素提取物浓度、反应物比例、反应温度。花色苷在丙酮介质中反应合成甲基吡喃花色苷的最佳条件为:反应物比例(葡萄红色素提取物mg∶丙酮mL)为15∶1,葡萄皮红色素提取物浓度2.5mg/mL,反应温度45℃,体系pH为3.0,在该条件下,甲基吡喃花色苷产物得率为49.4%。利用高效液相色谱串联离子阱多级质谱结合特征吸收光谱分析鉴定了反应主要产物为甲基吡喃锦葵花色苷。

图9 花色苷与丙酮反应生成物的HPLC-MS图谱(a)、峰1的一级(b)和二级(c)质谱图Fig.9 HPLC-MS chromatograms(a)of the anthocyanin-acetone adducts and MS1(b)and MS2(c)fragmentation scheme for peak 1
[1]Di Majo D,La Guardia M,Giammanco S,et al.The antioxidant capacity of red wine in relationship with its polyphenolic constituents[J].Food Chemistry,2008,111(1):45-49.
[2]于斌,余小平,易龙,等.黑米花色苷抑制人乳腺癌细胞促血管生成因子表达的机制[J].营养学报,2010(6):545-550.
[3]蔡花真,王霞.紫甘薯花色苷组分抑制小鼠肝、肾、心、脾脂质过氧化的研究[J].食品工业,2009(4):6-8.
[4]何静仁,邝敏杰,邓莉,等.膳食花色苷衍生物家族的结构及其形成机制[J].中国农业科学,2013,46(2):343-355.
[5]De Freitas V,Mateus N.Formation of pyranoanthocyanins in red wines:A new and diverse class of anthocyanin derivatives[J].Analytical and Bioanalytical Chemistry,2011,401(5):1463-1473.
[6]Rentzsch M,Schwarz M,Winterhalter P.Pyranoanthocyanins-An overview on structures,occurrence,and pathways of formation[J].Trends in Food Science&Technology,2007,18(10):526-534.
[7]Lu Y,Sun Y,Foo L Y.Novel pyranoanthocyanins from black currant seed[J].Tetrahedron Letters,2000,41(31):5975-5978.
[8]He J,Santos-Buelga C,Silva A M S,et al.Isolation and structural characterization of new anthocyanin-derived yellow pigments in aged red wines[J].Journal of Agricultural and Food Chemistry,2006,54(25):9598-9603.
[9]Giusti M,Wrolstad R E.Characterization and measurement of anthocyanins by UV-Visible spectroscopy[J].Current Protocols in Food Analytical Chemistry,2001(8):1-13.
[10]Wrolstad R E,Durst R W,Lee J.Tracking color and pigment changes in anthocyanin products[J].Trends in Food Science&Technology,2005,16(9):423-428.
[11]李洋,张媛,李琳,等.蛇莓果实总花色苷含量测定方法的比较[J].化学研究,2011,22(5):95-98.
[12]刘传菊,戚向阳,任献忠,等.杨梅花色苷的提取分离研究[J].中国食品学报,2009,9(1):59-64.
[13]孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[14]Hayasaka Y,Asenstorfer R E.Screening for potential pigments derived from anthocyanins in red wine using nanoelectrospray tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry,2002,50(4):756-761.
