抗肿瘤19肽在大肠杆菌中的融合表达与纯化
2014-07-25孙旸,迟惠,王聪,陈光
孙 旸,迟 惠,王 聪,陈 光
(吉林农业大学生命科学学院,吉林长春 130118)
抗肿瘤19肽为肿瘤抑素(tumstatin)靠近C端的185~203位氨基酸,具有直接抑制肿瘤细胞增殖和促进肿瘤细胞凋亡的作用[1-2]。运用Westem印迹和亲和层析法,TracyA,shahan等得到19肽的结合受体,发现该肽段是通过与肿瘤细胞表面的CD47/IAp(integrin associated protein)和αvβ3蛋白结合而发挥其作用。它与整合αvβ3、CD47/IAP复合体结合后,引起不同细胞的粘附、趋化以及增生的抑制,但这个肽段与细胞之间的作用却不依赖于CD47,在CD47不存在的情况下,该肽也可以通过与αvβ3蛋白的亚单位结合激活粘着斑激酶(focal adhesion kinase,FAK)和磷脂酸肌醇激酶3(phosphatidylinositol 3 kinase,PI3),PI 3激酶活化,后激活腺苷酸环化酶,从而使细胞内 cAMP 增加[3-5]。
本实验将合成的表达载体pet32a-19肽分别转化到4种不同型号的大肠杆菌中进行诱导表达[7],通过对其蛋白表达量分析筛选出高效表达菌株,然后进行发酵条件的优化,并对其融合抗肿瘤19肽进行纯化及其复性,为下一步抗肿瘤19肽活性实验研究奠定基础。
1 材料与方法
1.1 材料与仪器
重组质粒pet32a-19肽,大肠杆菌 DH5α,BL21,BL21(DE3),BL21(DE3)plysS和 Rosetta(DE3) 由吉林农业大学生物物理实验室保存;酵母提取物(YE)、异丙基β-D硫代半乳糖苷(IPTG)和蛋白胨(OXOID) 购自北京鼎国生物工程有限公司;质粒小量提取试剂盒 购自爱思进公司;实验中所用蛋白分子量标准 购自TaKaRa公司;Ni Sepharose 6 Fast Flow 购自长春百奥技术有限公司;其它试剂 国产分析纯。
DYY-2稳压稳流电泳仪 北京六一仪器厂;Touching 956凝胶成像系统 上海天呈科技有限公司;JY98-3超声波细胞破碎仪 宁波新芝科器研究所。
1.2 高效表达菌株的筛选
将重组质粒pET32a-19肽分别转化到大肠杆菌BL21(DE3)plysS,BL21,BL21(DE3)和 Rosetta(DE3)四种感受态中。分别挑取单菌落接种至液体培养基中振荡培养过夜。将菌液按1%的比例分别接种至LB液体培养基中振荡培养至OD600为0.6时,加入终浓度1mmol/L IPTG进行诱导,继续振荡培养6h。取诱导后菌液离心收集菌体,以诱导空质粒转化菌为阴性对照,取1mL菌液进行 SDS-PAGE电泳,上样量为10μL,检测菌体中蛋白的表达情况[5]。利用1DGelImageProcessingSoftware(Version 5.0.0.16 US)软件对凝胶电泳结果分析,筛选出重组蛋白表达量最高的菌株作为工程菌株。
1.3 表达条件的优化
挑取工程菌株接种于含Amp的LB固体培养基中,37℃倒置培养16h,然后挑取单菌落于含Amp的LB液体培养基中,180r/min振荡培养过夜,作为种子液。按培养基的pH、接种量、IPTG的浓度、IPTG添加时机、诱导温度和诱导时间设置单因素实验[5],诱导表达重组蛋白,每个单因素实验设置3个重复。
1.3.1 培养基的 pH 分别配制 pH 为 5.0、6.0、6.5、7.0、7.5的LB 液体培养基,将种子液按1%的接种量分别接到上述50mL含Amp培养基中,37℃,200r/min振荡培养至 OD600为 0.6时,加 IPTG至终浓度为1mmol/L,37℃,180r/min 继续诱导培养6h。
1.3.2 接种量 将种子液按1%、2%、3%、4%、5%的接种量分别接至pH为7.0的培养基中,其余条件与 1.3.1 相同。
1.3.3 诱导温度 诱导温度分别为 21、25、29、33、37、41℃,其余条件与 1.3.1 相同。
1.3.4 IPTG添加时间 振荡培养至其 OD600达到0.4、0.5、0.6、0.7、0.8 时添加 IPTG,其余条件与 1.3.1相同。
1.3.5 IPTG 的浓度 添加 IPTG 至终浓度为 0.1、0.5、1、1.5、2mmol/L,其余条件与 1.3.1 相同。
1.3.6 诱导时间 分别在 3、4、5、6、7h 后取样,其余条件与 1.3.1 相同。
把上述的1mL菌液进行SDS-PAGE电泳,上样量为10μL,检测重组蛋白的表达情况并通过软件1D Gel Image Processing Software(Version 5.0.0.16 US)进行分析。根据单因素结果,选用L18(37)正交实验表进行实验,将第七个因素做为空白对照,因素水平选择如表1所示。
1.4 融合蛋白可溶性分析
通过最适条件诱导表达融合蛋白,4℃离心收集菌体。在PBS缓冲溶液中超声破碎菌体(400W超声2s间歇4s共100次),4℃离心,分别收集上清和沉淀进行SDS-PAGE电泳检测,上样量为10μL。
1.5 融合蛋白的纯化和复性
4℃离心收集1L诱导菌液的菌体,用PBS缓冲溶液清洗菌体两次,在 buffer1(50mmol/L Tris-HCl,0.2mol/L MEDTA,0.5mol/L NaCl,1%TritonX-100,1mol/L MPMSF,1mg/mL溶菌酶,7%甘油)中超声破碎菌体(400W超声2s间歇4s共100次),4℃离心收集沉淀,用 buffer2(在 buffer1中加入2mol/L的尿素),4℃离心收集沉淀用 buffer3(20mmol/L Tris-HCl,0.5mol/LNaCl,7% 甘 油)洗 涤 沉 淀 两 次,用buffer4(8mol/L 尿素,20mmol/L 磷酸二氢钠,0.5mol/L NaCl)溶解沉淀。4℃ 离心收集上清,用 0.45μm 过滤。因为目的蛋白是带6个组氨酸标签的融合蛋白,进而可按照Ni sepharose 6 Fast Flow使用说明书的操作方法对目的蛋白进行纯化。分别用20mmol/L和40mmol/L咪唑洗涤跟柱子结合的杂蛋白,最后用300mmol/L咪唑洗下目的蛋白,并且收集样品,对样品进行SDS-PAGE电泳检测分析组分的纯度[6]。运用透析的方法进行复性,从5mol/L尿素逐步降低,分别配制透析液PBS含有10%甘油和5mol/L-0mol/L尿素,4℃搅拌分别10h,4℃离心收集上清进行SDS-PAGE电泳检测。
2 结果与分析
2.1 高效表达菌株的筛选
将重组质粒pET32a-19肽分别转化到不同型号的大肠杆菌感受态细胞中,用IPTG诱导,对其诱导后的菌体进行SDS-PAGE蛋白电泳检测,结果如图1,与对照组相比,大约在21ku处出现一条明显的表达条带,与推测的理论值大小相符,说明目的基因在重组菌中得到了表达,后用软件分析结果可知BL21(DE3)菌株表达量最高,大约18mg/L。
2.2 培养基pH的优化
如图2,通过软件分析可知当培养基pH为7.0时重组蛋白的表达量最高,pH为5.0时表达量最小,pH为7.5时表达量开始降低,说明重组菌在培养基pH为7.0时适合表达目的蛋白,而过酸过碱都会影响目的蛋白的表达。
2.3 接种量的优化
如图3,通过软件分析可知,接种量为3%时目的蛋白的表达量最高,接种量继续增加时,目的蛋白的表达量开始下降,而接种量为1%时表达量也很低。
2.4 诱导温度的优化
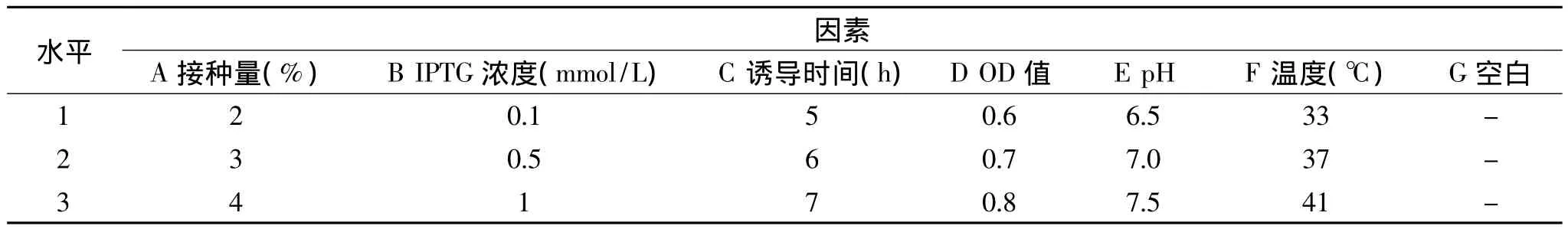
表1 正交实验设计Table 1 Orthogonal experimental design
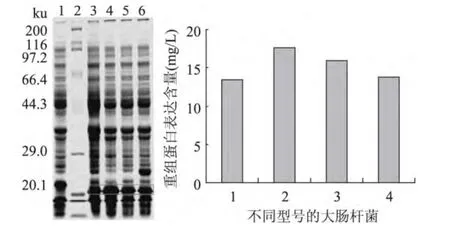
图1 高效表达菌株的筛选Fig.1 The screening of efficient recombinant bacteria
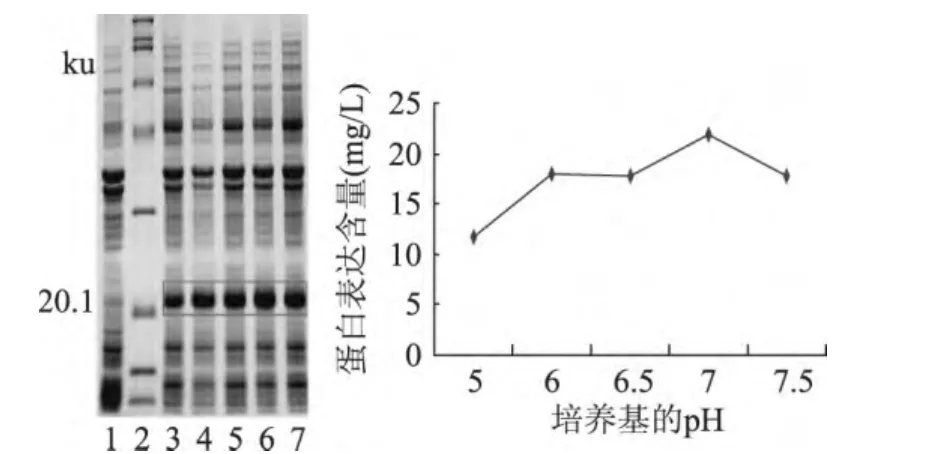
图2 不同pH培养基对重组蛋白表达的影响Fig.2 Influence of pH on the expression of recombinant protein

图3 不同接种量对蛋白表达的影响Fig.3 Influence of inoculation volume on the expression of recombinant protein
过低或过高的温度都会影响菌体的生长与代谢。如图4,在37℃时目的蛋白的表达量最高。
2.5 IPTG添加时间的优化
诱导剂添加时间对目的蛋白的表达有很大的影响,如图5,OD600为0.7时目的蛋白表达量最高。过早或过晚添加IPTG都会影响目的蛋白的表达。
2.6 IPTG添加浓度的优化
不同浓度的IPTG对目的蛋白表达有一定的影响,如图6。在1.0mmol/L时目的蛋白的表达量最高,随着浓度增加目的蛋白的表达量开始减少,因为高浓度的IPTG会对菌体产生毒副作用。

图4 不同温度对重组蛋白表达的影响Fig.4 Influence of induction temperature on the expression of recombinant protein
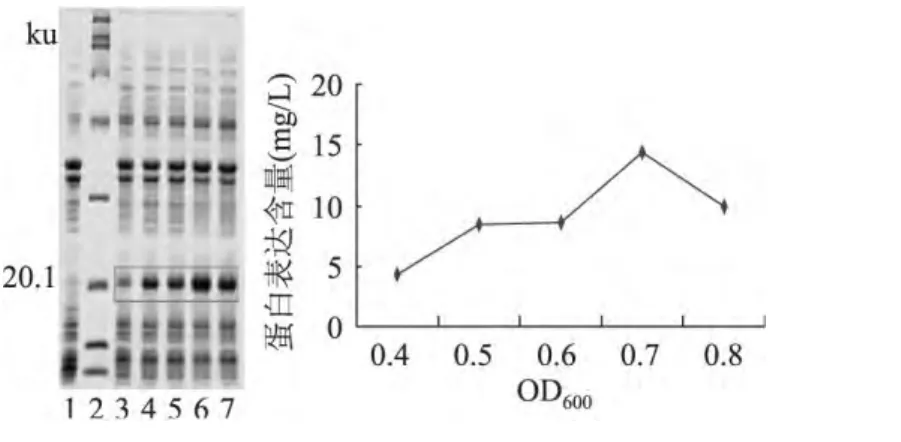
图5 不同IPTG添加时间对重组蛋白表达的影响Fig.5 Influence of induced opportunity on the expression of recombinant protein
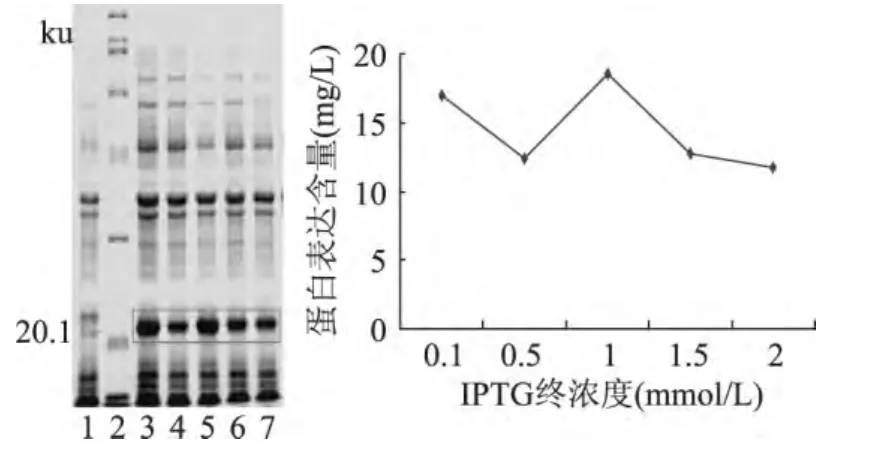
图6 不同IPTG浓度对重组蛋白表达的影响Fig.6 Influence of concentration of IPTG on the expression of recombinant protein
2.7 诱导时间的优化
诱导时间长短对目的蛋白表达量有一定的影响,如图7,软件分析可知,诱导后3h到6h,目的蛋白的表达量逐渐上升,在诱导6h后表达量达到最高,之后由于菌体的衰老,合成能力开始降低,甚至代谢产生出有害的产物,目的蛋白表达量逐渐下降。
2.8 正交实验结果
采用七因素三水平正交表设计正交实验,实验结果如图8,采用1D Gel Image Processing Software(Version 5.0.0.16 US)软件分析,结果见表 2。根据极差分析由表3可知,在六个因素中因素F影响最大,C、E、A、B、D的影响依次减小。从正交结果中来看,A2B1C1D2E2F3表达量最高,可以达到54.57mg/L。根据极差和方差的影响大小选取的组合条件为A2B3C1D3E2F3,考虑IPTG具有一定的毒性和成本高,OD600的影响是最小的,所以选用A2B1C1D2E2F3作为最优发酵条件。

表2 正交实验结果Table 2 Orthogonal experiment results
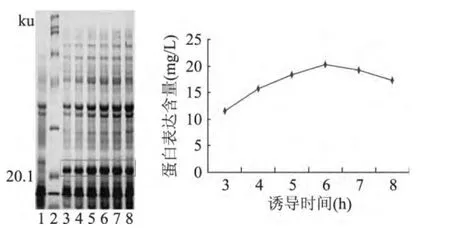
图7 不同诱导时间对重组蛋白表达的影响Fig.7 Influence of induced time on the expression of recombinant protein
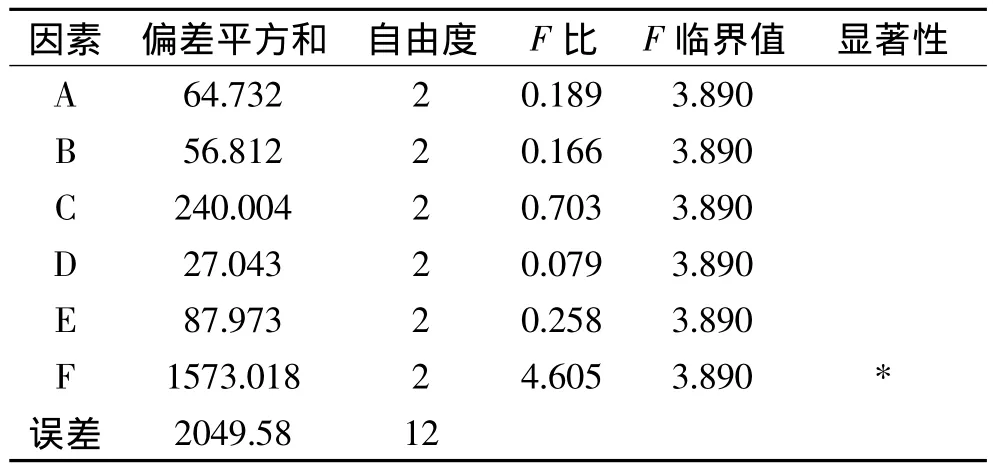
表3 正交设计方差分析表Table 3 Variance analysis of orthogonal arrayfor fermentation condition

图8 正交实验结果SDS-PAGE电泳鉴定Fig.8 Identification of orthogonal experimental results by SDS-PAGE
2.9 融合蛋白可溶性分析
如图9所示,重组蛋白主要存在于超声后的沉淀中,因此主要以包涵体形式进行表达。
2.10 融合蛋白的纯化和复性

图9 重组蛋白可溶性SDS-PAGE分析Fig.9 The analysis of recombinant soluble protein by SDS-PAGE
超声破碎菌体,洗涤包涵体,再经8mol/L尿素溶解,经Ni sepharose 6 Fast Flow亲和层析柱纯化,纯化出的蛋白通过梯度透析方法进行复性。SDSPAGE电泳显示(图10),纯化出的融合抗肿瘤19肽纯度很高,运用软件分析纯度达到95%。目的蛋白复性可能造成一定量的损失,目的蛋白浓度降低,从图11中可以看出复性后的蛋白没有被降解或形成二聚体。

图10 重组蛋白的纯化Fig.10 Recombinant protein purification results by SDS-PAGE

图11 重组蛋白的复性Fig.11 Recombinant protein purification refolding results by SDS-PAGE
3 结论与讨论
为了获得大量的重组蛋白,不仅要选择理想的表达载体和宿主菌,还需要优化诱导表达条件。不同型号的大肠杆菌促进合成的代谢产物是有区别的,所以表达的目的蛋白含量也不相同,用重组质粒转化到不同型号的大肠杆菌,才能找出最适合表达目的蛋白的工程菌株。本实验通过将重组质粒pET32a-19肽分别转化到不同型号的大肠杆菌中,筛选出高效表达菌株pET32a-19肽-BL21(DE3),在没有优化诱导表达条件的情况下就可以达到18mg/L。BL21(DE3)是一种常规表达宿主菌,可以保护lon和ompT蛋白酶对目的蛋白酶的降解,而且是最常用的表达宿主菌。BL21(DE3)菌株不具有抗生素的抗性,可以节约成本。何莉,鲜尽红等人用重组工程菌pET32a-CR1-SCR15-18/BL21(DE3)在高密度发酵中得到了,菌体产量为40g/L,CR1-SCR15-18蛋白表达率为28%[13]。因此,可以从高密度发酵来提高融合抗肿瘤19肽的表达量。
工艺研究不同pH的培养基会影响菌体的生长状态或菌体本身的酶促反应,从而使重组蛋白的表达量出现差异[7-8]。接种量过少时菌体繁殖缓慢,导致整个生长周期变长,当接种量过多时导致菌体生长过快,对培养基中营养及溶氧的消耗加速,都不利于目的蛋白的表达。微生物在发酵过程中伴随着很多酶促反应,来控制菌体的生长及代谢产物的合成,所以温度对于发酵是很重要的因素。过早添加IPTG会影响细菌的增殖,菌体的量相对较少,导致蛋白的表达量低;过晚添加IPTG,菌体处于稳定期或后期,培养基的营养成分和氧气量降低,并且代谢速度减慢,合成物质的能力降低,蛋白的表达量降低[9-10]。IPTG具有毒性,而且价格比较高,过高会影响菌体的生长代谢,过少会对菌体的诱导力度不够,从而影响目的蛋白的表达,所以要选择合适的IPTG添加浓度[11-12]。通过对工程菌株在接种量、培养基的 pH、温度、IPTG浓度、诱导时间和IPTG添加时间六个影响因素上进行发酵条件的优化,筛选出最适合工程菌株的发酵条件为培养基的pH为7.0、接种量为3%、IPTG 浓度 0.1mmol/L、IPTG 添加时间 OD600为 0.7、诱导温度为41℃和诱导时间5h,通过软件分析重组目的蛋白的表达量高达54.57mg/L。摇瓶发酵产重组蛋白的量是有限的,应继续进行高密度发酵。
原核诱导表达重组蛋白,形成的包涵体可以减少蛋白酶对其降解和提高表达产量,通过对其包涵体进行不同方式的洗涤,更利于分离目的蛋白。在洗涤包涵体的过程中加入了2mol/L的尿素、1%TritonX-100和EDTA洗去可溶的粘附的细菌蛋白,通过不同溶液洗涤,得到了较高纯度的包涵体,有利于之后的蛋白纯化。pET32a质粒带有组氨酸标签,可以运用亲和层析的方法纯化目的蛋白,方便简单。因此pET32a-19肽-BL21(BE3)表达的融合蛋白可以通过Ni sepharose 6 Fast Flow亲和层析柱纯化,得到目的蛋白,运用软件分析纯度达到95%。透析对于蛋白复性来说是比较稳定和有效的方法,但其缺点是需要大量的透析液。运用梯度透析的方法,复性了纯化出的目的蛋白,但在复性过程中出现了少量的沉淀,可能是蛋白复性过程中错误折叠,使复性出的蛋白减少,有部分蛋白被复性成功。为以后的抗肿瘤融合19肽的活性实验奠定了基础。
[1]王淑静,张艺,刘佳,等.肿瘤抑素抗肿瘤活性肽的研究进展[J].中国肿瘤,2012,21(1):56-59.
[2]Maeshima Y,Manfredi M,Reimer C,et al.Identification of the anti-angiogenic site with in vas cular basement membrane derived tumstatin[J].J Biol Chem,2001,276(18):15240-15248.
[3]FloquetN,Pasco S,RamontL,etal.The antitumor propertiesof the α3(IV)- (185 - 203)peptide from the NC1 domain of type IV collagen(tumstatin)are conformationdependent[J].J Biol Chem,2004,279(3):2091-2100.
[4]Folkman J.Tumor suppression by p53 is mediated in part by the antiangiogenic activity of endostatin and tumstatin[J].Sci STKE,2006,2006:pe35
[5]Y Hamano,R Kalluri.Tumstatin the NC1 domain of a3 chain of type IV collagen,is an endogenous inhibitor of pathological angiogenesis and suppresses tumor growth,Biochem[J].Biophys Res Commun,2005,333(2):292-298.
[6]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].第3版.北京:科学出版社,2002:1256-1259.
[7]沈宝明,谭新球,谭周进,等.影响工程菌株目的基因表达的因素[J].生物技术通报,2010(3):6-12.
[8]关瑜,陈欢,李旭媛,等.类人胶原蛋白表达的优化与纯化的研究[J].食品工业科技,2012,33(14):217-220.
[9]戎晶晶,刁振宇,周国华.大肠杆菌表达系统的研究进展[J].药物生物技术,2005,12(6):416-420.
[10]黎名元,郭新民,乔传令.重组大肠杆菌高密度培养研究进展[J].微生物学杂志,2006,26(6):55.
[11]杨炜,王伟刚,田海英,等.重组大肠杆菌高表达高密度发酵研究[J].生物技术,2006,16(3):83-86.
[12]任增亮,堵国成,陈坚,等.大肠杆菌高效表达重组蛋白策略[J].中国生物工程杂志,2007,27(9):103.
[13]何莉,鲜尽红,刘高科,等.重组工程菌 pET32a-CR1-SCR15-18/BL21(DE3)高密度发酵工艺研究[J].第三军医大学,2011,33(9):896-899.
