米曲霉发酵米糠制取米糠多肽及其抗氧化活性研究
2014-07-25薛正莲赵世光钱森和
魏 明,薛正莲,赵世光,钱森和
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
米糠是大米加工的副产品,我国米糠年产量超过一千万吨,但米糠有效利用率尚不足20%。米糠中蛋白质含量为12%~18%,是大米的一倍[1]。多肽是蛋白质水解的产物,具有抗氧化、降血压、降低胆固醇含量以及促进钙吸收等功能[2-5]。米糠蛋白是一种优质蛋白,其水解的多肽具有重要生理功能。研究表明,大米蛋白的碱性蛋白酶水解产物能抑制血管紧张素转化酶(AEC)的活性[6]。有学者从米糠蛋白的蛋白酶水解产物中分离出了类阿片拮抗肽[7]。
目前,米糠多肽主要通过酶法水解米糠蛋白获得,且不同的酶水解所获得的活性肽不同[8]。采用微生物发酵生产米糠多肽的研究报道较少。微生物在培养过程中可以产生各种蛋白酶,使蛋白质降解,提高多肽的产率,并且获得功能更多的小肽[9-10]。另外,利用微生物发酵生产米糠多肽可以降低生产成本,适于工业化生产。本研究通过微生物发酵生产米糠多肽,并分析多肽分子量分布规律及其活性,为米糠蛋白的深度开发和利用奠定基础。
1 材料与方法
1.1 材料与仪器
米糠来源南陵大米加工厂。
葡聚糖凝胶G-25 Pharmacia公司;辅酶Ⅰ、谷胱甘肽、Gly-Gly-Tyr-Arg四肽 Sigma公司;三氯乙酸、DPPH、H2O2、邻二氮菲、硫酸亚铁、氢氧化钠、硫酸铜、水杨酸、乙醇,酪氨酸 国药集团试剂公司,为分析纯。
菌种与培养基:米曲霉(Aspergillus oryzae,AS3.951)中国科学院微生物保藏中心,种子培养基(PDF):马铃薯汁1000mL,葡萄糖20g,自然pH。发酵培养基:米糠溶液添加KH2PO4和MgSO4121℃灭菌20min。
754紫外可见分光光度计,YX5-A台式离心机 上海仪器有限公司;HZ-9310KB恒温摇床,HH-4恒温水浴锅 江苏杰瑞尔电器有限公司。
1.2 实验方法
1.2.1 米糠预处理 米糠→脱脂→干燥→粉碎过20目筛备用。
1.2.2 种子液的制备和米糠发酵 将菌种在PDF斜面培养基上活化,然后从斜面挑取孢子接种至PDF液体培养基中,于28℃下培养72h后备用。以米糠为基本培养基,250mL三角瓶,每瓶装液量为100mL,米糠添加量为5g,按体积分数接种米曲霉种子液,120r/min摇床培养。将发酵液于5000r/min离心10min,上清液经0.45μm微孔滤膜过滤,滤液分成两份,一份测定多肽含量,另一份测定发酵液的蛋白酶活力。
1.2.3 米曲霉发酵米糠单因素实验 固定接种量5%、pH6、培养温度28℃和培养时间48h,在其他条件不变的情况下,以蛋白酶活力和多肽含量为指标,选取培养时间为72h,在不同时间段测定蛋白酶活力和多肽含量,接种量为1%、5%、10%、15%、20%、25%,培养温度为 20、25、30、35、40、45℃,起始 pH 为5.0、5.5、6.0、6.5、7.0、7.5、8.0 进行单因素实验,每组实验进行3次平行。
1.2.4 米曲霉发酵米糠工艺优化实验 根据Box-Benhnken的中心组合实验设计原理,综合单因素实验结果,选取发酵时间、发酵温度、接种量影响显著的3个因素,在单因素实验基础上采用三因素三水平的响应面分析方法,因素与水平见表1。
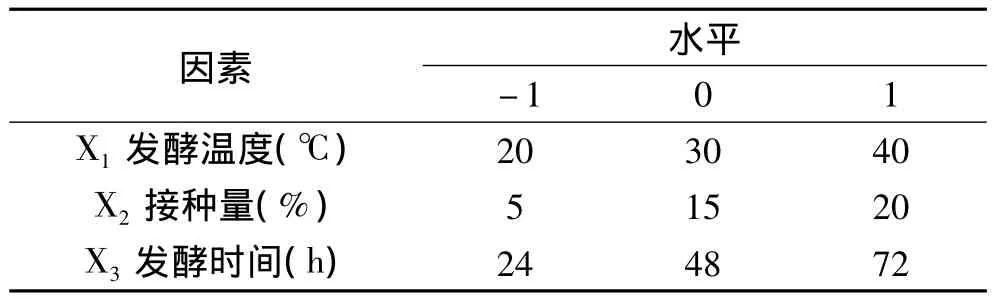
表1 因素水平编码表Table 1 Encode table of factor and levels
1.2.5 蛋白酶活力和多肽的测定 蛋白酶活用Folin法测定[11],酶活力定义为:每mL发酵液每分钟催化产生1μg酪氨酸所需的酶量为 1个酶活单位U(μg/mL·min)。
多肽含量测定用三氯乙酸法[12],配制 Gly-Gly-Tyr-Arg四肽标准溶液,以肽的浓度为横坐标X(mg/mL),OD值为纵坐标Y,制作标准曲线,得到回归方程y=0.0368x+0.003,R2=0.9993。将等体积的三氯乙酸(10%)加入到发酵液中,静置10min,然后在5000r/min下离心15min,在上清液中加入一定量的双缩脲试剂(样液∶双缩脲试剂 =3∶2,V/V),于漩涡混合仪上混合均匀,静置10min,2000r/min离心10min,取上清液于540nm下测定OD值,对照标准曲线求得样品溶液中的多肽量。米糠多肽含量(mg/g)=发酵液中多肽量/米糠质量。
1.2.6 米糠多肽的分子量测定 米糠多肽分子量测定参照文献[13]略作改动。米糠发酵上清液经超滤膜过滤后(截留分子量大于2000u),取1mL滤液上柱(SephadexG-25),以蒸馏水为洗脱液,洗脱速度为40mL/h,用自动部分收集器收集洗脱液,每管收集3mL,在 238nm处检测流出液。以辅酶Ⅰ(MW 663.45),Gly-Gly-Tyr-Arg(MW 451.48),谷胱甘肽(MW 307.32)为参照物,标准分子量的常用对数与管数之间的关系曲线为:n=374.2-122.6logMW。
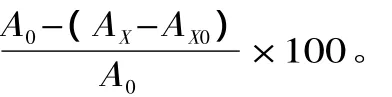
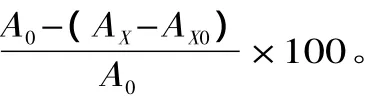
1.3 数据处理
原始数据采用 origin8.5完成,实验数据采用PPS7.01软件进行统计分析;采用Design Expert 7.1.6软件对中心组合设计实验数据进行回归分析。每组实验做三次平行实验,图中的数据为平均值±标准差。
2 结果与分析
2.1 发酵时间对米曲霉产蛋白酶和多肽含量的影响
从图1可以看出,在发酵16h之前,蛋白酶活力很低,40~48h时,酶活力趋于稳定,平均酶活力为92.6U,48h后,酶活力逐渐下降。在16h之前,多肽含量很低,48h达到最大,之后多肽含量增加缓慢。米曲霉接种到培养基中要经过延迟期、对数生长期、稳定期和衰退期等阶段。在延迟期米曲霉生长缓慢,产酶量很低,达到40h后,米曲霉进入稳定期,产酶能力最佳,衰退期产酶量降低。多肽含量与蛋白酶密切相关,在延迟期蛋白酶产量很低,多肽含量也很低,随着产酶量的增加,多肽含量也增加,在发酵后期,多肽含量降低,可能培养时间过长,多肽被微生物消耗,因此发酵最佳时间为48h,此时多肽含量为112.2mg/g。
2.2 接种量对米曲霉产蛋白酶和多肽含量的影响
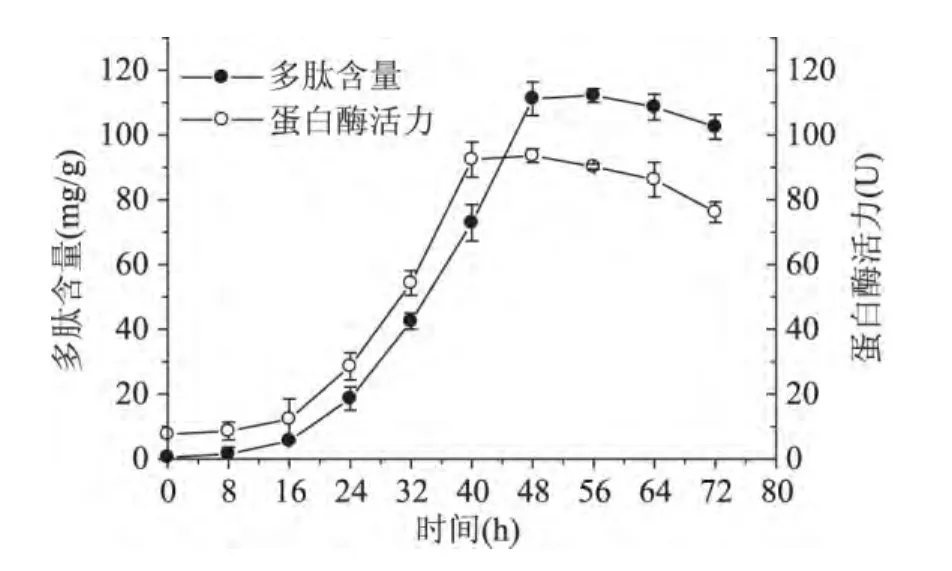
图1 培养时间对米曲霉产蛋白酶和多肽含量的影响Fig.1 Effect of culture time on protease activity and peptide content in rice bran during fermentation
从图2可以看出,随着接种量的增加,蛋白酶活力和多肽含量均增加,当接种量为15%时,蛋白酶活力和多肽含量达到最大,分别为96.5U和121.6mg/g,继续增加接种量蛋白酶活力和多肽含量有所下降,这是由于接种量过高,发酵前期菌体生长过快,导致发酵后期营养不足而使菌体自溶,使多肽含量降低,因此接种量15%较为适宜。
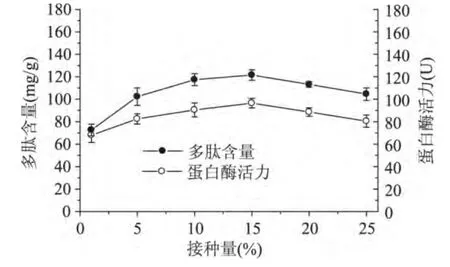
图2 接种量对米曲霉产蛋白酶和多肽含量的影响Fig.2 Effect of inoculum size on protease activity and peptide content in rice bran during fermentation
2.3 培养温度对米曲霉产蛋白酶和多肽含量的影响
从图3中可以看出,随着温度的升高,蛋白酶活性升高,多肽含量也提高。当温度达到30℃时,多肽含量达到122.8mg/g;继续升高温度,蛋白酶活力降低,多肽含量也降低,所以培养温度30℃为宜。
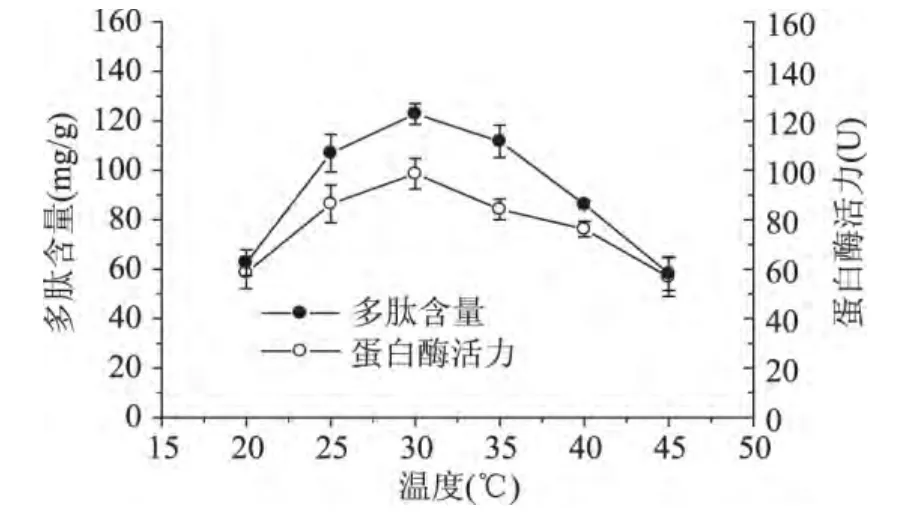
图3 温度对米曲霉产蛋白酶和多肽含量的影响Fig.3 Effect of temperature on protease activity and peptide content in rice bran during fermentation
2.4 起始pH对米曲霉产蛋白酶和多肽含量的影响
由图4可知,随着pH的升高,蛋白酶活性增加,多肽含量也有所提高。当pH为5.5时,多肽含量最高为121.4mg/g,继续提高pH,多肽含量降低,可能pH升高降低蛋白酶活性,从而影响多肽的产生。
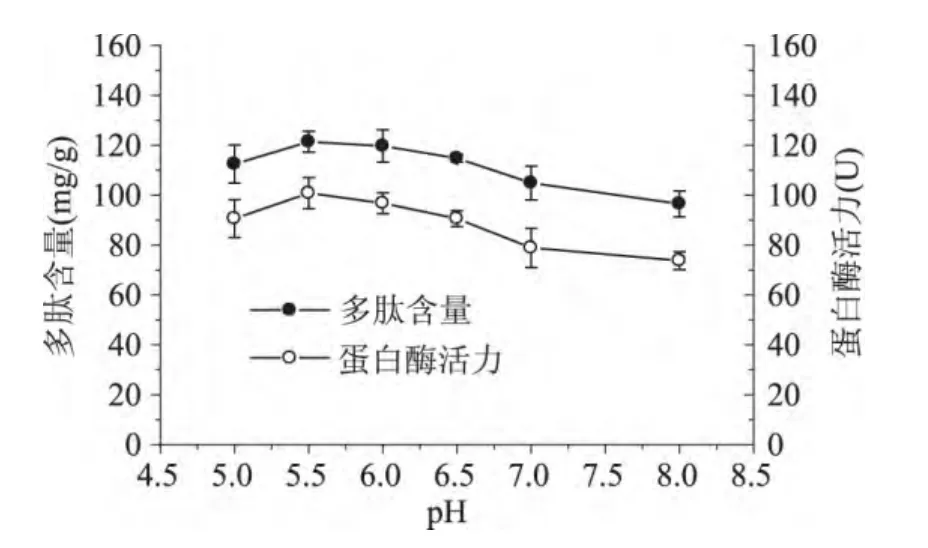
图4 pH对米曲霉产蛋白酶和多肽含量的影响Fig.4 Effect of pH on protease activity and peptide content in rice bran during fermentation
2.5 响应面优化实验
2.5.1 响应面实验设计及结果 选用中心组合模型,做3因素3水平共15个实验点的响应面分析实验。15个实验点分为两类:1~12个是析因点;13~15个是零点,为区域的中心点,零点实验重复3次,用以估计实验误差。米糠多肽含量为响应值,实验结果见表2。
根据表2的实验结果,采用Design Expert 7.1.6软件对实验数据进行回归分析,求出影响因素的一次效应、二次效应及其交互效应的关联方程,对米糠多肽的影响因素进行更深入的研究和条件优化,并做出响应面图。多元回归拟合分析得到米糠多肽含量与各因素变量的二次方程模型为:米糠多肽含量Y=130.2+7.743X1- 2.152X2+2.113X3- 1.385X1X2-2.672X1X3-1.914X2X3-2.155X12-1.175X22-2.161X32从方差分析表3可以看出,用上述回归方程描述各因素与响应面之间的关系,其因变量和全体自变量之间的线性关系显著,其中发酵时间和温度显著,接种量不是很显著。从回归方程各项的方差分析结果还可以看出,可用该回归方程代替实验真实点对实验结果进行分析和预测。
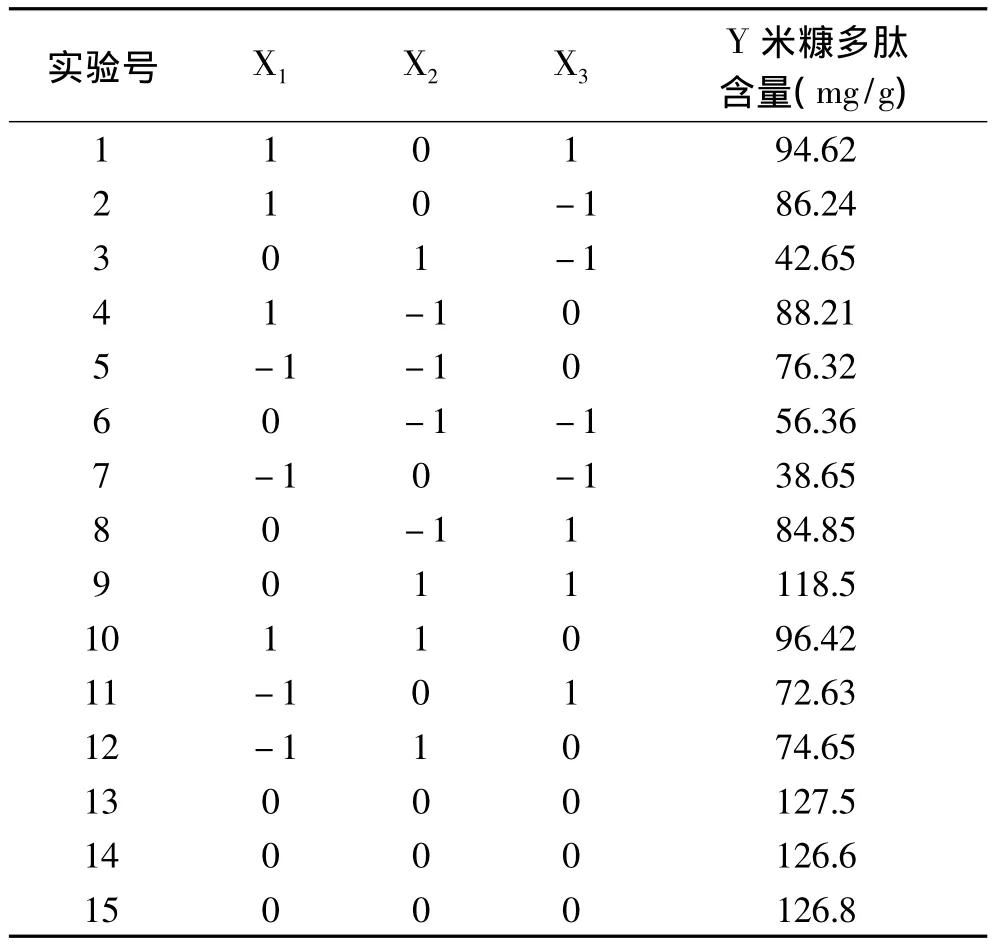
表2 响应面分析试验设计及结果Table 2 Response surface design and results
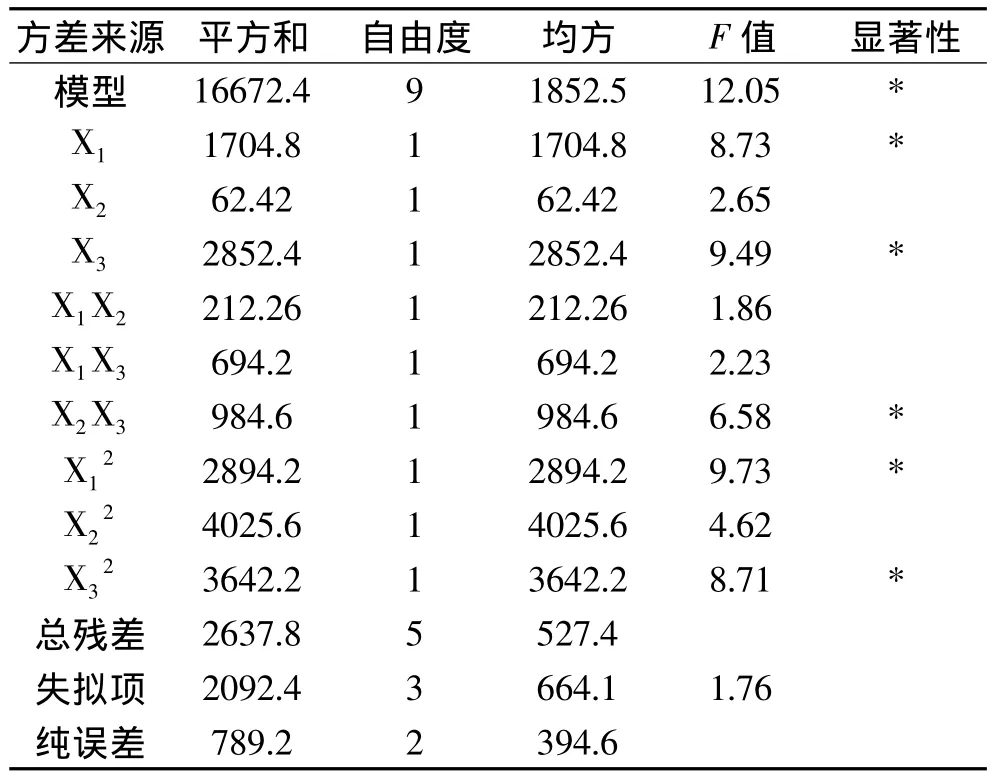
表3 方差分析表Table 3 The analysis of variance table
2.5.2 响应面曲面分析 图5直观地反映了各因素对响应值的影响,比较图5中的3个图可知:发酵温度X1、发酵时间X3对米糠多肽得率的影响显著,表现为曲线相对较陡;而接种量X2表现为曲线较为平滑,响应值变化较小。发酵时间和温度以及发酵时间和接种量之间有交互作用,其中发酵时间和接种量之间的交互作用显著(p<0.05)。
根据所得的模型,可预测在稳定状态下的最优工艺条件为:发酵时间为48.6h,发酵温度为29.5℃,接种量为14.6%,米糠多肽含量理论可达到129.5mg/g。进行3次平行实验验证,米糠多肽平均含量为128.4mg/g,与理论预测值接近,说明优化结果可靠。
2.6 米糠发酵多肽的分子量分布
采用超滤和SephadexG-25进行层析分离发酵液,分子量参照物与发酵液层析结果如图6所示。根据标准曲线,由出峰管数推测出分子量分布范围,并采用面积归一法对不同分子量肽的含量进行定量分析,结果见表4。由图6B和表4可知,米曲霉发酵米糠过程中,在发酵液中存在大小不等的多肽,分子量主要集中在500~800u之间,含量为75.6%,其中峰Ⅰ的平均分子量为1221u,峰Ⅱ的平均分子量为682u,峰Ⅲ的平均分子量为638u,峰Ⅳ的平均分子量为578u。
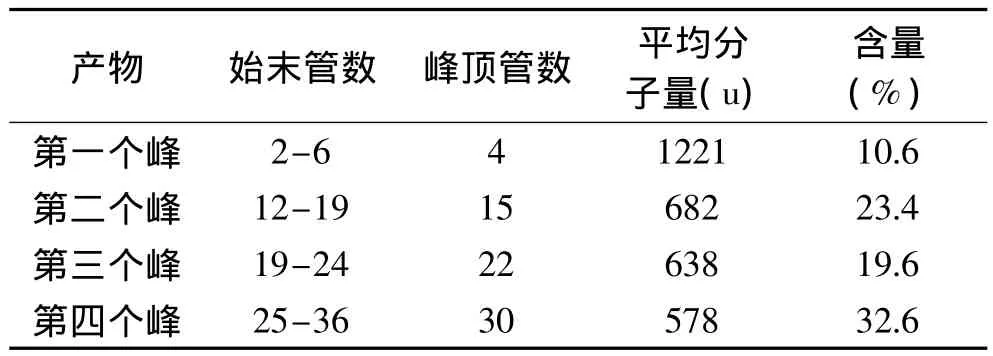
表4 米糠发酵液中多肽分子量分布Table 4 Distribution of peptides from rice bran
2.7 羟基自由基清除能力
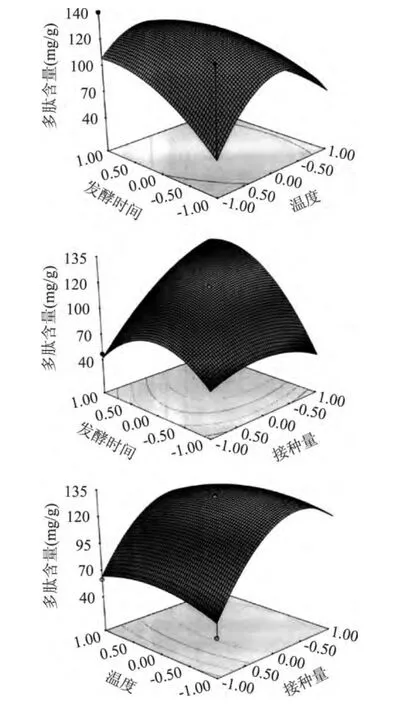
图5 两因素交互作用对多肽含量影响的响应面图Fig.5 Surface layer of the mutual-affection of two factors on peptides
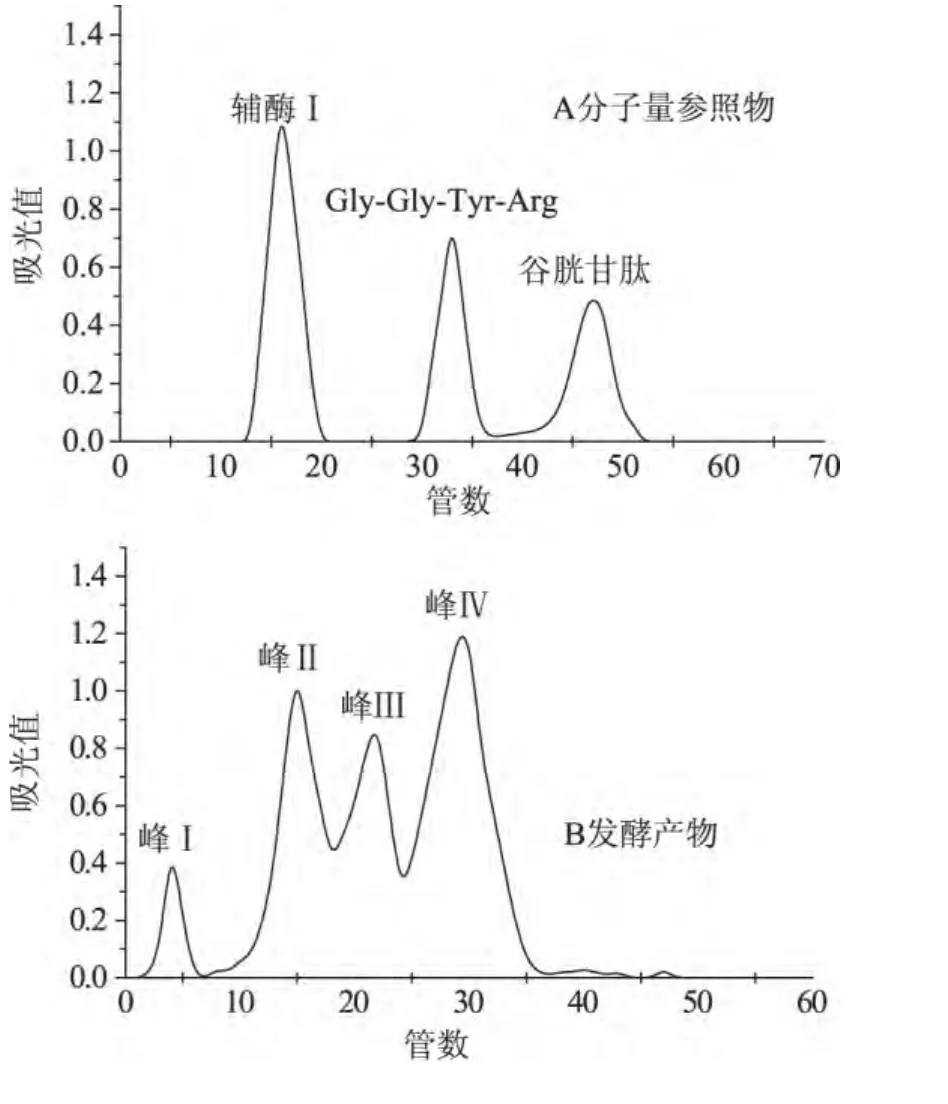
图6 米糠发酵多肽层析图谱Fig.6 Chromatogram of peptides from rice bran
羟基自由基清除能力如图7所示。分离的四种米糠多肽均具有清除羟基自由基的能力。随着多肽浓度的增加,样品对羟基自由基的清除率也随之增加,当多肽浓度达到2.5mg/mL时,峰Ⅱ所获得的多肽对羟基自由基的清除率达到86.2%,但低于对照VC的清除率。
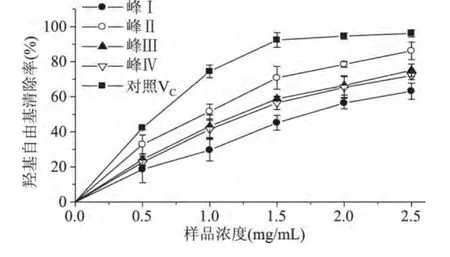
图7 米糠多肽羟基自由基清除能力Fig.7 The scavenging effects of peptides from rice bran on·OH
2.8 DPPH自由基清除能力
米糠多肽的DPPH清除能力如图8所示。从图8可以看出,分离的四种米糠多肽均具有一定的DPPH清除能力,其中峰Ⅳ所获得的多肽效果最好,随着多肽浓度的增加,样品对DPPH自由基清除率也随之增加,当多肽浓度为2.5mg/mL时,峰Ⅳ所获得的多肽对DPPH的清除率达到69.8%,但低于对照VC的清除率。
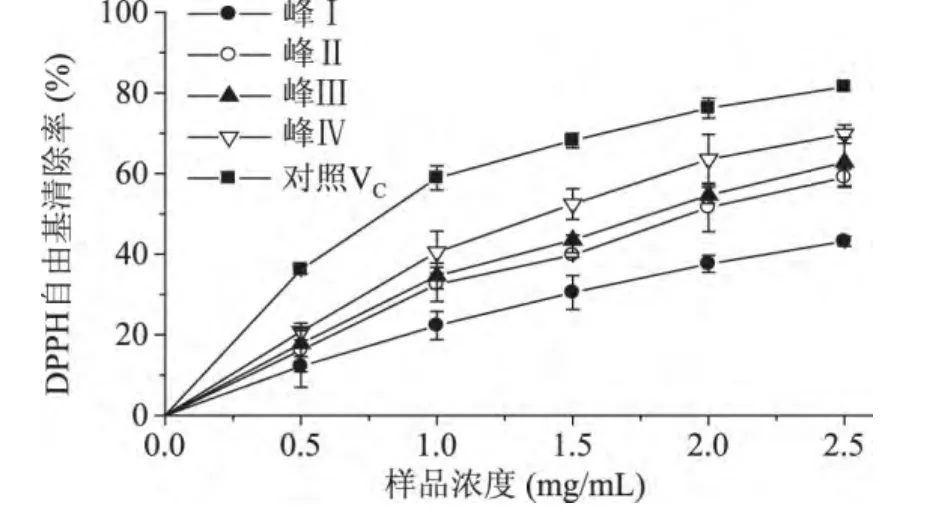
图8 米糠多肽DPPH自由基的清除能力Fig.8 The scavenging effects of peptides from rice bran on DPPH·
3 结论
利用米曲霉发酵米糠生产多肽,通过响应面优化,发酵米糠生产多肽的最佳条件为:米曲霉的接种量为14.6%,发酵时间为48.6h,发酵温度为29.5℃,发酵起始pH为5.5,多肽含量可达128.4mg/g。米曲霉发酵米糠产生多肽分子量主要分布在500~800u之间,含量在75.6%,对羟基自由基和DPPH自由基均具有一定清除能力。
[1]姚惠源,周素梅,王立,等.米糠与米糠蛋白质的开发与利用[J].无锡轻工业大学学报,2002,21(3):312-316.
[2]刘海军,乐超银,邵伟,等.生物活性肽研究进展[J].中国酿造,2010,29(5):5-8.
[3]朱银玲,刘华忠,李思东,等.酶解法制备方格星虫多肽及其抗氧化作用研究[J].化学研究与应用,2012,24(9):1397-1401.
[4]张淑蓉,武瑜,梁叶星,等.南瓜籽仁蛋白多肽的酶法制备和抗氧化活性研究[J].食品工业科技,2012,33(3):241-244.
[5]刘树兴,乔晓林.木瓜蛋白酶酶解谷朊粉制备抗氧化多肽的研究[J].食品工业科技,2013,34(21):167-173.
[6]Li CH,Liu H,Shi YH,et al.Direct spectrophotometric measurement of angiotensin I-converting enzyme inhibitory activity forscreening bioactive peptides[J].Journalof Pharmaceutical and Biomedical Analysis,2005,37(2):219-224.
[7]陈季旺,陶冠军,姚惠源.米糠蛋白类阿片拮抗肽的分离纯化[J].食品科学,2004,25(12):47-50.
[8]刘友明,赵思明,熊善柏,等.米糠的蛋白酶水解提取物抗氧化活性及分子量分布研究[J].中国粮油学报,2006,21(2):1-4.
[9]刘姝,余勃.发酵法制备鱼鳔多肽及其抗氧化活性研究[J].食品科学,2009,30(21):332-334.
[10]吴海滨,刘尊英,曾名湧,等.米曲霉发酵鳕鱼皮制取低分子肽条件的优化及活性研究[J].食品与发酵工业,2011,37(5):110-114.
[11]房耀维,刘姝,徐炜枫,等.一株有机溶剂稳定性蛋白酶产生菌的筛选与鉴定[J].食品科学,2009,30(7):197-201.
[12]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[13]云霞,朱蓓薇,吴海涛,等.玉米黄粉蛋白酶解过程的研究及产物分析[J].食品科学,2003,24(5):75-78.
[14]Smirnoff N,Cumbes QL.Hydroxygyl radical scavenging activity of compatible solutes[J].Phytochemistry,1989,28(4):1057-1060.
[15]Blois MS.Antioxidant determinations by the use of a stable free radical[J].Nature,1958,118(4):1199-1200.
