热稳定性脂肪酶生产菌的筛选及其酶学性质研究
2014-07-25陈吉祥李彦林刘元利张庆芳
王 颖,陈吉祥,王 冰,杨 智,李彦林,刘元利,张庆芳
(兰州理工大学石油化工学院,甘肃兰州 730050)
脂肪酶(EC.3.1.1.3)又称三酰甘油酰基水解酶,是一类水解长链脂肪酸甘油酯生成脂肪酸和甘油的界面酶,可催化油脂的选择性水解及其它酯类的转酯、氨解等反应,被广泛应用于食品加工、新型生物材料合成、精细化工、去污剂、皮革加工和造纸等诸多领域[1-2]。由于在非水相体系中具有良好的酯化、转酯、醇解和氨解特性,脂肪酶还被广泛用于不对称合成,外消旋体拆分制备手性化合物等,在药物合成领域有广阔应用前景[3-4],20世纪 90年代许多学者开始研究用生物酶法制备生物柴油,开发出多种脂肪酶代替化学催化剂化学转化的过程[5-6]。
脂肪酶广泛存在动物、植物和微生物中。而微生物来源的脂肪酶种类最多,广泛存在于细菌、酵母和霉菌中,易于大规模生产,具有比动植物脂肪酶更广的pH、温度适应性,因此是工业用脂肪酶的重要来源。目前已报道产脂肪酶的真菌主要有黑曲霉(Aspergillusspp.)、毛 霉 (Mucorspp.)、少 根 根 霉(Rhizopus arrhizus)、米根霉(Rhizopus oryzae)、皱褶假丝酵母(Candida rugosa)、南极假丝酵母(Candida antarctica)、柱状假丝酵母(Candida cylindracea)等。产脂肪酶的细菌包括无色杆菌属(Achromobacter)、产碱杆菌属(Alcaligenes)、节细菌属(Arthrobacter)、芽胞杆菌属(Bacillus)、伯克霍尔德菌(Burkholderia)、色杆菌(Chromobacterium)和假单胞菌属(Pseudomonas)[7-8]。脂肪酶产生菌的筛选工作国内也有大量相关研究,但仍缺少工业化应用的产品。国外脂肪酶价格昂贵,寻找活性高、稳定性好、易分离纯化的脂肪酶就成为促进酶法生产生物柴油产业发展的研究热点。本文从含油废水、农田以及被石油污染的土壤等不同来源样品中筛选得能产生脂肪酶的菌株并进行培养条件优化,酶学性质的研究,为脂肪酶的应用提供了新思路。
1 材料和方法
1.1 材料与仪器
土样 采自甘肃不同地区农田、油脂污染及石油污染土壤;供分离用蛋白胨、酵母粉、Tween-80等 均为国产和进口分析纯;对硝基苯丁酸酯(4-Nitrophenyl butyrate) 天津希恩思生化科技有限公司;限制性内切酶、dNTP、T4 DNA连接酶、Taq DNA聚合酶等 大连宝生物工程有限公司;DNA凝胶回收纯化试剂盒 天根生物工程有限公司;脂肪酶活性检测培养基 蛋白胨 10.0g/L,CaCl2·H2O 0.5g/L,NaCl 10.0g/L,琼脂 15.0g/L,1%Tween-80,pH7.0;LB液体培养基 蛋白胨 10.0g/L,酵母粉5.0g/L,NaCl 10.0g/L,pH7.0。
UV-2102PC分光光度计 尤尼柯上海仪器有限公司;IS-RDH2恒温振荡器 美国精骐有限公司;Neofuge 15R台式高速冷冻离心机 上海力申科学仪器有限公司;TC-96/G/H基因扩增仪 杭州博日科技有限公司;Tanon-3500凝胶图像处理系统 上海天能科技有限公司;MA99-2A自动液相色谱分离层析仪 上海沪西分析仪器厂有限公司;VE-180垂直电泳仪 上海天能科技有限公司;TRACE DSQ气相色谱质谱联用仪 美国热电公司。
1.2 脂肪酶产生菌株筛选及鉴定
称取 10.0g土样加入到 100mL无菌水中,150r/min振荡培养3~4h,使土样中细菌分散于水中,静置30min。取上清液涂于脂肪酶活性检测培养基,30℃恒温培养24h,观察菌落周围晕圈产生情况,挑选晕圈明显的单菌落,经多次分离纯化得到脂肪酶产生菌株。对具有酶活性的菌株再接种于液体LB培养基培养,用橄榄油乳化法[9]和对硝基苯酚法[10]测定脂肪酶活性,筛选出产酶能力高的菌株,-80℃保存。
将筛选菌株接种于LB固体培养基上,37℃培养24~48h,进行菌落形态、革兰氏染色、芽孢染色等,进行细菌形态学观察,并分析生理生化特性,提取细菌基因组 DNA,采用16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG - 3′ 1492R:5′-GGTTACCTTGTTACGACTT-3 ′)进行PCR 扩增,将所得样品送生工生物工程公司测序,将所得的16S rDNA 序 列 与 NCBI(http://blast.ncbi.nlm.nih.gov/blast.cgi)库中的16S rDNA序列进行同源性比较,构建系统进化树。
1.3 酶活力测定
脂肪酶能水解对硝基苯丁酸酯(4-Nitrophenyl butyrate)底物生成丁酸和对硝基苯酚,后者是一种黄色物质在410nm下有光吸收[10]。通过测定酶催化反应生成的黄色对硝基苯酚的量来计算酶活力。具体条件为:1.9mL 反应基质溶液(1.5% 阿拉伯胶、2%Triton X -100、0.3mg/mL 对硝 基 苯 丁 酸 酯 溶 于50mmol Tris-HCl中)和100μL脂肪酶的混合物反应体系,40℃下水浴10min后,410nm下测光吸收值。酶活力单位的定义(U):在给定条件下,每小时释放0.1μmol p-对硝基苯酚所需要的酶量为1U。
1.4 菌株的生长特性及产酶条件优化
将筛选所得菌株接种到LB培养基中,30℃恒温振荡培养,分别在不同时间取发酵液,测菌液OD600确定菌株生长曲线,10000r/min离心10min,取上清液测定脂肪酶活力,确定菌株最佳产酶时间。在不同温度下培养,以确定菌株的最适生长温度及最佳产酶温度。设计不同初始pH,确定菌株最适生长及最佳产酶初始pH,用相对酶活表示。
1.5 脂肪酶的分离纯化
将筛选所得菌株接种到1000mL LB培养基中,30℃恒温振荡培养36h,10000r/min离心10min,取上清液用80%饱和度的(NH4)2SO4进行盐析,将盐析后的蛋白质沉淀溶于pH7.2的Tris-HCl缓冲液中,透析脱盐,将透析后的液体加样于用20mmol/L pH8.5的Tris-HCl平衡好的DEAE-Sepharose Fast Flow阴离子层析柱,用含0~0.6mol/L NaCl的相同缓冲液梯度洗脱,每0.1mol/L增加一个梯度进行洗脱,流速控制在24mL/h,每管2mL收集洗脱液,测定蛋白吸收和酶活力,以酶活力单位U表示。洗脱程序为:0~9管0mol/L NaCl;10~41 管 0.1mol/L NaCl;42~82 管0.2mol/L NaCl;83~116 管 0.3mol/L NaCl;117~ 137管 0.4mol/L NaCl;138 ~ 149 管 0.5mol/L NaCl;150~160管 0.6mol/L NaCl。最后收集合并具有脂肪酶活性部分,低温保存备用。
1.6 蛋白质含量测定
蛋白质含量的测定用 Bradford方法进行[11],以牛血清白蛋白为标准。
1.7 脂肪酶的SDS-PAGE电泳分析
蛋白酶的分子量测定采用SDS-PAGE垂直板电泳法:浓缩胶浓度5%,分离胶浓度10%,考马斯亮兰R-250染色,其中分子量标准蛋白包括磷酸化酶b、牛血清蛋白、卵清蛋白、碳酸苷酶、胰蛋白酶抑制剂、溶菌酶。
1.8 温度对脂肪酶活力和稳定性的影响
按1.3方法在不同温度下测定酶活力,确定酶的最适温度,另外将蛋白酶溶液于不同温度保温30min取样并迅速冷却到室温,再测定酶的活力,确定温度对酶稳定性影响,用相对酶活表示。
1.9 pH对脂肪酶活力和稳定性的影响
选取不同pH的缓冲液作为反应体系中的缓冲液,其他条件不变,测定酶活力,确定该酶的最适作用pH。将酶溶液加入不同pH缓冲液中,4℃下保温2h,测定酶活力,确定不同pH对酶稳定性影响,用相对酶活表示。
1.10 脂肪酶催化合成生物柴油的初步研究
将 10.0mL 含 10.0mg 椰子油、10.0mg Tween-80的正己烷溶液与3.3mL 3%的MgSO4溶液搅拌制成乳浊液,再与10.0g硅藻土混合,干燥。称出1.7g与2.0mL纯化后的脂肪酶混合,室温放置直至干燥[12-13]。50mL 具塞锥 形 瓶中加入 3.0g 橄 榄 油[14],0.14mL 的甲醇(醇油摩尔比为 3∶1),5.0mL 正己烷,2.0g固定化脂肪酶,40℃密闭振荡反应,分3次流加甲醇,48h后用气相色谱质谱仪对样品进行分析。
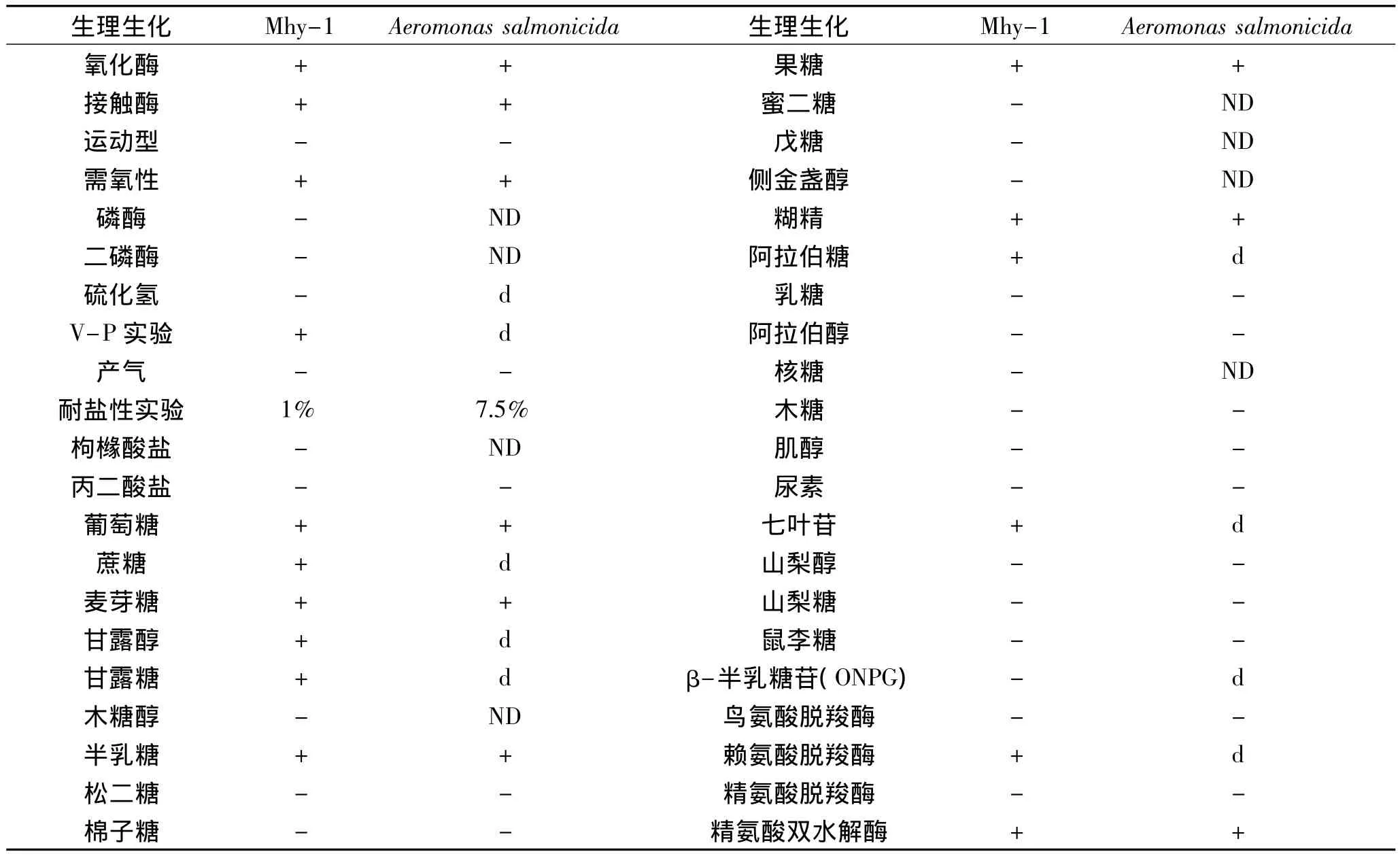
表1 菌株Mhy-1生理生化特性Table 1 Physiological characteristics of the strain Mhy-1
2 结果与分析
2.1 脂肪酶产生菌的筛选及鉴定
采用平板透明圈法对不同地区来源的土样进行初筛,共获得31株脂肪酶产生菌株,其中菌株Mhy-1具有生长速度快、产酶高且稳定的特点,所产生的脂肪酶具有较好的热稳定性,所以后续的实验选用Mhy-1进行酶的生产及性质的研究。该菌株菌落呈淡黄色,边缘光滑整齐,表面湿润,细胞呈短杆状,革兰氏阴性,大小为(0.3~0.5)μm × (0.1~0.2)μm,无芽孢,其主要生理生化特性如表1。
采用16S rDNA通用引物从菌株Mhy-1基因扩增获得大小为1500bp左右的特异性片段。将扩增产物纯化后送到生工生物工程(上海)有限公司进行DNA序列测定,根据菌株16S rDNA序列同源性构建的进化树(图1),菌株Mhy-1的16S rDNA序列与杀鲑气单胞菌(Aeromonas salmonicida)可聚为一类,结合细菌培养特性、生理生化特征及16S rDNA序列分析,初步确定其为杀鲑气单胞菌(Aeromonas salmonicida)。

图1 菌株Mhy-1的系统发育树Fig.1 Phylogenetic tree of strain Mhy-1
2.2 培养时间对菌株生长及产酶活力的影响
将菌株Mhy-1接种到LB培养基中,30℃恒温振荡培养得到的生长曲线如图2所示,该菌株在前10h生长迅速,10h后进入稳定期,菌株的最佳产酶时间为36h。
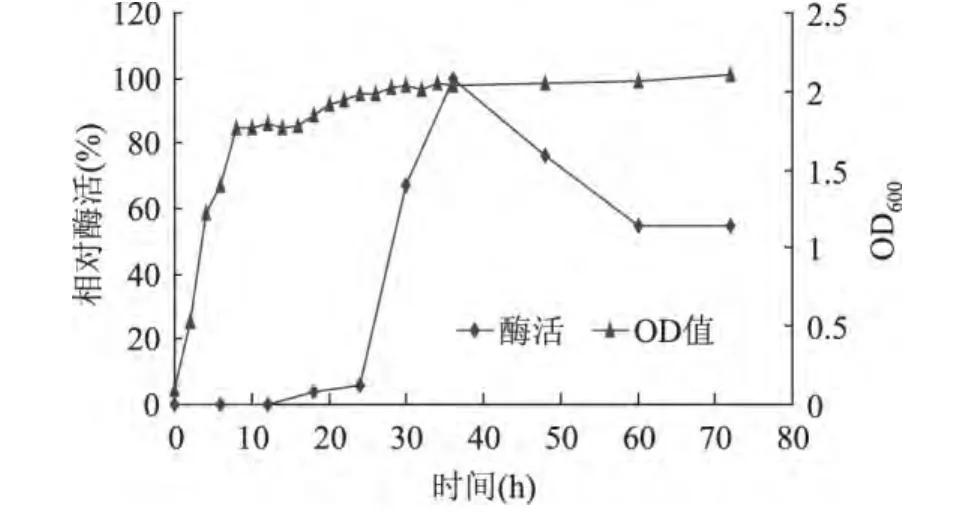
图2 培养时间对菌株生长特性及产酶活力的影响Fig.2 Effect of culture time on the growth of the strain and lipase production
2.3 培养温度对菌株生长特性及产酶活力的影响
将菌株Mhy-1接种到LB培养基中,不同培养温度下菌株生长特性及产酶活力的影响如图3所示,其最佳生长温度及最佳产酶温度分别为35、30℃。
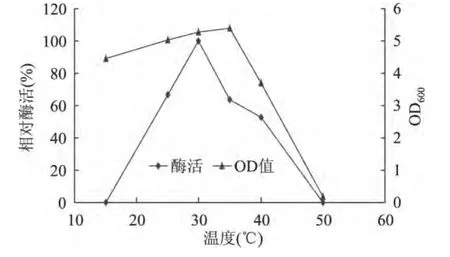
图3 培养温度对菌株生长特性及产酶活力的影响Fig.3 Effect of culture temperature on the growth of the strain and lipase production
2.4 初始pH对菌株生长特性及产酶活力的影响
将菌株Mhy-1接种到不同初始pH的发酵培养基中,30℃恒温振荡培养,发现菌株的最佳生长初始pH 为 6.0~9.0 范围,最佳产酶初始 pH 为 9.0(图 4)。
2.5 脂肪酶的纯化及性质
菌株Mhy-1培养上清液经硫酸铵沉淀、DEAESepharose fast flow阴离子交换层析两步的分离纯化,经过DEAE-Sepharose Fast Flow阴离子交换层析得到5个蛋白吸收峰,发现最大酶活在第二个蛋白峰和第三个蛋白峰处,脂肪酶最终纯化倍数为7.25,最终的回收率为17.92%(图5、表2)。

图4 不同初始pH对菌株生长特性及产酶活力的影响Fig.4 Effects of the initial pH on the growth of the strain and lipase production
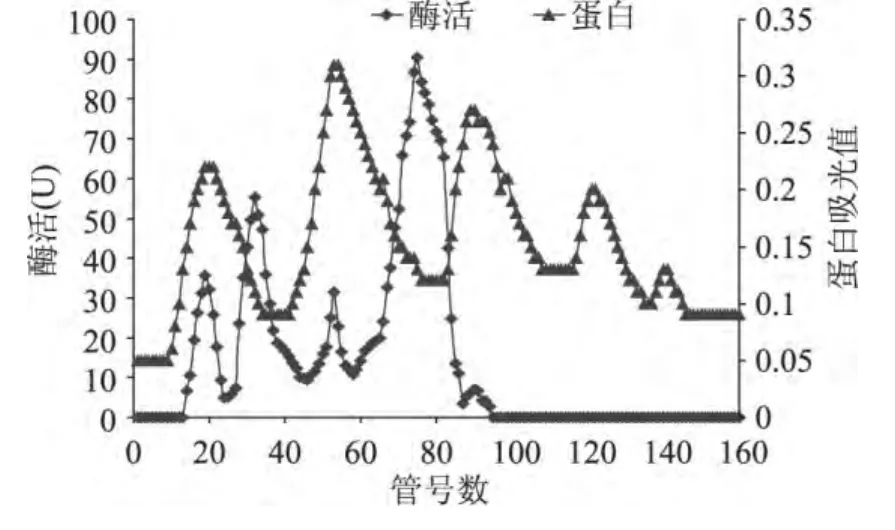
图5 DEAE-Sepharose Fast Flow层析柱Fig.5 Purification by DEAE-Sepharose Fast Flow
2.6 SDS-PAGE测定脂肪酶纯度及分子量
用SDS-PAGE方法测定纯化后脂肪酶的纯度及其分子量,结果如图6所示,最终纯化得到的脂肪酶的电泳图谱表现为单一条带,分子量约为34ku。

图6 SDS-聚丙烯酰胺凝胶电泳Fig.6 SDS-PAGE analysis
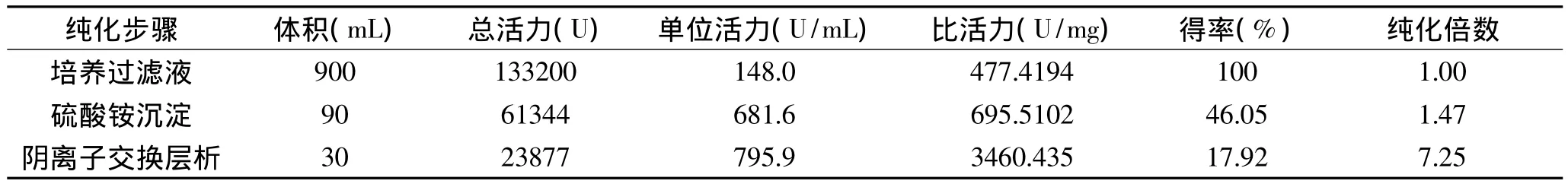
表2 菌株Mhy-1脂肪酶的纯化结果Table 2 Purification of lipase from Mhy-1
2.7 温度对脂肪酶活力和稳定性的影响
选取不同温度进行酶反应,发现该酶最适作用温度为45~50℃之间,在20℃与70℃失活,拥有较宽的温度适应范围。在30~70℃均热稳定性良好,在50℃时,稳定性最优(图7)。
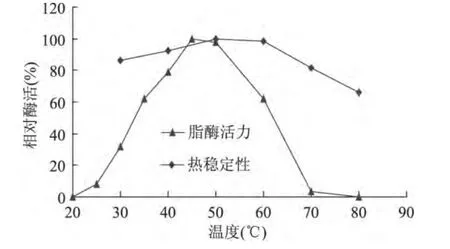
图7 温度对脂肪酶活力和稳定性的影响Fig.7 Effects of temperature on the lipase activity and stability
2.8 pH对脂肪酶活力和稳定性的影响
纯化的脂肪酶最适作用pH为8.0。且在碱性条件下也能发挥较高活力,酸性条件下失活。pH为8.0时,pH稳定性最好,并且在碱性条件下适应能力较强,判断该脂肪酶为碱性脂肪酶(图8)。
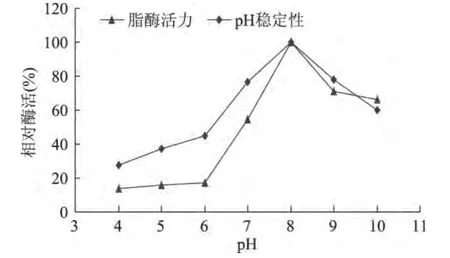
图8 pH对脂肪酶活力和稳定性的影响Fig.8 Effects of pH on the lipase activity and stability
2.9 脂肪酶催化合成生物柴油的初步研究
纯化后脂肪酶与橄榄油、甲醇、正己烷在密闭容器中40℃振荡反应48h,收集上清液,用正己烷稀释,用气相色谱质谱联用仪分析,转酯率为21.48%,其中 12.91min(1.66%),15.28min(11.66%),16.24min(8.16%)。见图 9。
3 结论与讨论
生产脂肪酶的微生物种类繁多,不同种类的微生物产生的脂肪酶性质有较大差异,常见的产脂肪酶细菌有芽孢杆菌属(Bacillusspp.)、假单胞菌属(Pseudomonasspp.)、伯克霍尔德菌 (Burkholderiaspp.)、葡萄球菌属(Staphylococcusspp.)。Ertugˇrul等分离了17株能产生脂肪酶的菌株,最后筛选得到一株芽孢杆菌(Bacillussp.),通过培养条件优化后,产酶量可达168U/mL[15];Kiran从海绵中分离到57株异养细菌,其中37%能产脂肪酶,假单胞菌(Pseudomonassp.)MSI057 产酶的能力可达 750U/mL[16],Carvalho 等从石油污染的土壤中分离的一株Biopetro-4经培养120h后产脂肪酶的能力为1675U/mL[17]。Abada等从空气环境中分离的嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)AB-1在培48h后的产酶量为1585U/mL[18]。本文从含油废水中筛选出一株活性较高的产碱性脂肪酶菌株Mhy-1,该菌在常规培养条件下生长迅速,生长适应范围广,产酶稳定。根据细胞形态、生理生化以及16S rDNA序列分析,鉴定为杀鲑气单胞菌(Aeromonas salmonicida)。该菌株具有生长迅速,产酶稳定的优点,其最适的生长温度和pH分别为35℃和pH7.0,而菌株的最佳产酶温度和初始pH分别为30℃和 pH9.0,菌株在30℃培养10h后进入稳定期,最佳产酶时间为36h,纯化后产酶能力可达 795.9U/mL。
采用硫酸铵沉淀、DEAE-Sepharose Fast Flow阴离子层析从菌株Mhy-1的培养上清液中分离纯化得到了较高活性的脂肪酶,SDS-PAGE测定酶的分子量为34ku。酶的最适作用温度为45℃,最适作用pH8.0,在 pH7.0~9.0 之间都能较好的适应,属于碱性脂肪酶,在70℃处理30min后,酶活力仍保持在80%以上,表明该酶是一热稳定性的脂肪酶。Lee等从嗜热噬油芽孢杆菌(Bacillus thermoleovorans)ID-1纯化的脂肪酶分子量为34ku,酶最适温度为70~75℃,最适pH为7.5,该酶在60℃保温1h或70℃保温30min后的活力为50%,Ca2+和 Zn2+对酶活性有促进作用[19]。Tang等从凝结芽孢杆菌(Bacillus coagulans)ZJU318分离的脂肪酶分子量为32ku,酶最适温度为45℃,最适 pH9.0,在 pH7.0~10.0 的范围内稳定,在40~50℃范围内酶迅速失活,Ag+、Cu2+对酶有抑制作用,SDS、Brij 30 和 Tween-80 能抑制酶活性[20]。
从气单胞菌属不同菌株来源的脂肪酶分子量分别为 15.5、26、31、34、45、50、72、80 和 97ku[21-23]。Neelambari等报道从嗜水气单胞菌(Aeromonas hydrophila)上清液中分离到分子量为34ku的碱性脂肪酶,酶在 pH7.5~9.5 和温度 40~45℃ 范围内稳定[22]。气单胞菌(Aeromonassp.)LPB 4 脂肪酶的分子量为50ku,酶的最适温度为10℃,在低于50℃的范围内比较稳定,添加0.1%的表面活性剂能增加酶活力,而1%反而降低酶的活性,丁醇能降低酶活力而甲醇能增加酶的活力[21]。Lotrakul等从温和气单胞菌(Aeromonas sobria)LP004分离纯化的脂肪酶分子量为97ku,酶的最适温度为45℃,最适 pH6.0,在低于 40℃,pH6.5~10.0 的范围内比较稳定[24]。而从海水底泥分离的气单胞菌(Aeromonassp.)EBB-1脂肪酶分子量为45ku,在pH8.0和37℃下活力最高,酶在 pH6.0~8.0 和 30~80℃ 范围内都比较稳定[23]。Wang等从芽孢杆菌(Bacillussp.)A30-1分离的热稳定性脂肪酶在60℃时的活力最大,在70℃保持30min仍保持100%的酶活性。在60℃保持15h仍保持90%的酶活性[25]。其他热稳定性脂肪酶也有报道[26]。
用脂肪酶代替酸碱催化剂催化合成生物柴油的报道很多,酶催化转酯反应有反应条件温和、相对节能、环境友好、副产物易回收及适合高含量游离脂肪酸油脂作为底物等明显优势[27-28],可催化合成生物柴油的微生物脂肪酶包括细菌脂肪酶,真菌脂肪酶,固定 化 酶 Novozym435[29-30]等,包 括 洋 葱 假 单 胞 菌(Pseudomonas cepacia)[31],假丝酵母 (Candidasp.)99-125[32],米根霉(Rhizopus oryzae)[33],疏棉状嗜热丝孢 菌 (Thermomyces lanuginosus)[34],产 气 肠 杆 菌(Enterobacter aerogenes)[35]来源的脂肪酶都用于生物柴油的制备。优质高产的脂肪酶菌株对于酶的合成至关重要。本文将纯化后的脂肪酶用于生物柴油的合成,转酯率可达21.48%。由于该酶的稳定性较好,会在将来的应用中发挥优势,有关酶的基因表达及调控等有待于进一步的研究。
[1]Sirisha E,Rajasekar N,Narasu ML.Isolation and optimization of lipase producing bacteria from oil contaminated soils[J].Advances in Biological Research,2010,4(5):249-252.
[2]Aravindan R,Anbumathi P,Viruthagiri T.Lipase applications in food industry[J].Indian Journal of Biotechnology,2007,6(2):141-158.
[3]Yang G,Wu J,Xu G,et al.Comparative study of properties of immobilized lipase onto glutaraldehyde-activated amino-silica gel via different methods[J].Colloids and Surfaces B:Biointerfaces,2010,78(2):351-356.
[4]Hasan F,Shah AA,Hameed A.Industrial applications of microbial lipases[J].Enzyme and Microbial Technology,2006,39(2):235-251.
[5]Tan T,Lu J,Nie K,et al.Biodiesel production with immobilized lipase:A review[J].Biotechnology Advances,2010,28(5):628-634.
[6]Bajaj A,Lohan P,Jha PN,et al.Biodiesel production through lipase catalyzed transesterification:An overview[J].Journal of Molecular Catalysis B:Enzymatic,2010,62(1):9-14.
[7]Treichel H,Oliveira D,Mazutti MA,et al.A review on microbial lipases production[J].Food and Bioprocess Technology,2010,3(2):182-196.
[8]Colen G,Junqueira RG,Moraes-Santos T,et al.Isolation and screening of alkaline lipase-producing fungi from Brazilian savanna soil[J].World Journal of Microbiology and Biotechnology,2006,22(8):881-885.
[10]Xu L,Diosady LL.The production of Chinese rapeseed protein isolates by membrane processing[J].Journal of the American Oil Chemists′Society,1994,71(9):935-939.
[11]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein- dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[12]邓利,谭天伟,王芳,等.脂肪酶催化合成生物柴油的研究[J].生物工程学报,2003,19(1):97-101.
[13]Cho SS,Park DJ,Simkhada JR,et al.A neutral lipase applicable in biodieselproduction from a newly isolatedStreptomycessp.CS326 [J].Bioprocess and Biosystems Engineering,2012,35(1-2):227-234.
[14]Sanchez F,Vasudevan PT.Enzyme catalyzed production of biodieselfrom olive oil[J].Applied Biochemistry and Biotechnology,2006,135(1):1-14.
[16] Kiran GS,ShanmughapriyaS,JayalakshmiJ,etal.Optimization of extracellular psychrophilic alkaline lipase produced by marinePseudomonassp.(MSI057)[J].Bioprocess and Biosystems Engineering,2008,31(5):483-492.
[17]Carvalho NB,Souza RL,Castro HF,et al.Sequential production of amylolytic and lipolytic enzymes by bacterium strain isolated from petroleum contaminated soil[J].Applied Biochemistry and Biotechnology,2008,150(1):25-32.
[18]Abada EAE.Production and characterization of a mesophilic lipase isolated fromBacillus stearothermophilusAB-1[J].Pakistan JournalofBiologicalSciences,2008,11(8):1100-1106.
[19] Lee DW,Koh YS,Kim KJ,etal.Isolation and characterization of a thermophilic lipase fromBacillus thermoleovoransID-1[J].FEMS Microbiology Letters,1999,179(2):393-400.
[20]Tang L,Xia L.Purification and partial characterization of a lipase fromBacillus coagulansZJU318[J].Applied Biochemistry and Biotechnology,2005,125(2):139-146.
[21]Lee HK,Ahn MJ,Kwak SH,et al.Purification and characterization ofcold active lipase from psychrotrophicAeromonassp.LPB 4[J].The Journal of Microbiology,2003,41(1):22-27.
[22]Neelambari V,Vasanthabharathi V,Balasubramanian R,et al.Lipase from marineAeromonas hydrophila[J].Research Journal of Microbiology,2011,6(8):658-668.
[23]Charoenpanich J,Suktanarag S,Toobbucha N.Production of a thermostable lipase byAeromonassp.EBB-1 isolated from marine sludge in Angsila,Thailand[J].Science Asia,2011,37(2):105-114.
[24]Lotrakul P,Dharmsthiti S.Lipase production byAeromonas sobriaLP004 in a medium containing whey and soybean meal[J].World Journal of Microbiology and Biotechnology,1997,13(2):163-166.
[25]Wang Y,Srivastava KC,Shen GJ,et al.Thermostable alkaline lipase from a newly isolated thermophilicBacillus,strain A30-1[J].Journal of Fermentation and Bioengineering,1995,79(5):433-438.
[26]Sharma R,Chisti Y,Banerjee UC.Production,purification,characterization,and applications of lipases[J].Biotechnology Advances,2001,19(8):627-662.
[27]Marchetti JM,Miguel VU,Errazu AF.Possible methods for biodiesel production[J].Renewable and Sustainable Energy Reviews,2007,11(6):1300-1311.
[28]Demirbas A.Comparison of transesterification methods for production of biodiesel from vegetable oils and fats[J].Energy Conversion and Management,2008,49(1):125-130.
[29]吴虹,宗敏华,娄文勇.无溶剂系统中固定化脂肪酶催化废油脂转酯生产生物柴油[J].催化学报,2004,25(11):903-908.
[30]Modi MK,Reddy JRC,Rao BVSK,et al.Lipase-catalyzed mediated conversion of vegetable oils into biodiesel using ethyl acetate as acyl acceptor[J].Bioresource Technology,2007,98(2):1260-1264.
[31]LiQ,Yan Y.Production ofbiodieselcatalyzed by immobilizedPseudomonas cepacialipase fromSapium sebiferumoil in micro-aqueous phase[J].Applied Energy,2010,87(10):3148-3154.
[32]Tan T,Nie K,Wang F.Production of biodieselby immobilizedCandidasp.lipase at high water content[J].Applied Biochemistry and Biotechnology,2006,128(2):109-116.
[33]Wang Y,Shen X,Li Z,et al.Immobilized recombinantRhizopus oryzaelipase for the production of biodiesel in solvent free system[J].Journal of Molecular Catalysis B:Enzymatic,2010,67(1-2):45-51.
[34]Rodrigues RC,Pessela BCC,Volpato G,et al.Two step ethanolysis:A simple and efficient way to improve the enzymatic biodiesel synthesis catalyzed by an immobilized stabilized lipase fromThermomyces lanuginosus[J].Process Biochemistry,2010,45(8):1268-1273.
[35]Zhang Z,Guan C.A promising alternate lipase for biodiesel fuel production[J].Frontiers of Agriculture in China,2010,4(2):129-136.
