番茄碱的分离纯化和抑菌活性的研究
2014-07-13李建光
李建光, 张 露
(新疆医科大学药学院, 乌鲁木齐 830011)
番茄碱是番茄苷的苷元,存在于茄科植物中的甾体类糖苷生物碱,是植物产生的次生代谢物[1]。番茄碱具有抗肿瘤、抗炎、降低胆固醇及抗利尿的作用,同时可作用于心血管、胆碱酯酶和钙调蛋白有关酶,还可作为抗疟疾疫苗的免疫佐剂[2-6]。在番茄植株中,番茄苷的含量最高,而番茄苷在高温强酸性条件下可以水解成番茄碱,降低番茄苷的毒性,提高番茄等茄科植物的食用安全性。天然植物中的番茄碱含量较低,且由于受到原料的限制,制约了番茄碱的产业化及在医药、农药、功能食品上的推广应用[7]。长期以来人们一直研究植物体内番茄碱的生物合成,Laurila等[8]研究发现了番茄碱在植物体内的一系列生物合成途径。但是在番茄碱的合成过程中许多作用酶还不清楚,这就制约了番茄碱在体外的生物合成。
本实验根据在高温强酸性条件下可以使番茄苷水解成番茄碱的特性,将提取出的番茄苷粗品与浓盐酸发生水解反应得到番茄碱,用HPLC-MS/MS 对番茄碱进行定量分析,并采用琼脂扩散滤纸片法研究番茄碱对大肠杆菌的抑制活性。
1 仪器与试药
1.1仪器Agilent1200RRLC-Agilent6410串联三重四级杆质谱仪,XDB-C18柱(2.1 mm×50 mm,1.8 μm),电子天平(Sartorius BP211D,0.01 mg),RE-52旋转蒸发仪(上海安亭电子仪器厂),PHILIPS打浆机,0.22 μm一次性过滤头(德国Dr),洁净工作台(SW-CJ-IBV苏净集团苏州安泰技术有限公司)。
1.2试药新鲜青番茄:青熟期,全果翠绿色,部分果顶显白色,药材经新疆医科大学药学院胡君萍教授鉴定为茄科(Solanaceae)番茄属(LycopersiconMill)植物番茄的果实。番茄碱对照品(多伦多化学实验有限公司,批号6192-62-7),甲醇(色谱纯,美国TENDA),其余试剂均为分析纯。大肠埃希氏杆菌(新疆医科大学免疫教研室提供,20130428),营养琼脂(实验室自制)。
2 方法与结果
2.1番茄碱的含量测定
2.1.1 HPLC-MS/MS分析条件 流动相为CH3OH-10 mmol/L-NH4Ac水溶液(含0.1%HCOOH)=60∶40,SIM,ESI(+),XDB-C18柱(2.1 mm×50 mm,1.8 μm),柱温40 ℃,进样量3 μL,流速0.2 mL/min。干燥气温度350℃,干燥气流量9 L/min,雾化气压力40 psi,毛细管电压+4 000 V,源内碎裂电压135 V。
2.1.2 番茄碱对照品溶液的配制 精密称定番茄碱对照品约10.00 mg,用甲醇溶解,定容于100 mL量瓶中,得番茄碱对照品储备液,浓度为0.1 mg/mL。
2.1.3 标准曲线 用甲醇将储备液稀释为浓度为0.003 0、0.009 0、0.015 0、0.020 0、0.030 0 μg/mL的稀释液,每一浓度进3针,取峰面积平均值,以对照品浓度为横坐标X,峰面积为纵坐标Y,得线性方程Y=65 990X+9.054,r=0.999 5,线性范围为0.003 0~0.030 0 μg/mL。HPLC-MS/MS图如图1、2所示。

图1 番茄碱对照品HPLC-MS/MS图
2.1.4 稳定性试验 取番茄碱对照品溶液,浓度为0.009 0 μg/mL,分别在0、2、4、8、16、24 h不同时间点进行测定,考察峰面积的一致性,结果RSD为0.86%。
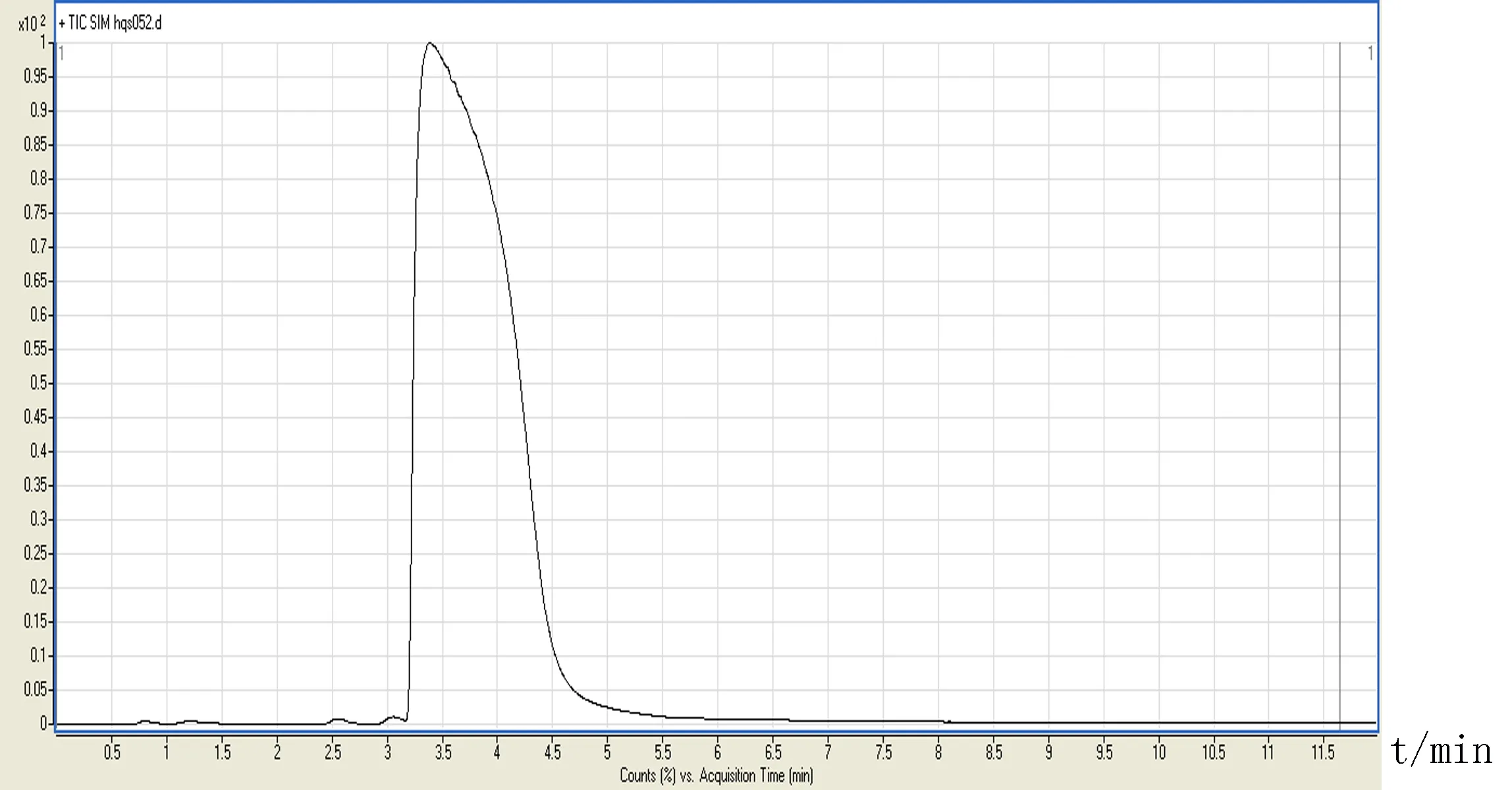
图2 番茄碱晶体样品HPLC-MS/MS图
2.1.5 精密度试验 取番茄碱对照品溶液,浓度为0.009 0 μg/mL,做日内和每隔1天的日间精密度试验,各进6次样,每次进3针,计算平均峰面积,测定峰面积与出峰时间的比值,结果日内RSD为0.48%,日间RSD为0.98%。
2.1.6 重现性试验 取番茄碱对照品溶液5份,浓度为0.009 0 μg/mL,每份进3针,考察峰面积的一致性,结果RSD为0.71%。
2.1.7 加样回收率试验 取番茄碱样品溶液6份,浓度为0.009 0 μg/mL,各1 mL,精密测定,分别准确加入浓度分别为0.004 5、0.009 0、0.018 0 μg/mL对照品溶液各1 mL,依次加入6份样品溶液中,测定并计算其回收率,结果番茄苷的平均回收率为97.56%(n=6),RSD=1.74%。
2.2番茄碱粗品的制备原料为青番茄,提取溶剂为无水乙醇,温度为60℃,浸提时间为2.5 h,料液比为1∶5,超声处理30 min,共提取2次。提取液浓缩至无醇味,用5% NaOH调节其pH值>8,静置过夜,离心得到沉淀物,用蒸馏水将沉淀物洗至中性,用丙酮、氯仿将沉淀物各萃取3次,用甲醇溶解沉淀,将不溶物过滤后弃去,蒸干甲醇得到番茄苷粗品。用20%乙醇溶解后经HPD-100A大孔吸附树脂用3 BV的蒸馏水除杂,然后用3 BV的95%乙醇洗脱,除去番茄苷粗品中的糖和部分水溶性杂质,合并乙醇洗脱液后待用[9-10]。
将上述乙醇洗脱液旋蒸至无醇,体积为V1,加入浓盐酸,体积为V2(V1∶V2=10∶1),在90℃条件下水解1 h,水解完全后用5% NaOH调节溶液pH值>8,用氯仿萃取3次合并氯仿液,旋转蒸干氯仿后用无水乙醇溶解蒸发瓶上的物质,蒸发掉约一半的乙醇后,趁热过滤后弃去不溶物。滤液置于4 ℃冰箱1 w,过滤得到沉淀,将沉淀再溶于无水乙醇,重复上述操作即可得到番茄碱粗品。
2.3番茄碱粗品的分离纯化精密称定1.093 g番茄碱粗品,称取在160 ℃条件下活化2 h的硅胶100 g,湿法装柱(柱为3.5 cm×70 cm层析柱),干法上样。以4种流动相依次进行洗脱:(1)氯仿-甲醇(15∶1,v/v);(2)氯仿-甲醇-28%氨水(40∶10∶1,v/v/v);(3)氯仿-甲醇-28%氨水(90∶30∶5,v/v/v);(4)甲醇。洗脱流速为7 mL/min,以每50 mL为一流份收集,TLC实时跟踪番茄碱至检不出番茄碱,停止洗脱。合并含番茄碱的流份,旋转蒸发至干,称量,用甲醇溶解洗脱物,过滤弃去不溶物,用HPLC-MS/MS 测定滤液中番茄碱浓度,计算洗脱物中番茄碱的含量。结果由样品峰面积计算后可知洗脱物中番茄碱的含量为69.60%。
2.4番茄碱的结晶与重结晶用适量的甲醇将洗脱物溶解,过滤并弃去不溶物,置4℃冰箱中使其缓慢结晶,待结晶完全后,使上清液倾出,用少量冷甲醇将结晶冲洗,抽滤,干燥。反复重结晶2次,将得到的晶体称重,溶于甲醇,用HPLC-MS/MS 测定浓度,计算晶体中番茄碱的含量。结果由晶体样品峰面积计算后可知番茄碱含量达到90.48%,与粗品比较番茄碱的最终收率为81.84%。
2.5番茄碱抑菌活性的研究
2.5.1 番茄碱供试液的配制 称取番茄碱晶体5.004 g,用甲醇溶解,定容于10 mL量瓶中,相当于番茄碱的浓度为500.4 mg/mL,其阳性对照为1.5%的苯甲酸钠溶液。
2.5.2 供试菌株的活化 在无菌室环境中将大肠埃希氏杆菌接入相对应的试管斜面培养基上,置35~37℃恒温培养箱内18~24 h。培养好的试管斜面放置在0~4℃冰箱内冷藏备用。
2.5.3 培养基平板的制备 将配制好的培养基在电炉上融化,置电热恒温水浴锅中保持温度至50~60℃。在无菌操作条件下将培养基倾注于高压灭菌后的无菌培养皿内,每皿体积15~20 mL,放平置培养基凝固。
2.5.4 菌悬液的制备 取活化培养好的菌株,用接种环调取2环菌体,放入9 mL无菌生理盐水中,摇匀,制成菌体悬浮液。
2.5.5 番茄碱与苯甲酸钠的抑菌活性对照试验 用打孔器将定性滤纸打成直径为5 mm的小圆片,放入培养皿中置120℃恒温箱中干热灭菌2 h。将灭菌后的滤纸片分别浸泡于番茄碱供试液、1.5%苯甲酸钠、无菌水中24 h。在无菌条件下,分别取0.2 mL菌悬液加入培养基平板中,用三角刮铲涂布均匀。在接种后的平板上贴上浸泡好的滤纸片,培养皿背面分为3个部分,各贴供试液滤纸片、浸有1.5%苯甲酸钠滤纸片及无菌水滤纸片(空白对照)。置35~37℃恒温培养箱内培养18~24 h,培养好后取出测抑菌圈直径。结果番茄碱供试液、苯甲酸钠溶液、空白对照样的抑菌圈直径分别为7.12、6.30、5.00 mm,452.8 mg/mL番茄碱的抑菌圈直径比苯甲酸钠的大(图3)。

A: 番茄碱供试液

B: 苯甲酸钠
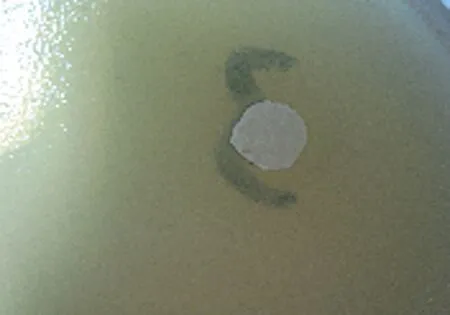
C: 空白对照样
图3番茄碱和苯甲酸钠对大肠埃希氏菌的抑菌效果图
2.5.6 番茄碱最低抑菌浓度(MIC)的测定 配制番茄碱供试液,采用倍比稀释法用甲醇将番茄碱稀释成浓度分别为452.8、226.4、113.2、56.6、28.3、14.15 mg/mL的稀释液,用无菌吸管分别吸取0.5 mL稀释液加入到已制备好的培养基上。在其上按皿底的记号,用移液枪吸取0.1 mL菌悬液,涂于平板上,用三角刮铲涂布均匀,置35~37 ℃温度下培养18~24 h,观察大肠埃希氏杆菌生长情况。另稀释相同系列浓度番茄碱溶液,不接种菌作为对照,最低稀释液浓度为完全没有菌生长时对大肠埃希氏杆菌最低抑菌浓度(MIC)(n=6)。结果番茄碱的浓度降低到113.2 mg/mL时无大肠埃希氏菌生长,故可认为在本实验中番茄碱的最低抑菌浓度为113.2 mg/mL(表1)。

表1 番茄碱对大肠埃希氏菌的MIC
注:“-”表示无菌生长,“+”表示有菌生长。
2.6不同条件对番茄碱抑菌活性的影响
2.6.1 pH对番茄碱抑菌活性的影响 用HCl和NaOH调节番茄碱供试液的pH值为3、4、5、6、7、8、9的不同溶液,将无菌滤纸片分别放入7种溶液中浸泡24 h,贴于涂有0.1 mL菌悬液的培养基上,置35~37 ℃温度下培养18~24 h,测定各滤纸片的抑菌圈直径,以比较不同的pH对番茄碱抑菌活性的影响(n=3)。结果不同的pH对番茄碱的抑菌活性有一定的影响。在pH为3~6时,番茄碱抑菌圈直径为6~8 mm,且并无较大差别;在pH为7时番茄碱抑菌圈直径扩大至最大,为7.82 mm,抑菌活性明显增强,抑菌效果最好。碱性条件下番茄碱的抑菌活性强于在酸性条件下,原因是在碱性条件下,番茄碱析出,抑菌活性增强,且番茄碱在中性环境中抑菌性较强、热稳定性好(表2)。
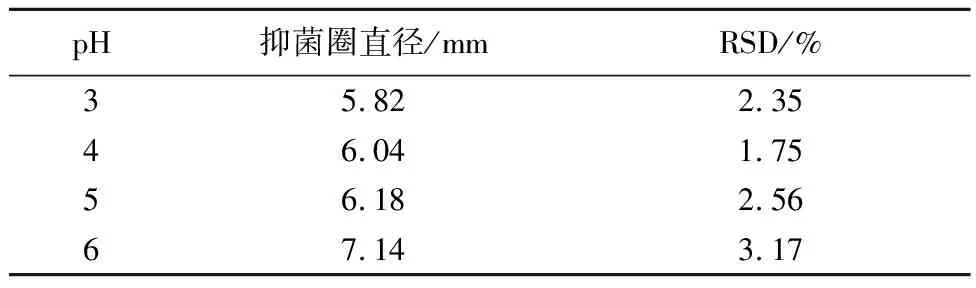
表2 pH对番茄碱抑菌活性的影响
2.6.2 温度对番茄碱抑菌活性的影响 分别取番茄碱供试液各5 mL,放入5个不同的小烧杯中,分别置于20、40、60、80、90℃水浴处理15 min后,将无菌滤纸片分别放入各个烧杯中浸泡24 h。贴于涂有0.1 mL菌悬液的培养基上,置35~37℃温度下培养18~24 h,测定滤纸片的抑菌圈直径,比较不同温度对番茄碱抑菌活性的影响(n=3)。结果随着温度的升高,番茄碱的抑菌活性不断增大,在60~80℃之间变化较大,原因是由于甲醇被蒸发,番茄碱的浓度增大,抑菌活性增强(表3)。

表3 温度对番茄碱抑菌活性的影响
2.6.3 供试液与大肠埃希氏杆菌作用不同时间对抑菌活性的影响 取番茄碱供试液1 mL与0.1 mL的菌悬液混合,番茄碱取6个同样的混合样,摇匀,同时各放入1片滤纸片,经过1、3、5、8、10、12 h,分别依次取出1~6号混合样中的滤纸片,贴在涂有0.1 mL菌悬液的培养基上,置35~37 ℃温度下培养18~24 h,测定滤纸片的抑菌圈直径(n=3)。结果随着番茄碱与菌悬液作用时间的延长,抑菌圈的直径不断增大,抑菌活性增强,由此可知:番茄碱与菌悬液作用时间越长,抑菌效果越好(表4)。
3 讨论
具碱性的生物碱能和酸结合生成盐,生物碱盐一般易溶于水,难溶或不溶于亲脂性有机溶剂,但可溶于甲醇或乙醇。生物碱盐的水溶液加碱后生成的游离碱又可自水溶液中沉淀析出。番茄碱是仲胺类生物碱,具有亲脂性,其氮原子上未共用电子对,容易与未全卤代的卤代烃中的氢形成了氢键,所以可将游离的番茄碱用氯仿萃取出来。番茄碱经硅胶柱分离纯化后,显著提高了番茄碱的含量,并用HPLC-MS/MS对番茄碱进行定量分析。本实验制得的番茄碱粗品为白色粉末,在分离纯化粗品过程中,可以将大量的色素留在硅胶柱上,起到对番茄碱粗品脱色的作用。抗菌药物对于细菌的抑制作用的机理有抑制细菌细胞壁的合成、影响细胞膜通透性、抑制蛋白质合成、抑制核酸代谢、影响叶酸代谢。

表4 不同作用时间对番茄苷抑菌活性的影响
本实验初步研究发现一定浓度下的番茄碱对于大肠埃希氏杆菌具有抑制作用,其作用机理还有待于进一步的研究。
文献参考:
[1] 江纪武, 肖庆祥. 植物药有效成分手册[M]. 北京:人民卫生出版社, 1986:3.
[2] 段江燕. 番茄碱对乙酰胆碱酯酶活性影响的研究[J]. 西北植物学报, 2008, 28(3):501-505.
[3] 陶永霞, 刘洪海, 王忠民, 等. 番茄生物碱粗体物抑菌作用的研究[J]. 天然产物研究与开发, 2006, 18(3):438-440.
[4] Elliger CA. α-tomatine and resistance of tomato cultivars toward the nematode meloidogyne incognita[J]. Chem Ecol,1988,14(4):1253-1259.
[5] 王彦章. 番茄成熟过程中番茄碱含量的变化及其抑菌作用[J]. 新疆农业大学学报, 2000, 23(2):35-37.
[6] Mendel FT, Fitch E, Yokoyama WE. Lowering of plasma LDL cholesterol in hamsters by the tomato glycol alkaloid Tomatine[J]. Food Chem Toxicol, 2003, 38:549-553.
[7] 陶永霞, 刘洪海, 王忠民, 等. 番茄碱的研究现状及应用前景[J]. 现代食品科技, 2005, 22(2):253-256.
[8] Pingulkar K, Kamat A, Bongirwar D. Microbiological quality of fresh leafy vegetables, salad components and ready to eat salads:an evidence of inhibition of Listeria monocytogenes in tomatoes[J]. Food Sci Nutr, 2001, 52:15-23.
[9] 李莉, 王婷媛, 热娜·卡斯木. HPLC法测定西伯利亚接骨木中槲皮素、芦丁的含量[J]. 新疆医科大学学报,2014,37(2):163-165.
[10] 许巧霞, 杜平, 苏叶萍, 等. 大孔吸附树脂分离纯化青番茄中的番茄苷[J]. 中国中医药信息杂志, 2002, 17(8):51-53.
