凝胶过滤色谱纯化乳清蛋白降胆固醇肽的研究
2014-07-13马丽媛李晓东c庄建鹏尚尔坤任红晶李明浩刘璐毕伟伟
马丽媛,李晓东c,庄建鹏,尚尔坤,任红晶,李明浩,刘璐,毕伟伟
(东北农业大学 a.乳品科学教育部重点实验室;b.食品学院,c.食品安全与营养协同创新中心;哈尔滨 150030)
0 引 言
干酪副产物乳清营养价值独特,其主要成分乳清蛋白已被证实含有很多潜在的生物活性肽段,这些生物活性肽在原乳清蛋白序列中并无活性,一般通过胃肠道时释放出来的很少,但在体外可通过酶解及分离纯化技术将其释放出来,包括具有抗高血压、降胆固醇、抑菌、抗氧化等功能的活性肽[1,2]。Nagaoka,S通过小鼠生物实验证明,相比大豆蛋白和酪蛋白,牛乳清蛋白源生物活性肽具有更强的降低血液胆固醇的活性[3]。
凝胶过滤色谱是很好的分离纯化肽的方法,它是利用具有网状结构的凝胶分子筛,将不同分子大小的物质分离开来,是一种液体柱层析技术[4,5]。凝胶过滤色谱不仅能将肽分离纯化,还可以分析肽的相对分子质量,其分离分析简单快速而被广泛应用。
1 实 验
1.1 材料
乳清蛋白产品;蛋白质标准品(胰蛋白酶、溶菌酶、糜蛋白酶、牛胰岛素、维生素B12);凝胶葡聚糖Sephadex G-50。
1.2 设备
WIGGENS数字式搅拌器,SMB-20型超滤设备,TDL-500B冷冻离心机,LGJ-1型冷冻干燥机,KQ-500B型超声波清洗器,玻璃层析柱1.5 cm×70 cm,ÄKTATMprime蛋白质纯化系统。
1.3 方法
1.3.1 乳清蛋白水解肽的制备
取一定量的乳清蛋白配制成一定浓度的水溶液,置于恒温水浴锅中90℃高温灭酶活10 min后,冷却至酶解温度,用浓度为1.0 mol/L的氢氧化钠溶液调节酶解液pH值至适宜条件,加入一定量的胰蛋白酶,将数字搅拌器插入溶液中选择一定转速进行搅拌,水解过程中不断加入适量氢氧化钠溶液以维持pH值在适宜范围内,水解结束时将水温再次调至90℃高温灭酶活10 min,4 000 g离心10 min,排除沉淀,上层清液使用10 ku截留薄膜超滤,收集超滤透过液,即为乳清蛋白水解液。冷冻干燥,-20℃保存备用。
1.3.2 凝胶色谱分离降胆固醇活性肽
1.3.2.1 凝胶前处理
将一定量凝胶葡聚糖Sephadex G-50溶于水后经沸水溶胀2 h,冷却至室温,真空抽滤去除气体后装柱。将1.5 cm×70 cm的玻璃层析柱垂直固定在蛋白纯化仪的支架上,将预处理好的Sephadex G-50缓慢装入层析柱中,先加入缓冲液,缓冲液体积占柱体积10%~15%为宜,后缓慢加入胶液,保证凝胶液面水平,打开出液口排出多余缓冲液,使柱内胶面上部保留2~3 cm缓冲液为宜。再将玻璃层析柱上两端的的进出液管口分别与仪器上相应的进出液位置相连,打开机器,用3~5倍柱体积缓冲液冲洗机器和柱子,待机器紫外检测值稳定后上样。
1.3.2.2 绘制凝胶过滤色谱的分子量校正曲线
选择几种已知分子量的蛋白质标准品,由于凝胶葡聚糖Sephadex G-50分离的范围是1 500~30 000 u,所以实验选择胰蛋白酶(MW 23.3 ku)、溶菌酶(MW 14.4 ku)、 糜蛋白酶 (MW 11.0 ku)、 牛胰岛素(MW 5.73 ku)、维生素B12(MW 1.36 ku),质量浓度为1.0 g/L,一次进样6 mL(凝胶总体积的5%),将标准品分别进行凝胶层析,记录每个标准物质出现峰值的时间,以蛋白标品分子量的对数为纵坐标,出现峰值的洗脱时间为横坐标绘制校正曲线。
1.3.2.3 凝胶过滤色谱纯化乳清蛋白肽条件的优化
本实验分别选择磷酸钠缓冲液、醋酸钠缓冲液和Tris-HCl缓冲液3种溶液作为流动相,在其他条件一定的情况下对乳清蛋白肽进行分离纯化,根据凝胶分离效果筛选合适的洗脱溶液,分别进行洗脱,并对筛选的洗脱液浓度和pH值进行优化,收集每个洗脱峰的组分,测定其降胆固醇活性。
取冻干后的水解肽,用一定浓度的缓冲液配制成质量浓度为20 g/L的溶液,通过进样环进样。调节压力为1.0 MPa,流速为1 mL/min,样品收集为2 mL/管,一次上样6 mL(5%BV),紫外检测器波长为280 nm,收集各个洗脱峰,经冷冻干燥后备用。
1.3.3 降胆固醇活性的测定
Nagaoka S.等人研究发现,通过配制一种模拟人体胃肠道环境的人造胆汁胶束溶液,经超速冷冻离心使胶束溶液发生两相分离,然后测定其水相中胆固醇溶出的含量,来考察乳清蛋白肽对胆固醇在胶束溶液中的溶解度的影响,进而成为衡量降胆固醇活性高低的指标。
参照Charles F.Shoemaker[6]等人的方法并略作修改,配制模拟胆汁胶束溶液包含:浓度为0.01 mol/L牛磺胆酸钠,0.002 mol/L胆固醇,0.005 mol/L油酸,0.135 mol/L氯化钠,0.015 mol/L磷酸钠缓冲液(pH值为7.4),质量浓度为5 g/L水解肽粉末,通过超声波乳化制得,然后37℃培养24 h,100 000 g离心60 min后取上清液测定胆固醇浓度。上清液中的胆固醇浓度即为胆固醇胶束溶解度,以不加水解肽的胶束溶液为空白,按下式计算水解肽对胆固醇在模拟胆汁胶束溶液中的溶解度的抑制率为
抑制率=(M-N)/M×100%
式中:M为空白对照溶液的胆固醇溶解度(mol/L);N为样品溶液的胆固醇溶解度(mol/L)。
2 结果与讨论
2.1 分子量校正曲线的绘制
将已知分子量蛋白质标准品分别进行凝胶层析,研究蛋白质分子量对数与其出峰时间的关系,如图1所示。

图1 蛋白标品分子量对数与出峰时间的关系
由图1可以看出,蛋白标品分子量的对数和出峰时间之间存在明显的线性关系,得到回归方程:y=-0.014x+4.5203(R2=0.9785),根据这个回归方程可以粗略计算样品中多肽的分子量分布。
2.2 凝胶过滤色谱纯化乳清降胆固醇肽分离条件的筛选
为得到好的分离效果,在流速1 mL/min、压力1.0 MPa、凝胶体积120 mL等其他条件一致的情况下,比较了相同浓度和pH值的3种洗脱流动相对乳清蛋白降胆固醇肽的分离情况,同时对筛选的洗脱液浓度和pH值进行优化。
2.2.1 洗脱流动相种类筛选
图2为pH 值为7.0,浓度为0.05 mol/L洗脱流动相种类筛选结果。由图2可以看出,以Tris-HCl和醋酸钠溶液作为流动相洗脱时,只出现了两个明显的洗脱峰,而相同条件的磷酸钠溶液作为流动相时洗脱得到了3个明显的洗脱峰,分离效果较好。所以选择磷酸钠溶液作为流动相进行后续的实验。

图2 相同pH值和浓度下各洗脱流动相种类筛选结果
2.2.2 pH值筛选
在其他条件一致的情况下,考察了不同pH值的磷酸钠缓冲液对乳清蛋白降胆固醇肽的分离情况,结果如图3所示。
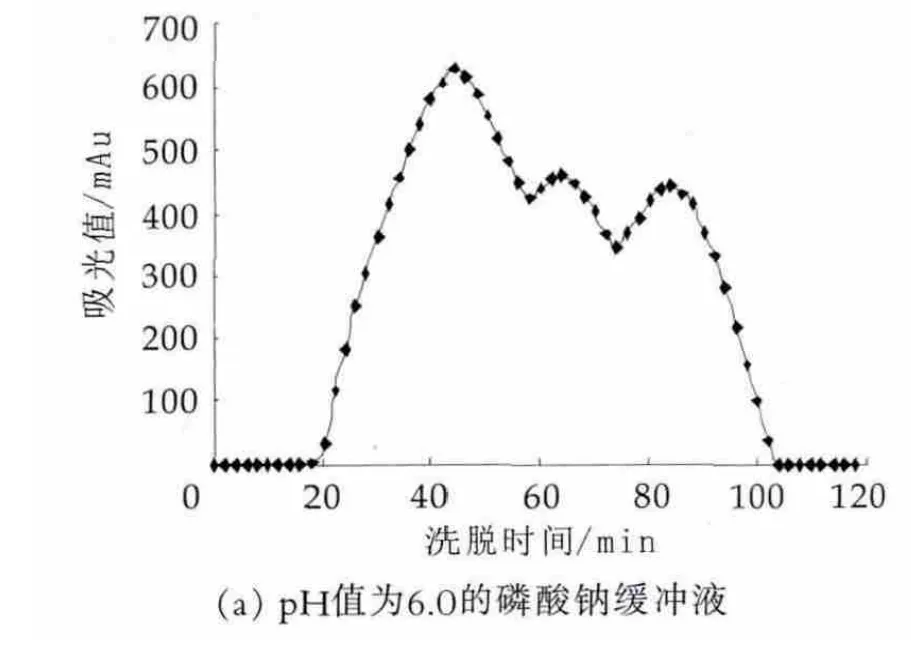
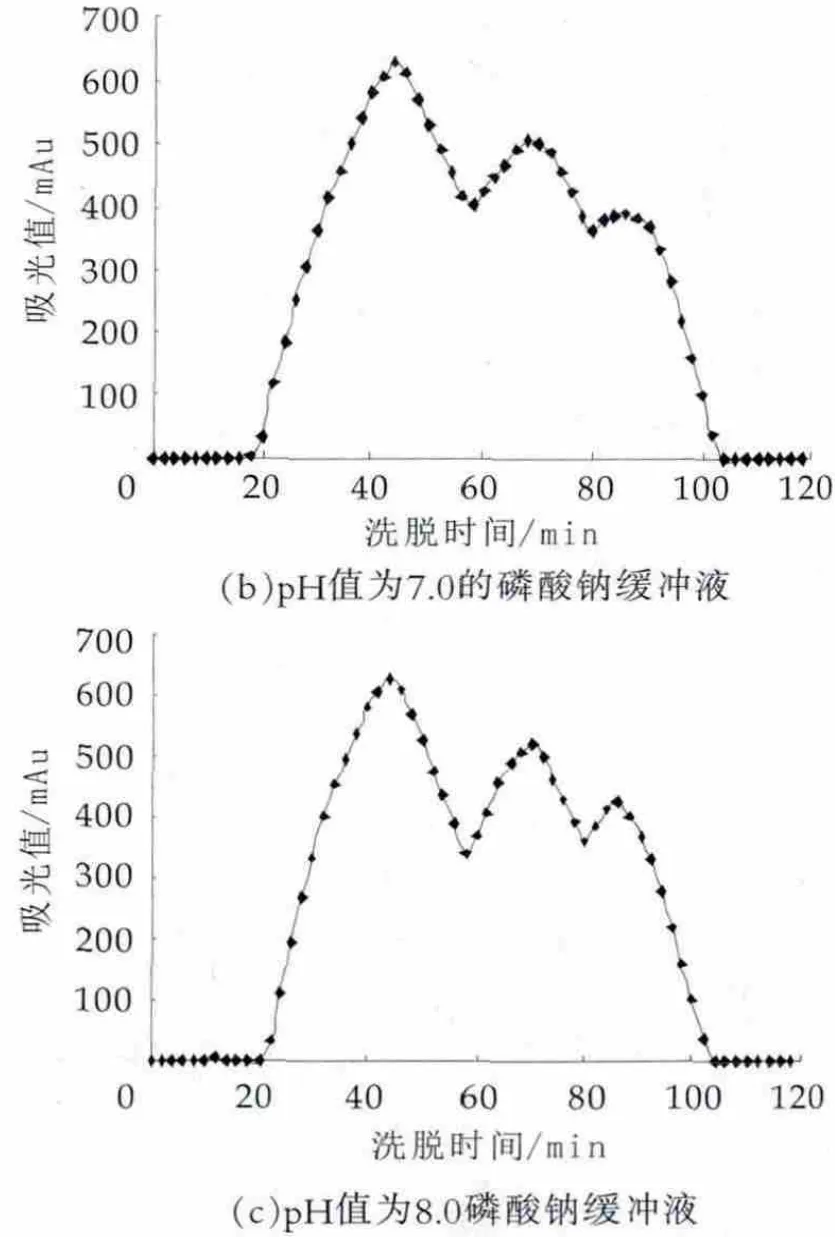
图3 相同浓度不同pH值下洗脱液pH值筛选结果
由图3可以看出,当pH值为6.0时,洗脱的第2个峰与第1个峰没有完全分开,两峰有粘连现象;当pH值为7.0时,虽然前两个峰明显分开,但是第3个峰峰型不完整,没有很好的洗脱出来;当pH值为8.0时,可以明显的看到三个界限较清晰地组分峰,此pH值下的分离效果较好。
2.2.3 洗脱液浓度筛选
在其他条件一致的情况下,选择pH值为8.0的不同浓度的磷酸钠缓冲液对乳清蛋白降胆固醇肽进行分离,筛选最佳流动相浓度,结果如图4所示。
由图4可以看出,随着洗脱流动相的浓度增大,分离效果呈现越来越差的现象。可能是由于离子强度过大,待分离肽与凝胶之间结合力较小,峰与峰之间出现粘连、甚至拖尾现象。而当磷酸盐洗脱液的浓度为0.03 mol/L时,待分离肽被分成3个明显的组分峰,且峰型较窄,无拖尾现象,显示分离效果较好。
综上所述,当选择pH值为8.0,浓度为0.03 mol/L的磷酸钠溶液作为洗脱流动相,在280 nm检测波长下测定各个管中的吸光值,组分的凝胶层析图共出现3个比较明显的峰,3个洗脱组分峰得到了较好的分离,与其他分离条件相比较分离效果较好。所以本实验选择pH值为8.0,浓度为0.03 mol/L的磷酸钠溶液进行实验,将洗脱下来的3个峰的液体收集,重复多次上样,真空浓缩,冷冻干燥,分别测定它们的降胆固醇活性。
2.3 目标活性肽的降胆固醇活性及分子量分布
水解肽经凝胶葡聚糖Sephadex G-50分离得到的3个组分峰(图4a)分别命名为:F1,F2,F3,经真空浓缩,冷冻干燥,测定的胆固醇胶束溶解度抑制率结果如表1所示。

图4 不同浓度下的洗脱液液浓度的筛选结果
由表1可以看出,经Sephadex G-50凝胶层析分离前后水解肽的胆固醇胶束溶解度抑制率差异显著,且第1、2、3洗脱组分的降胆固醇活性差异显著,洗脱组分F2的胆固醇胶束溶解度抑制率最高为57.48%,可以确定F2组分即为目标活性肽,即降胆固醇肽。根据凝胶分子量校正曲线计算可知降胆固醇肽的分子量在2 000~4 700 u范围内。

表1 3个组分的胆固醇胶束溶解度抑制率和分子量分布
3 结 论
本文研究了凝胶过滤色谱分离纯化乳清蛋白降胆固醇肽的洗脱条件,确定的最佳洗脱流动相为pH值为8.0,浓度为0.03 mol/L的磷酸钠溶液。在此条件下,乳清蛋白降胆固醇肽经凝胶葡聚糖Sephadex G-50分离纯化后,胆固醇胶束溶解度抑制活性从24.18%提高到至57.48%,分子量分布在2 000~4 700 u范围内。研究结果表明,采用凝胶过滤色谱法纯化乳清蛋白降胆固醇肽是完全可行的,在提高活性肽生物活性的同时,还可以对活性肽的相对分子质量分布进行分析。但是经凝胶过滤色谱纯化后的乳清蛋白降胆固醇肽还不是单一组分,在下一步的工作中,将运用反相高效液相色谱对其进一步纯化。
[1]包怡红,李锐达.乳清多肽的分离纯化及体外抗氧化活性研究[J].中国乳品工业,2011,39(10):12-14.
[2]刘玉军,魏永利,代龙.肽的分离纯化研究进展[J].辽宁中医杂志,2012,39(1):180-181.
[3]NAGAOKA S,KANAMARU Y,FUTAMURA Y,et al.Identification of novel hypocholesterolemic peptides derived from bovine milk β-lactoglobulin[J].Biochemical and Biophysical Research Communications,2001,281(1):11-17.
[4]于志鹏,赵文竹,刘静波,等.蛋清蛋白质降压肽纯化及分子量测定[J].食品工业科技,2010,31(7):230-232.
[5]PAN D D,CAO J X,GUO H Q,et al.Studies on Purification and the Molecular Mechanism of a Novel ACE Inhibitory Peptide from Whey Protein Hydrolysate[J].Food Chemistry,130(2012)121-126.
[6]ZHONG F,MA J G,CHARLES F S,et al.Preparation of Hypocholesterol Peptides from Soy Protein and their Hypocholesterolemic Effect in Mice[J].Food Research International,40(2007)661-667.
