婴幼儿配方奶粉中邻苯二甲酸酯的固相萃取净化-气相色谱-质谱法测定
2014-07-13苗宏健鲁杰梁丽娜赵云峰
苗宏健,鲁杰,梁丽娜,赵云峰
(1.国家食品安全风险评估中心 卫生部食品安全风险评估重点实验室,北京 100021;2.赛默飞世尔科技(中国)有限公司,北京 100044)
0 引 言
邻苯二甲酸酯(PAEs)可通过迁移、挥发等途径对食品造成污染[1],部分PAEs具有内分泌干扰作用[2-3]。为降低PAEs对健康的影响,欧盟指令No 10/2011及我国GB9685规定含PAEs材料不得接触婴幼儿配方食品[4-5]。
婴幼儿配方奶粉基质复杂,良好的样品前处理和质量保证是确保检测结果可靠性的关键环节。目前,针对婴幼儿配方奶粉的前处理方法主要以液液萃取法(LLE)[6-7]、固相萃取法(SPE)[8-9]和凝胶渗透色谱法(GPC)为主[10]。SPE较其他方法试剂使用量小,可有效降低试验空白,但方法特异性、推广性和实用性需进一步论证。本文采用前期建立的PAEs测定同位素稀释气相色谱-质谱法[10],通过不同前处理方法的比较和优化,选择PSA/Slica的SPE净化方式,建立了适合于婴幼儿配方奶粉中PAEs的快速测定方法。
1 材料与方法
1.1 试剂与仪器
布鲁克450气相色谱仪-320质谱仪,PSA/Silica固相萃取柱 (1 000 mg/6 mL, 玻璃材质),Extrelut NT(Merck KGaA, 德 国 )、AccuPrep MPSTM及 AccuVap FLXTM(J2 Scientific,美国),乙腈(Fisher,HPLC 级,美国),二氯甲烷(DikmaPure,农残级),正己烷(TEDIA,Spectro级)。
邻苯二甲酸酯标准品溶液(CDN Isotopes INC.,1 000 μg/mL,溶剂为正己烷):邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二苯酯 (DphP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二壬酯(DNP); D4-邻苯二甲酸酯标准品(CDN Isotopes INC.,与上述标准溶液中16种标准品一一对应,纯度大于99.7%)
1.2 方法
1.2.1 标准曲线配制
将16种邻苯二甲酸酯标准品溶液以正己烷稀释至质量浓度为10 μg/mL中间液,将16种D4-邻苯二甲酸酯分别以称重法配制成质量浓度为10 μg/mL乙腈和正己烷标准中间液。准确移取邻苯二甲酸酯及D4-邻苯二甲酸酯的中间液,配制成系列标准溶液,D4-邻苯二甲酸酯质量浓度为0.1 μg/mL,邻苯二甲酸酯的标准曲线工作范围为0.02~2.0 μg/mL。
1.2.2 样品提取
称取0.5 g(精确至0.01 g)样品于10 mL具塞玻璃刻度管,加入乙腈内标工作液40 μL,移取2 mL去离子水与样品混溶。提取前加入1.0 g NaCl,以2 mL乙腈涡旋提取2 min,3次提取,3 000 r/min以上离心5 min,取2 mL上清液待净化。
1.2.3 样品净化
将PSA/Silica固相萃取柱以5 mL二氯甲烷和5 mL乙腈活化后,以2 mL提取液上样,以2 mL乙腈洗脱样品,将4 mL乙腈接收。氮气吹至近干后,以2 mL正己烷复溶,3 000 rpm以上离心5 min,上清液进气相色谱-质谱仪检测。
1.2.4 色谱及质谱条件
气相色谱参考条件:DB-5ms UI石英毛细管柱,柱长30 m,内径0.25 mm ,膜厚0.25 μm;高纯氦气,纯度≥99.999%,恒流模式,流速1.0 mL/min;进样口温度260℃;升温程序为初温60℃,保持1 min,以20℃/min升至220℃,保持1 min,再以5℃/min升至280℃,保持10 min;以20℃/min升至300℃,保持4 min。进样方式,柱上不分流进样;进样量1 μL;传输线温度280℃。
质谱参考条件:电子轰击源(EI);电离能量70 eV;离子源温度250℃;溶剂延迟6 min。
1.2.5 定性及定量离子
定性及定量离子参见文献[10]。
2 结果与讨论
2.1 条件优化
2.1.1 样品提取液的选择
婴幼儿配方奶粉基质复杂,含有大量脂肪、蛋白质、脂溶性维生素等干扰PAEs准确定量的物质。因此,对样品进行有效的提取,是定量分析PAEs的重要环节。提取溶剂的选择主要包括两种:Lambert[6]以正己烷与甲基叔丁基醚作为萃取溶液对样品进行提取,以乙腈反提正己烷。杨国良等[7]直接以乙腈对样品进行提取。本文对两种提取方式进行比较后发现:以Lambert[6]方法提取,提取液大部分与样品结合成胶状,有乳化现象。同时以乙腈反提后,除DNOP、DNP外,其余PAEs基本无法从正己烷中提出,损失较大,且样品有基质效应干扰,需串接质谱检测排除干扰;直接以乙腈提取,由于样品中包裹DNOP和DNP等物质,其绝对回收率均在50%以下。近期,Mir等[11]研究分散液液微萃取牛奶中PAEs时发现,乙腈可促进牛奶中蛋白质沉降,破除乳化现象;且在盐的作用下,相比甲醇、丙酮和四氢呋喃等类似溶剂,乙腈与水的分层度最佳,利于提取。因此,本文在结合相关研究的基础上,最终确定了以去离子水溶解样品后,乙腈提取,NaCl破除乳化的样品提取方案。
2.1.2 净化手段的选择
本文以LLE、SPE及GPC方法进行样品前处理比较。样品取样量及D4-PAEs检测浓度一致。GPC方法参数参见文献[10],其他如表1所示。由图1可以看出,直接以液液萃取法提取样品带有杂质,影响DNOP和DNP定量分析。以弗罗里硅藻土净化提取液,分析物和杂质在柱上不保留,净化效果差,无法减除杂质对定量的影响。以GPC进行净化时,分子量较大的DNOP和DNP等的绝对回收率较低,且所用溶剂量较大。以PSA/Silica净化时,杂质保留柱上,PAEs被洗脱,DNOP和DNP的定量干扰被排除。近期WANG[8]和LIU[9]等采用的Fe3O4@SiO2-G或C18-Fe3O4@mSiO2固相萃取体系净化奶制品,方法新颖性强,但此类实验操作较为复杂,且具有很强的特异性,其实用性和推广性仍需论证。而本文采用的固相萃取柱为成熟产品,经济实用且推广性较强。且本方法所用溶剂量小,操作简单快捷,减除基质干扰明显,适用于快速高效准确的检测奶粉中PAEs。
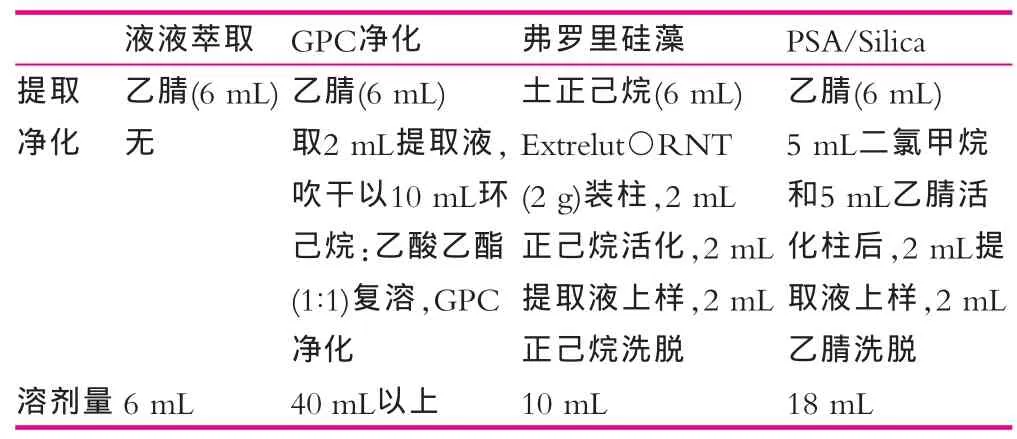
表1 样品提取及净化方式
2.2 线性试验和灵敏度
本方法采用在空白样品中加入标准溶液(10 μg/mL)的方法,按照IUPAC和美国化学联合会中环境分析化学的规定平行测定20次得出[12]。16种PAEs的检出限在15~30 μg/kg,定量限为50~100 μg/kg。 其中,DMEP、DEEP及DBEP的检出限与定量限高于其余PAEs,这主要是因为DMEP、DEEP及DBEP碳链的化学结构与其他PAEs不同,造成其定量离子m/z 149的前体离子裂解效率低,m/z 149分子离子峰面积响应低导致。

图1 婴幼儿配方奶粉的前处理方式比较
2.3 准确度和精密度
依照本方法的定量限,在含量低于方法检出限的样品中加入混合标准溶液,进行加标回收率实验,加标浓度分别为各PAEs定量限的1倍、3倍和5倍,平行测试6次。由图2看出,婴幼儿配方奶粉的加标回收率在74%~124%之间。计算平行测定的RSD,在0.78%~7.1%之间。

表2 方法的线性、检出限和定量限 μg/kg

图2 婴幼儿配方奶粉的加标回收率
2.4 实际样品测定
为验证方法适用性,本文对市售的37份婴幼儿配方奶粉进行检测。结果如表3所示,样品中主要检出DMP、DEP、DBP和DEHP。其中,婴幼儿配方奶粉中DBP最大值为165 μg/kg,含量约为卫生部发布的551号文件《卫生部办公厅关于通报食品及食品添加剂中邻苯二甲酸酯类物质最大残留量的函》中规定的DBP在食品中最大残留量300 μg/kg的55%;而DEHP测试值均在定量限以下,最大值为文件规定最大残留量的2.8%。

表3 样品测试结果(n=3)
3 结 论
本文以乙腈作为提取剂,采用PSA/Silica柱固相萃取净化,建立了婴幼儿配方奶粉中PAEs测定的同位素稀释气相色谱-质谱法。本方法简便快捷,准确可靠。
[1]WITTASSEK M,KOCH H M,ANGERER J,et al.Assessing exposure to phthalates—the human biomonitoring approach[J].Molecular Nutrition&Food Research,2011,55:7-31.
[2]SHER S,STEVE S L.Phthalates:Toxicogenomics and inferred human diseases[J].Genomics,2011,97(3):148-157.
[3]LATINI G,VERROTT A,DE FELICE C.Di-2-ethylhexyl phthalate and endocrine disruption:a review[J].Current Drug Targets-Immune,Endocrine&Metabolic Disorders,2004,4:37-40.
[4]Official Journal of the European Union.COMMISSION REGULATION(EU)No 10/2011 of14 January 2011on plastic materials and articles intended to come into contact with food[S].2011-01-15.
[5]中华人民共和国卫生部.GB9685-2008食品容器、包装材料用添加剂使用卫生标准[S].北京:中国标准出版社,2008.
[6]LAMBERT K S.Determination of phthalates in milk and milk products by liquid chromatography/tandem mass spectrometry [J].Rapid Communications in Mass Spectrometry,2006,20(7):1135-1143.
[7]杨国良,孔福奎,张开翔,等.气相色谱-质谱法测定婴幼儿配方乳粉及原料中15种邻苯二甲酸酯[J].食品安全质量检测学报,2013,4(3):699-704.
[8]WANG W,MA R,WU Q,et al.Fabrication of magnetic microsphere-confined graphene for the preconcent ration of some phthalate esters from environmental water and soybean milk samples followed by their determination by HPLC[J].Talanta,2013,109:133-140.
[9]LIU X,YU Y,ZHAO M,et al.Solid phase extraction using magnetic core mesoporous shell microspheres with C18-modified interior porewalls for residue analysis of cephalosporins in milk by LC-MS/MS[J].Food Chemistry,2014,150:206-212.
[10]杨欣,陈达炜,苗虹,等.同位素稀释凝胶渗透色谱-气相色谱-质谱法测定膳食样品中16种邻苯二甲酸酯类物质[J].中国食品卫生杂志,2014,26(1):41-46.
[11]MIR A F,DJAVANSHIR D,MOHAMMAD R A,et al.Determination of phthalate esters in cow milk samples using dispersive liquidliquid microextraction coupled with gas chromatography followed by flame ionization and mass spectrometric detection[J].Journal of Separation Science,2012,35,742-749.
[12]JÁNOS I,TAMÁZ L,ALLAN M U,et al.Compendium of Analytical Nomenclature[M].United States:International Union of Pure and Applied Chemistry,1998.
