含双歧杆菌的婴儿配方奶粉和原料中阪崎肠杆菌的检测
2014-07-13姜勇吕学娜安玉枝王锡青
姜勇,吕学娜,安玉枝,王锡青
(圣元营养食品有限公司,山东 青岛266400)
0 引 言
双歧杆菌 (Bifidobacterium)是人体肠道内数量最多、功能最重要的益生菌,革兰氏阳性、无芽胞,通过定植于肠黏膜上皮细胞表面,形成一个生物学屏障,阻止和抑制各种致病菌与条件致病菌在肠道的定植、入侵和生长繁殖[1]。阪崎肠杆菌(Enterobacter sakazakii)是一种有周生鞭毛、能运动、无芽孢、兼性厌氧的革兰氏阴性致病菌。新生儿感染该菌可导致脑膜炎、坏死性小肠结肠炎和菌血症,感染引起的死亡率高达50%以上[2,3]。目前国家婴儿配方食品标准GB 10765中规定阪崎肠杆菌的限量为0/100g[4],指定的检测方法为GB 4789.40[5];对添加活性菌种的产品规定为活性益生菌数应≥106CFU/g(mL)[4]。有文献报道益生菌对肠道致病菌有抑制作用[6,7],其作用机理主要在于竞争性抑制或生长代谢过程中产生某些抑菌物质[8-10]。本研究的目的在于考察按照GB 4789.40检测阪崎肠杆菌,双歧杆菌的存在是否会影响检测结果;在证实抑制作用存在后,对检测方法进行了改进。
1 材料与方法
1.1 材料与试剂
原料A:双歧杆菌(BI-07,1011g-1);样品A:婴儿配方奶粉(添加BI-07,107g-1);样品B:婴儿配方奶粉(与样品A的差别仅在于未添加BI-07)。阪崎肠杆菌标准菌株(ATCC 51329),缓冲蛋白胨水(BPW),改良月桂基硫酸盐胰蛋白胨肉汤(mLST),阪崎肠杆菌显色培养基,胰蛋白胨大豆琼脂(TSA),MRS培养基,营养肉汤,万古霉素,莫匹罗星锂盐。API 20 E肠杆菌和其他革兰氏阴性杆菌鉴定系统。
1.2 仪器与设备
TG16-WS台式高速离心机,BBL CrystalTMSpec比浊计,LRH-150F生化培养箱。
1.3 方法
1.3.1 阪崎肠杆菌的检测
按GB 4789.40进行阪崎肠杆菌的检测[5],检测程序如图1所示。
1.3.2 双歧杆菌的计数
按GB 4789.35进行双歧杆菌的计数[11]。
1.3.3 标准菌悬液的制备
阪崎肠杆菌标准菌株经复活后转接营养肉汤,36℃±1℃培养24 h±2 h后,离心该培养液10 min(2 000转/min),弃去上清液。用10 mL无菌生理盐水振荡洗涤菌体,离心10 min(2 000 r/min),弃去上清液。如此洗涤离心操作2次,再加10 mL无菌生理盐水混匀,配制成菌悬液。用浊度计测量麦氏浊度并按GB4789.2进行计数[12]。以上操作均为无菌操作。
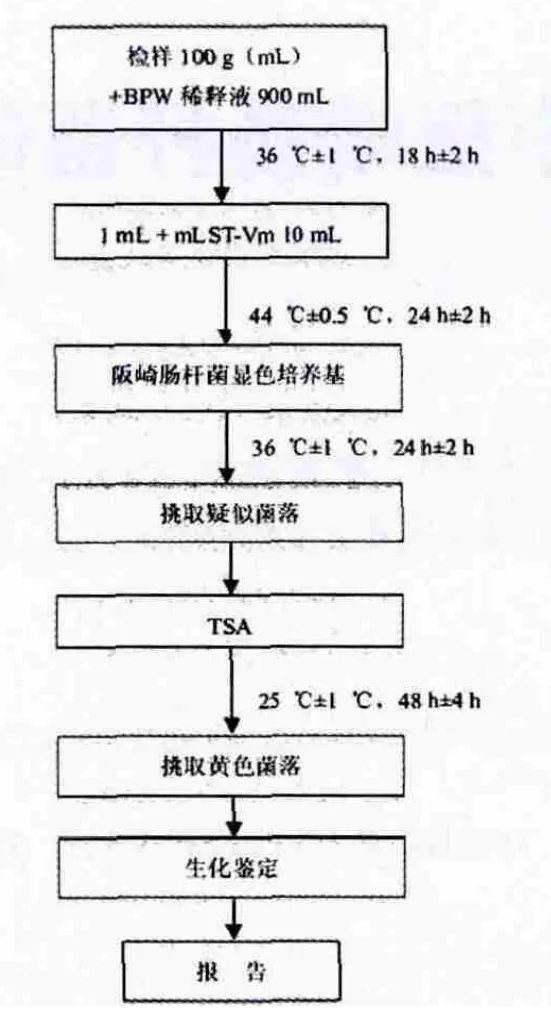
图1 GB 4789.40阪崎肠杆菌检测程序
以菌悬液浓度对相应的浊度值作图,得菌液浓度与浊度关系曲线(图2)。在之后的实验中,通过测定所制备的菌悬液的浊度,从而查得菌液浓度,然后根据所需菌液浓度用无菌生理盐水做梯度稀释。

图2 菌液浓度与浊度关系曲线
1.3.4 阪崎肠杆菌阳性对照的检测
在按GB 4789.40程序进行检测的第一步,即100 g检样加入900 mL BPW稀释液的同时,加入一定量已知浓度的阪崎肠杆菌菌悬液,然后再按照后续步骤进行。
2 结果与分析
2.1 含双歧杆菌的婴儿配方奶粉的检测
对表1所列检样进行阪崎肠杆菌的检测。其中在样品A阪崎肠杆菌阳性对照1和样品B阪崎肠杆菌阳性对照1中分别加入浓度为100 mL-1的阪崎肠杆菌菌悬液1 mL,折算到检样中的含量分别为0.01 g-1;在样品A阪崎肠杆菌阳性对照2和样品B阪崎肠杆菌阳性对照2中分别加入浓度为101mL-1的阪崎肠杆菌菌悬液1 mL,折算到检样中的含量分别为0.10 g-1,检测结果如表1所示。
由结果分析可知,当婴儿配方奶粉中双歧杆菌含量为107g-1时,可以对含量为10-2g-1的阪崎肠杆菌产生抑制,从而使检测结果呈现假阴性;而当阪崎肠杆菌含量增至10-1g-1时,不能被完全抑制,检测结果呈阳性。因为国家标准对婴儿配方食品中阪崎肠杆菌的限量值为每100 g不得检出,所以当含双歧杆菌的婴儿配方奶粉中,阪崎肠杆菌含量在10-2g-1水平时,按GB 4789.40进行检测存在假阴性风险。
2.2 双歧杆菌原料的检测
对表2所列检样进行阪崎肠杆菌的检测。因为双歧杆菌在原料A中的含量为1011g-1,在样品A中的含量为107g-1,按此比例计算原料A在样品A中的添加量为1/1 000;若阪崎肠杆菌在样品A中的含量分别为10-2g-1和10-1g-1水平,且全部来源于原料A,则其在原料A中的含量分别为102g-1和103g-1。因此在原料A阪崎肠杆菌阳性对照1和空白阪崎肠杆菌阳性对照1中分别加入104mL-1的阪崎肠杆菌菌悬液1 mL,折算到检样中的含量分别为102g-1;在原料A阪崎肠杆菌阳性对照2和空白阪崎肠杆菌阳性对照2中分别加入105mL-1的阪崎肠杆菌菌悬液1 mL,折算到检样中的含量分别为103g-1,检测结果如表2所示。
由结果分析可知,当原料中双歧杆菌含量为1011g-1时,可以对含量为102g-1和103g-1的阪崎肠杆菌产生抑制,从而使检测结果呈现假阴性;而其对应的产品检测结果分别为假阴性和阳性。可见采用GB 4789.40作为双歧杆菌原料中阪崎肠杆菌的检测方法时,也存在假阴性风险。
2.3 抑制机理研究
根据GB 4789.40检测程序,阪崎肠杆菌的检测过程中存在两步增菌,第一步先用BPW(缓冲蛋白胨水)增殖肠道菌,第二步再用mLST-Vm(改良月桂基硫酸盐胰蛋白胨肉汤-万古霉素)选择性增殖革兰氏阴性肠道菌,其中加入万古霉素的作用就是选择性抑制革兰氏阳性菌,而双歧杆菌是革兰氏阳性菌,理应在此步中被抑制,因此双歧杆菌对阪崎肠杆菌的抑制作用很有可能发生在第一步增菌过程。为验证此推断,在第一步增菌后,省略第二步增菌,直接划阪崎肠杆菌显色培养基,并进行后续检测,实验结果如表3所示。由此可见,省略第二步增菌后的检测结果与之前的检测结果是一致的,证实双歧杆菌对阪崎肠杆菌的抑制作用发生在第一步增菌过程。
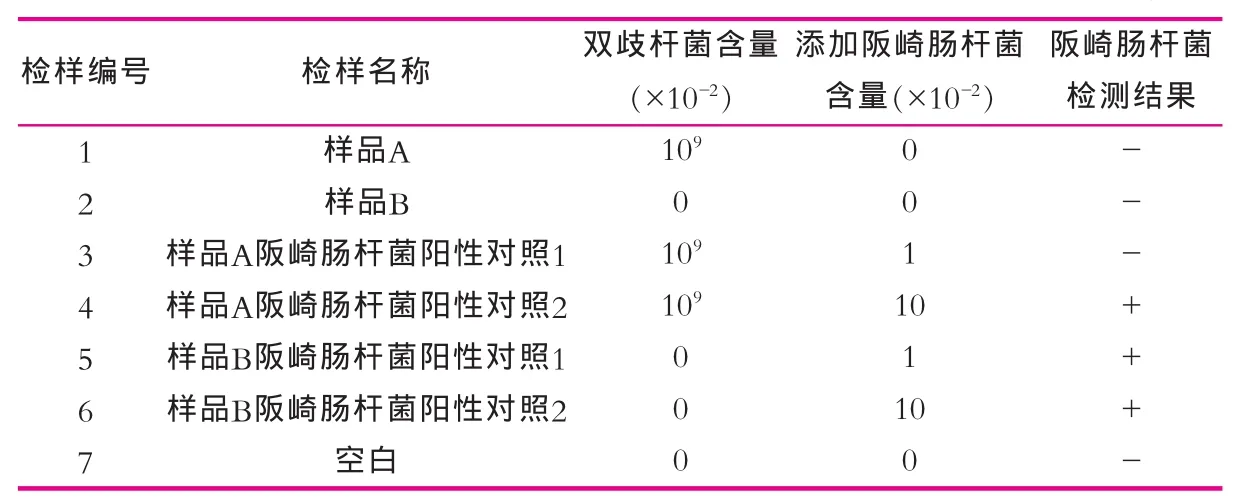
表1 含双歧杆菌的婴儿配方奶粉的阪崎肠杆菌检测结果 g-1

表2 含双歧杆菌的原料的阪崎肠杆菌检测结果 g-1

表3 省略第二步增菌后的阪崎肠杆菌检测结果
分别对样品A和原料A在第一步增菌前后的双歧杆菌含量进行测定,结果如表4所示。由表中数据可以看出,虽然从微生物学角度来说双歧杆菌并未显著增殖,但是对于如此高浓度的初始菌含量,可以通过占优势的双歧杆菌的竞争性代谢活动,迅速消耗第一步增菌培养基中的营养物质,从而极大程度的抑制处于弱势的阪崎肠杆菌的生长繁殖。

表4 增菌前后双歧杆菌的含量 mL-1

表5 方法改进后阪崎肠杆菌的检测结果
2.4 检测方法改进
检测方法的改进,主要从如何抑制双歧杆菌的生长,促进阪崎肠杆菌的增殖两方面考虑。可以通过添加选择性抑制剂,或增大稀释液的用量以降低双歧杆菌对阪崎肠杆菌的抑制作用等方法来实现。在第一步增菌过程中,分别考察在BPW中加入万古霉素(终质量浓度为10 mg/L)和增大BPW稀释液用量至1∶100;对含双歧杆菌的婴儿配方奶粉和原料的阪崎肠杆菌阳性对照样品进行检测,结果如表5所示。
由结果分析可知,在BPW中加入终质量浓度为10 mg/L万古霉素,可以避免双歧杆菌含量为107g-1的婴儿配方奶粉的阪崎肠杆菌检测结果的假阴性;而对双歧杆菌含量为1011g-1的原料,检测结果仍为假阴性,可能是因为双歧杆菌含量太高所致。增大BPW稀释液用量至1∶100,对含双歧杆菌的婴儿配方奶粉和原料的阪崎肠杆菌的检测,均可避免结果的假阴性。
3 结 论
本课题的研究表明,对于含双歧杆菌的婴儿配方奶粉和原料,按照GB 4789.40进行阪崎肠杆菌的检测,检测结果存在假阴性风险。通过添加万古霉素,或增大BPW稀释液的用量,可以降低双歧杆菌对阪崎肠杆菌的抑制作用,从而避免检测结果的假阴性,保证产品的质量与安全。而双歧杆菌对阪崎肠杆菌的抑制限需做进一步研究;万古霉素的添加量、BPW稀释液的使用量也需进一步优化。
[1]MATSUMOTO M,BENNO Y.Consumption of Bifidobacterium lactis LKM512 yogurt reduces gut mutagenicity by increasing gut polyamine contents in healthy adult subjects[J].Mutat Res,2004,568(2):147-153.
[2]Joint FAO/WHO Workshop on Enterobacter sakazakii and other Microorganisms in Powdered Infant Formula,Geneva,2004[C].
[3]HEALY B,COONEY S,O'BRIEN S,et al.Cronobacter(Enterobacter sakazakii): an opportunistic foodborne pathogen [J].Foodborne Pathog Dis,2010,7(4):339-350.
[4]中华人民共和国卫生部.GB 10765-2010食品安全国家标准 婴儿配方食品[S].2010.
[5]中华人民共和国卫生部.GB 4789.40-2010食品安全国家标准 食品微生物学检验阪崎肠杆菌检验[S].2010.
[6]BULLEN C L,TEARLE P V,WILLIS A T.Bifidobacteria in the intestinal tract of infants: an in-vivo study[J].J Med Microbiol,1976,9(3):325-333.
[7]赵智兴.乳酸菌发酵上清液对肠道致病菌抑菌特性的研究 [D].中国农业科学院,2006.
[8]康白.双歧杆菌的微生态学及临床意义 [J].中华儿科杂志,1999(05):54-56.
[9]卢金星,张旭帆,李革,等.试管内双歧杆菌、复方双歧杆菌制剂对肠道致病菌的拮抗作用[J].中国微生态学杂志,1990(01):15-18.
[10]梁冰,吴力克,姜峰,等.双歧杆菌QJ405、乳杆菌QJ405在试管内对肠道致病菌抑杀效果的初步报告[J].中国微生态学杂志,2000(05):25-27.
[11]中华人民共和国卫生部.GB 4789.35-2010食品安全国家标准 食品微生物学检验乳酸菌检验[S].2010.
[12]中华人民共和国卫生部.GB 4789.2-2010食品安全国家标准 食品微生物学检验菌落总数测定[S].2010.
