基于Demons算法的MR图像与病理切片的非刚性配准
2014-06-13史长征罗嘉莉曾德威
赵 倩,史长征,罗嘉莉,曾德威,陈 婷
(1.广州医科大学公共卫生学院统计系 广东 广州 510182;2.暨南大学附属第一医院医学影像中心 广东 广州 510630)
脑胶质瘤是神经系统最常见的原发肿瘤,约占原发性神经系统肿瘤的42%[1]。目前,罹患恶性胶质瘤患者的中位生存期仅为9个月,2年存活率为5%,偏良性胶质瘤患者10年存活率为20%,患者大多在确诊后1 a内死亡[2]。MRI检查具备较高的软组织分辨率和多平面、多方位成像,对脑肿瘤的诊断有重要价值。为研究不同病理特征所对应的MR参数特点,首先需要获取肿瘤相应层面的全面病理信息,这在人脑胶质瘤中通常难以实现。本研究基于SD大鼠的C6胶质瘤模型获取其肿瘤的病理切片,进一步探讨如何将MR图像与病理切片图像进行有效配准。
基于光流场的Demons算法是一种较为稳定的非刚性配准算法[3]。近年来,为达到更准确、更快速的配准变换,国内外一些学者提出了一种可用于多模态图像配准的改进Demons算法[4-6]。在Demons算法单纯利用参考图像梯度信息为驱动图像变形力的基础上,结合两幅图像的互信息,作为当前变换的附加力,并将浮动图像的梯度信息加入到光流场方程中。最终把参考图像梯度和图像互信息共同作为内力使浮动图像向两幅图像互信息增大的方向变形。
本课题组采用Demons算法对脑胶质瘤MR图像和病理切片进行非刚性配准,结合MR图像与病理切片的灰度信息,对病理切片进行变形。初步判断脑胶质瘤在脑组织中的真实区域,排除脑肿瘤周边水肿或其它临床指征对判别肿瘤区域的影响,最终获取较好的配准结果。
1 材料和方法
1.1 大鼠C6胶质瘤模型 SD大鼠禁食12 h,腹腔注射麻醉后,立体定位仪固定头部。取单侧尾壳核为接种点,采用微量注射器抽取10 μl C6胶质瘤细胞悬液,将细胞悬液注入接种点,缝合头皮,消毒切口,常规饲养。
1.2 MR扫描和图像后处理 采用GE signa 1.5T磁共振成像系统和八通道的腕线圈(GE Healthcare,Milwaukee,WI),SD大鼠在接种C6胶质瘤细胞第2周进行MR检查。冠状面T2加权成像(TR/TE:2 960/68 ms;矩阵:256×192),T1加权成像(TR/TE:300/10 ms;矩阵:256 ×192),扫描层厚2.0 mm,层距0 mm,矩阵284×224,FOV=80 mm ×80 mm,激励次数(NEX)=2次。平扫后马上行增强扫描,造影剂0.1 mmol/kg,扫描参数同T1加权成像。
1.3 病理标本 大鼠行MRI检查后立即处死开胸,鼠体僵硬后断头取脑,对应MRI扫描中心层面将鼠脑切片取材,石蜡包埋,以5 μm层厚连续切片,行常规病理学检查、HE染色、拍照,获取病理图片,见图1。
1.4 图像预处理 采用Matlab R2012b对获得的T1加权成像增强(T1增强)图像(图1a)和病理图像(图1b)进行预处理。首先对照彩色病理图像,在T1增强中选出相应的病灶区域,去除多余的图像背景(图1c);然后将彩色病理图像转化为灰度图像,基于最近邻域法对缺失区域进行补充,使病理图片上肿瘤位置与MR图像基本一致;最后采用双立方插值法,将病理图像和T1增强图像的分辨率调至一致(图1d)。
2 Demons算法及结果
Demons算法是一种基于光流理论的配准方法,假设图像在运动的过程中灰度保持不变,通过像素的运动完成两幅图像配准[3]。对于浮动图像M和参考图像F,需要找出一个形变向量u驱驶浮动图像中的每个像素点向参考图像中对应点移动。给定一个点p,设f是参考图像F上的灰度,m是浮动图像M上的灰度。则有:

其中,▽f为参考图像F的梯度向量。改进后的形变向量增加了浮动图像的梯度信息,并通过参数α控制形变向量的大小,提高了配准的速度和稳定性[4]。

配准实际上就是寻找一个形变向量u,使得形变后浮动图像和参考图像能较为相似。通常采用均方误差作为相似性测度,当▽E(u)=0时,取得最优解[5-6]:
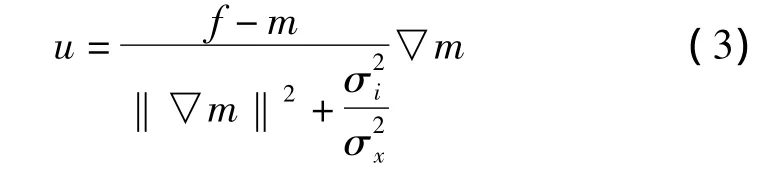
将预处理后的T1增强图像作为参考图像,病理切片图像作为待配准图像,采用Demons算法进行配准。图1e为Demons算法得到配准后的病理图像,图1f为T1增强图像与配准后病理图像的融合。配准后互信息为 0.68。
3 讨论
经MR扫描后,可直接观测脑肿瘤的侵犯范围、解剖位置和大小,但难以给出肿瘤的病理信息。病理切片虽然能准确地给出肿瘤组织的病理和分级结果,但在制作过程中,由于化学物质的影响,肿瘤会出现脱水皱缩现象。因此,若能将MR图片和病理切片图片进行有效的配准,就能全方面地得到肿瘤的解剖信息和病理信息。
本文以T1增强为参照图像,病理切片图像为浮动图像,采用Demons算法配准后,原本有皱缩现象的病理切片已发生变形,肿瘤边界向四周延伸。配准后的病理图像与MR图像的肿瘤轮廓已基本达到一致,基本还原至T1增强肿瘤的范围、位置、大小。
配准后的病理图像,不但保留了金标准病理切片“病变部位与正常组织存在清晰边界”的特点,而且肿瘤分布与MR图像基本吻合,可认为是脑肿瘤在脑组织中接近真实的反映。本文对病理切片和MR图像的配准进行尝试,进一步证明Demons算法对多模图像配准的有效性,具有较好的速度和精度。
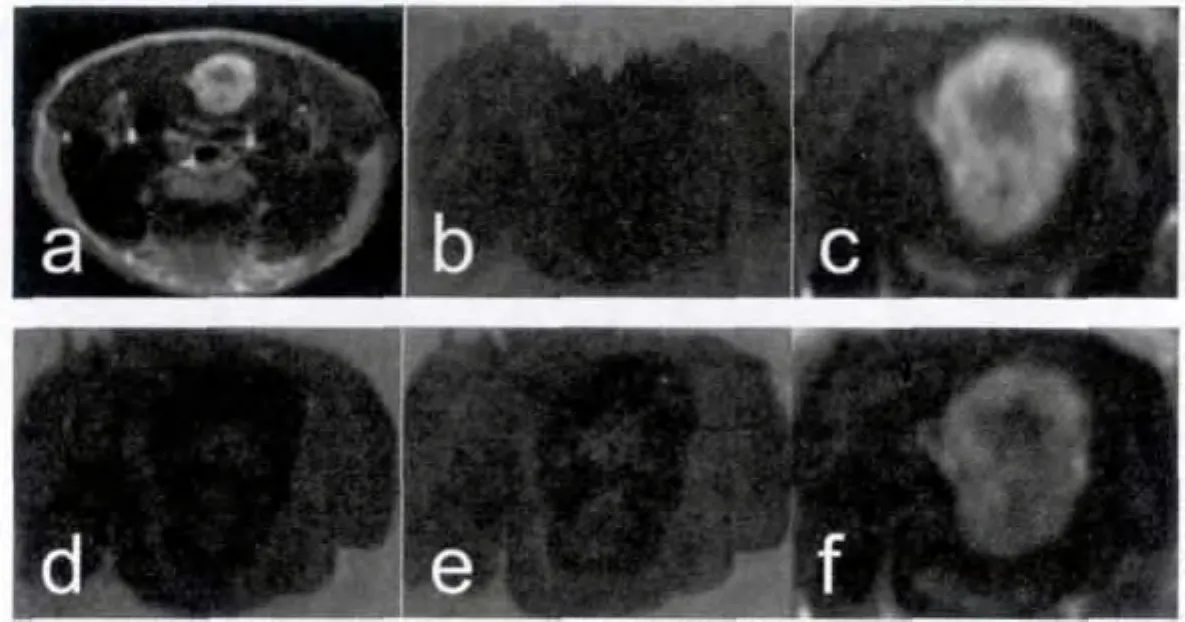
图1 Demons算法配准结果
[1] 陈忠平,重视胶质瘤的规范化治疗[J].中国临床神经外科杂志,2007,12(5):257-258.
[2] Gilbertson R J,Rich J N.Making a tumour’s bed:glioblastoma stem cells and the vascular niche[J].Nature Reviews Cancer,2007,7(10):733-736.
[3] Thirion J P.Image matching as a diffusion process:an analogy with Maxwell’s Demon[J].Medical Image Analysis,1998,2(3):243-258.
[4] Wang H,Dong L,O’Daniel J,et al.Validation of an accelerated 'demons'algorithm for deformable image registration in radiation therapy[J].Phys Med Biol,2005,50(12):2887-2905.
[5] Vercauteren T,Pennec X,Malis E,et al.Insight into efficient image registration techniques and the demons algorithm[J].Inf Proc Process Med Imaging,2007,(20):495-506.
[6] Kroon D J,Slump C H.MRI modalitiy transformation in demon registration[C].Boston,USA:IEEE International Symposium on Biomedical Imaging:From Nano to Macro,2009:963-966.
