基质金属蛋白酶及其抑制因子与宫颈癌浸润转移的关系分析
2014-06-13杜莹莹李真珍张胜军
游 泳,杜莹莹,曹 媛,李真珍,张胜军
(1.郑州大学第一附属医院妇产科 河南 郑州 450052;2.河南省高等学校临床医学重点学科开放实验室 河南 郑州 450052)
宫颈癌是女性常见的恶性肿瘤之一,早期就可经淋巴转移,预后较差,严重威胁女性的生命健康。肿瘤的侵袭和转移是导致宫颈癌患者预后不佳的主要原因,如何有效控制宫颈癌的侵袭和转移是当前亟待解决的课题。有报道称,肿瘤侵袭正常组织及转移必须突破细胞外基质(extracelluar matrix,ECM),在ECM成分降解过程中基质金属蛋白酶(matrix metalloproteinase,MMPs)发挥了重要作用[1]。基质金属蛋白酶组织抑制物(tissu inhibitor of matrix metalloproteinase,TIMPs)是MMPs特异性抑制物,抑制MMPs在肿瘤侵袭转移中的活性[2]。目前,已有少量文献报道MMPs和TIMPs与宫颈癌的发生、发展有关[3],但其在宫颈癌中确切的表达情况及其与临床分期、临床分级、间质浸润和淋巴结转移等临床病理因素的关系尚不完全清楚,且有关 MMP-2、MMP-9和 TIMP-2、TIMP-1联合检查及表达研究较少。本研究通过分析MMP-2、MMP-9和TIMP-2、TIMP-1在宫颈癌中表达情况,探讨其与宫颈癌侵袭转移的关系,为宫颈癌侵袭转移的潜能评价提供参考依据。
1 材料与方法
1.1 临床资料 选取2009年6月至2013年8月郑州大学第一附属医院经病理证实的早期宫颈浸润癌患者108例(ICC组)。年龄36~72岁,平均(60.6±5.2)岁。按照国际妇产科联盟(FIGO)标准分期:Ⅰa期22例、Ⅰb期24例、Ⅱa期28例、Ⅱb期34例;组织学分级:G122例、G230例、G356例。镜下早期浸润18例、间质浸润90例;病理学类型:鳞癌81例、腺癌27例;伴有脉管浸润33例、盆腔淋巴结转移27例。另选取同期行子宫全切或宫颈锥切的宫颈上皮内瘤样病变(CIN)患者65例(CIN组)。年龄33~74岁,平均(57.2±6.1)岁。同时取同期因子宫肌瘤行子宫全切术的正常宫颈组织标本40例为对照组,年龄35~61岁,平均(52.5±5.8)岁。所有标本均经病理学确诊,患者均未合并结缔组织病和免疫系统疾病,术前均未接受过放疗、化疗、免疫、冷冻和激光等治疗。
1.2 方法 取ICC组和CIN组切除的病变组织标本2份;对照组任取宫颈组织2份。标本经生理盐水冲洗后,1份行常规病理检查确诊,1份置于-70℃冰箱中保存待检。取待检标本置于离心管中剪碎,采用Trizol试剂(购自美国Invitrogen公司)提取组织总RNA,应用RT-PCR试剂盒(购自上海生物工程有限公司)逆转录合成cDNA,在PCR扩增仪上进行PCR反应。以β-action为内参照,与目的基因同一程序同时扩增。94℃变性 45 min,60℃退火 1 min,72℃延伸 1.5 min,共30个循环,最后72℃延伸7 min。取10 μl PCR扩增产物,进行2%琼脂糖凝胶电泳,后溴化乙锭(0.5 mg/ml)染色。紫外线观测仪检查有无特异条带并摄影,有目的基因条带及内参条带者为阳性表达,只有内参条带者为阴性表达,用图像分析系统(HPIAS-1000)进行图像扫描分析。检测扩增产物含量以MarkerⅠ为分子量标准,目的基因mRNA表达水平=目的基因的灰度值/β-action的灰度值×100%。目的基因和β-action基因序列见表1。

表1 目的基因和β-action基因序列
1.3 参数记录和比较 记录RT-PCR检测各个因子(MMP-2、MMP-9、TIMP-1 和 TIMP-2)的表达水平;比较ICC组、CIN组和对照组各因子表达情况差异。同时记录ICC组患者年龄、FIGO分期、组织学分级、大体类型、组织类型、分化程度、脉管浸润、淋巴结转移和浸润深度等临床病理情况,分析临床病理参数与各因子表达水平的关系。
1.4 统计学方法 应用SPSS 13.0软件进行统计学分析,定量资料以()表示,采用的统计学方法为两随机样本t检验和方差分析。检验水准α=0.05。
2 结果
2.1 各组相关因子的表达水平比较 ICC组MMP-2和MMP-9的表达水平显著高于CIN组和对照组,TIMP-2和TIMP-1的表达水平显著低于CIN组和对照组(P<0.05)。CIN组MMP-2和MMP-9的表达水平显著高于对照组,TIMP-2和TIMP-1的表达水平显著低于对照组(P<0.05)。见表2。
表2 各组相关因子表达水平比较()

表2 各组相关因子表达水平比较()
<0.001 <0.001 <0.001 <0.001组别 n 88 ±12.17 CIN 组 65 73.57 ±17.51 75.68 ±17.15 92.82 ±18.62 91.23 ±19.74对照组 40 35.59 ±9.82 37.26 ±10.54 108.25 ±23.93 110.16 ±22.42 F 163.02 158.33 107.15 126.00 P MMP-2 MMP-9 TIMP-2 TIMP-1 ICC 组 108 96.75 ±21.23 94.27 ±19.35 66.51 ±11.96 63.
2.2 临床病理参数与相关因子表达水平的关系
ICC组中,Ⅱ期、G3级、低分化、有脉管浸润、有淋巴结转移、有间质浸润的患者MMP-2和MMP-9的表达水平分别显著高于Ⅰ期、G1-G2级、中-高分化、无脉管浸润、无淋巴结转移、无间质浸润的患者(P<0.05),而TIMP-1和TIMP-2的表达水平分别显著低于Ⅰ期、G1-G2级、中-高分化、无脉管浸润、无淋巴结转移、无间质浸润的患者(P<0.05)。各因子的表达水平在不同大体类型、不同组织类型之间差异无统计学意义(P>0.05)。见表3。
表3 临床病理参数与ICC组相关因子表达水平的关系()
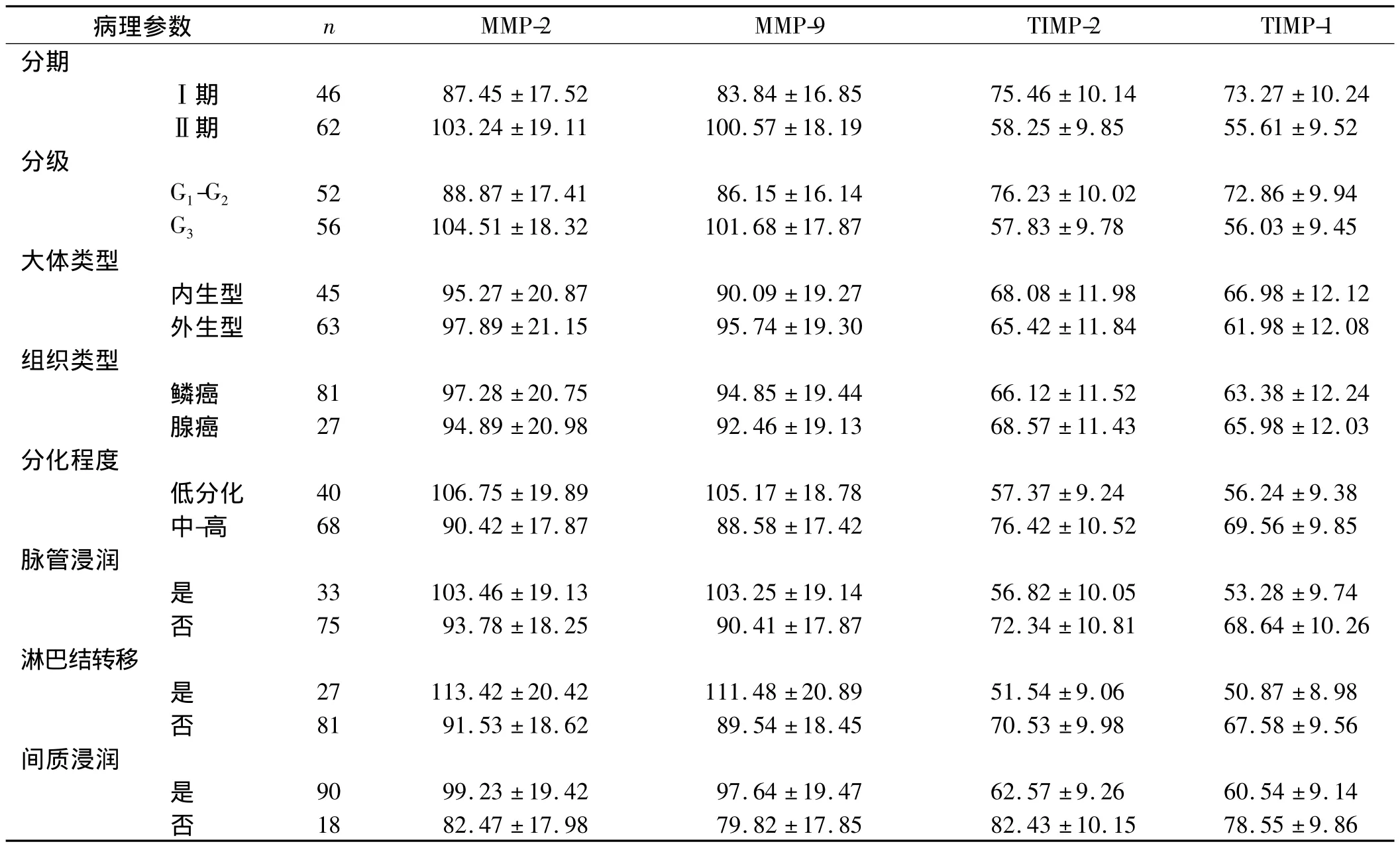
表3 临床病理参数与ICC组相关因子表达水平的关系()
病理参数 n MMP-2 MMP-9 TIMP-2 TIMP-1分期Ⅰ期 46 87.45 ±17.52 83.84 ±16.85 75.46 ±10.14 73.27 ±10.24Ⅱ期 62 103.24 ±19.11 100.57 ±18.19 58.25 ±9.85 55.61 ±9.52分级G1-G2 52 88.87 ±17.41 86.15 ±16.14 76.23 ±10.02 72.86 ±9.94 G3 56 104.51 ±18.32 101.68 ±17.87 57.83 ±9.78 56.03 ±9.45大体类型内生型 45 95.27 ±20.87 90.09 ±19.27 68.08 ±11.98 66.98 ±12.12外生型 63 97.89 ±21.15 95.74 ±19.30 65.42 ±11.84 61.98 ±12.08组织类型鳞癌 81 97.28 ±20.75 94.85 ±19.44 66.12 ±11.52 63.38 ±12.24腺癌 27 94.89 ±20.98 92.46 ±19.13 68.57 ±11.43 65.98 ±12.03分化程度低分化 40 106.75 ±19.89 105.17 ±18.78 57.37 ±9.24 56.24 ±9.38中-高 68 90.42 ±17.87 88.58 ±17.42 76.42 ±10.52 69.56 ±9.85脉管浸润是33 103.46 ±19.13 103.25 ±19.14 56.82 ±10.05 53.28 ±9.74否75 93.78 ±18.25 90.41 ±17.87 72.34 ±10.81 68.64 ±10.26淋巴结转移是27 113.42 ±20.42 111.48 ±20.89 51.54 ±9.06 50.87 ±8.98否81 91.53 ±18.62 89.54 ±18.45 70.53 ±9.98 67.58 ±9.56间质浸润是90 99.23 ±19.42 97.64 ±19.47 62.57 ±9.26 60.54 ±9.14否18 82.47 ±17.98 79.82 ±17.85 82.43 ±10.15 78.55 ±9.86
3 讨论
宫颈癌是女性常见的恶性肿瘤之一,位居生殖器官肿瘤死因的首位。虽然以手术、化疗和放疗为主的综合疗效有所提高,但宫颈癌的转移、侵袭和预后不良仍是难题。如何有效预测宫颈癌的侵袭与转移能力,对制定正确的治疗方案及判断预后具有重要的意义。不过目前尚未发现具有特异性的生物学指标可有效预测宫颈癌的侵袭与转移能力。
MMPs在肿瘤的侵袭和转移中发挥重要作用。MMPs通过降解ECM,破坏基底膜屏障及局部的组织结构,使肿瘤细胞浸润周围组织,进而发生远处转移;同时MMPs具有促进新生血管形成的作用,为肿瘤细胞的侵润和转移提供条件[4]。李敏等[5]研究显示,正常宫颈上皮无MMP-2表达,宫颈癌组织中MMP-2表达率为74.5%,其认为MMP-2表达可能与宫颈癌的发生有关。刘嵘等[6]研究发现,宫颈癌患者MMP-9表达阳性率显著高于CIN患者和正常宫颈组织。本研究发现,对照组MMP-2和MMP-9的表达水平显著低于CIN组和ICC组,CIN组MMP-2和MMP-9的表达水平显著低于ICC组。与上述研究结果相似,提示MMP-2和 MMP-9可能与宫颈癌侵袭、转移有关。TIMPs是体内MMP的天然抑制物,与MMPs结合特异性抑制其活性。南云泽等[7]研究显示,TIMP-1在原位宫颈癌和宫颈浸润癌表达率(54.3%和73.5%)显著高于正常宫颈上皮(20.0%)。李芳等[8]研究显示,TIMP-1和TIMP-2在宫颈鳞癌中的表达水平明显低于慢性宫颈炎。本研究发现,对照组TIMP-2和TIMP-1的表达水平显著高于CIN组和ICC组,CIN组TIMP-2和TIMP-1的表达水平显著高于ICC组。与上述研究结果相似,提示TIMP-2和TIMP-1可能与宫颈癌侵袭、转移有关。
寻找敏感而特异的生物学标志物是非创性评估早期恶性肿瘤侵袭能力的研究方向。MMPs和TIMPs与淋巴结转移的相关性已在乳腺癌等肿瘤中得到证实,但其与宫颈癌患者的临床病理因素关系尚不完全清楚。李婵玉等[9]报道称,有淋巴结转移的宫颈癌患者MMP-9表达阳性率明显高于无淋巴结转移的患者,且表达阳性率随着肿瘤浸润程度的增加而明显增加。王德华等[10]研究显示,MMP-2和TIMP-2在宫颈癌的阳性表达率与FIGO分期、组织分级和淋巴结转移有关,随着临床分期升高、组织分级降低和淋巴结转移,MMP-2阳性表达率升高,而TIMP-2阳性表达率降低。张晓莹等[11]研究发现,MMP-9和TIMP-1在宫颈癌的表达率与组织分化程度和淋巴结转移有关,与病理类型和临床分期无关。本研究发现,Ⅱ期、G3级、低分化、有脉管浸润、有淋巴结转移、有间质浸润的ICC患者MMP-2和MMP-9的表达水平分别显著高于Ⅰ期、G1-G2级、中-高分化、无脉管浸润、无淋巴结转移、无间质浸润的患者,而TIMP-1和TIMP-2的表达水平分别显著低于Ⅰ期、G1-G2级、中-高分化、无脉管浸润、无淋巴结转移、无间质浸润的患者。这提示 ICC患者MMP-2、MMP-9、TIMP-1和TIMP-2的表达水平与FIGO分期、组织学分级、分化程度、脉管浸润、淋巴结转移和浸润深度有关。因此,MMP-2、MMP-9、TIMP-1和TIMP-2可能在宫颈癌侵袭与转移中发挥重要作用。
综述所述,MMP-2、MMP-9及其抑制因子TIMP-2、TIMP-1可能在宫颈癌的侵袭与转移中发挥重要作用,其可作为评估宫颈癌侵袭转移潜能的重要指标。有关MMP-2、MMP-9、TIMP-1和TIMP-2在宫颈癌侵袭转移中的确切机制仍需进一步研究。
[1] 衷筱琴,蔡红平,肖雯,等.CD44v6和MMP-9过表达与宫颈癌浸润转移的关系[J].中国妇幼保健,2009,24(34):4900-4903.
[2] 付晓瑞,张辰,陈长英,等.基质金属蛋白酶及其抑制因子在非黑色素性皮肤癌中的表达及临床意义[J].中华肿瘤杂志,2012,34(5):369-373.
[3] 郝力,丁美珍.宫颈癌患者基质金属蛋白酶2、9及其组织抑制剂检测的意义[J].浙江医学,2006,28(2):100-102.
[4] Shao W,Wang W,Xiong X G,et al.Prognostic impact of MMP-2 and MMP-9 expression in pathologic stage IA non-small cell lung cancer[J].J Surg Oncol,2011,104(12):841-846.
[5] 李敏,王文福,汪青.宫颈癌中MMP-2及TIMP-2的表达及其临床意义[J].解剖与临床,2004,9(4):241.
[6] 刘嵘,蒲德敏,程艳香,等.受体结合肿瘤抗原、血管内皮生长因子和基质金属蛋白酶-9在宫颈癌组织中额表达及其与肿瘤侵袭、转移的关系[J].中华医学杂志,2007,87(49):1326-1329.
[7] 南云泽,刘丽利,林贞花,等.MMP-9及TIMP-1在子宫颈鳞癌组织中的表达及临床意义[J].中国妇幼保健,2011,26(10):1523-1526.
[8] 李芳,张淑兰,邱荣兰.MMP-2、MMP-9及TIMP-2、TIMP-1在宫颈鳞癌中的表达及其意义[J].临床肿瘤学杂志,2006,11(6):450-456.
[9] 李婵玉,李力.MMP-9及其相关因子与宫颈癌[J].重庆医学,2012,41(33):3545-3547.
[10]王德华,田冬艳.MMP-2和TIMP-2在宫颈癌中的表达及意义[J].天津医科大学学报,2010,16(4):590-593.
[11]张晓莹,薛秀珍,米建强.MMP-9、TIMP-1及VEGF在宫颈癌中的表达及相关性研究[J].河南科技大学学报(医学版),2008,26(1):3-5.
