蓝舌病病毒8型VP2蛋白单克隆抗体的制备及其抗原表位鉴定
2014-05-21赵国辉孙恩成秦永丽徐青元刘二战钱爱东吴东来
席 娜,赵国辉,孙恩成,秦永丽,孙 亮,魏 天,徐青元,杨 涛,孙 晶,刘二战,钱爱东,吴东来*
(1.吉林农业大学动物科学技术学院,吉林 长春 130000;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江 哈尔滨 150001)
蓝舌病(Bluetongue,BT)是一种由呼肠孤病毒科环状病毒属的BT病毒(BTV)引起的,通过库蠓等昆虫传播的非接触性反刍动物传染病,主要感染反刍类动物,动物感染BTV的平均死亡率为30%,绵羊高达80%[1]。OIE将其列为须通报疾病,我国规定为一类动物疫病。BT流行广泛,目前尚无有效治疗方法[2],由于BT血清型众多,新的血清型不断出现,目前已发现26个血清型[3-4],各血清型之间交叉保护免疫性差,因此预防该病的关键是建立快速的血清型检测方法。2006年以来,BTV8在德国、法国、荷兰、比利时等欧洲国家暴发,造成了严重的经济损失。目前还未有BTV8在我国流行的相关报道,因此,必须加强我国BTV尤其是BTV8相关工作的研究。
BTV基因组由10个线性双股正链RNA节段组成,外壳由L2和M5基因编码的VP2和VP5组成,占病毒总量的40%,其中VP2是主要型特异性抗原,大多数能够诱导产生中和抗体的抗原表位都存在于VP2蛋白上,并且具有与受体结合以及凝集红细胞作用[5]。本实验利用真核表达的重组BTV8 VP2蛋白制备了特异性单克隆抗体(MAb),并对其抗原表位进行了鉴定,为BTV8型特异性检测方法的建立和VP2蛋白结构和功能的研究奠定了基础。
1 材料和方法
1.1 细胞、病毒株及实验动物 SP2/0细胞、BHK-21细胞、Sf21细胞、E.coliDH10bac感受态细胞、BTV1~24型病毒株、茨城病毒、中山病毒、赤羽病毒及抗西尼罗病毒NS1蛋白MAb 4D1均由哈尔滨兽医研究所保存;E.coliDH5α感受态细胞购自北京中衫金桥生物技术有限公司;6周龄~10周龄的SPF级BALB/c雌鼠由中国农业科学院哈尔滨兽医所实验动物中心提供。
1.2 主要试剂 pFastBacHTA供体质粒、抗BTV8型绵羊阳性血清均由本研究室保存;ExTaqDNA聚合酶、限制性内切酶BamHⅠ、HindⅢ、反转录酶、DNA Marker均购自宝生物工程(大连)有限公司;T4 DNA连接酶、辣根过氧化物酶(HRP)标记的抗His标签MAb购自NEB公司;Cellfectin Reagent转染试剂、MAb亚型鉴定试剂盒购自Invitrogen公司;二氨基联苯胺(DAB)显色试剂盒、羊抗鼠IgG-HRP购自北京中杉金桥生物技术有限公司;羊抗鼠 IgG-FITC、驴抗绵羊 IgG-HRP、邻苯二胺(OPD)均购自GIBCO公司;弗氏佐剂、PEG、HAT、HT和8-氮鸟嘌呤(8-AG)均购自SIGMA公司。
1.3 BTV8VP 2蛋白的真核表达 根据GenBank中登录的BTV8 L2基因序列(AJ585129),利用Primer 5.0软件选取其ORF在5'端和3'端分别设计上、下游引物,引物由Invitrogen公司合成。其序列为:VP2-F:5'-CGGGATCCATGGAGGAGCTAGCAATT C-3'(BamHⅠ),VP2-R:5'-GTCAAGCTTCTATACA TTGAGCAGRTTAG-3'(Hind Ⅲ)。
提取病毒基因组,PCR扩增获得L2全长基因,双酶切目的片段VP2和供体质粒pFastBacHTA,构建重组质粒pFast-VP2,并将其转化至DH10Bac,提取重组杆粒BAC-VP2,按照Bac-to-Bac说明书方法在脂质体Cellfectin Reagent作用下将重组杆粒BAC-VP2转染Sf21昆虫细胞,转染后的Sf21细胞经SDS-PAGE分析,并以HRP标记的抗His标签的MAb为一抗,进行western blot鉴定检测VP2蛋白的表达及其生物活性。
1.4 重组VP 2蛋白纯化 以SDS-PAGE分析重组蛋白的表达[6],利用常规包涵体纯化方法纯化重组VP2蛋白。
1.5 动物免疫 以纯化的重组VP2蛋白腹腔注射免疫6周龄BALB/c雌鼠6只,为100 μg/只,间隔两周免疫一次。首免以弗氏完全佐剂乳化,二免和三免以弗氏不完全佐剂乳化,三免后一周尾静脉采血,将血清倍比稀释,利用纯化的重组VP2蛋白包被的ELISA板检测血清抗体效价,选择血清效价最高的小鼠于融合前3 d以100 μg/只VP2蛋白(不加佐剂)进行加强免疫,取其脾细胞进行细胞融合。
1.6 间接ELISA检测方法的建立 按常规间接ELISA操作步骤,分别以纯化的重组VP2蛋白和野毒杆状病毒感染的Sf21细胞作为抗原包被,阴阳性血清为一抗,经方阵法确定抗原抗体最佳稀释倍数,判定标准为,阳性血清孔OD492nm值约为1.0,阴性血清孔OD492nm值<0.2,P/N>2.1的最大稀释度为其最适工作浓度[7]。
1.7 杂交瘤细胞株的建立及MAb的制备 将SP2/0细胞与效价最高小鼠的脾细胞以1∶4混合,加入融合剂PEG进行融合[6]。选择阳性细胞进行克隆纯化,直到筛选出稳定分泌特异性MAb的杂交瘤细胞株进行扩大培养,并将细胞冻存。
1.8 MAb的鉴定
1.8.1 间接免疫荧光(IFA)鉴定 将BTV1~24型病毒株、茨城病毒、中山病毒和赤羽病毒分别接种BHK-21细胞,培养24 h后用预冷的75%乙醇4℃固定30 min,以MAb为一抗,羊抗鼠IgG-FITC(1∶50)为二抗,同时设立未接病毒细胞空白对照及阴、阳性血清对照,荧光显微镜下观察结果。
1.8.2 MAb的western blot鉴定 将感染BTV8的细胞沉淀和BHK-21细胞沉淀处理后进行SDS-PAGE转印硝酸纤维素膜,分别以MAb 2G4和3B7作为一抗,羊抗鼠IgG-HRP作为二抗,DAB显色试剂盒显色,进行western blot分析。
1.8.3 MAb腹水的制备 选取10周龄BABL/c小鼠腹腔注射灭菌液体石蜡0.5 mL/只,7 d后腹腔注射杂交瘤细胞,密度为1×106个/mL~2×106个/mL,1 mL/只,待小鼠腹部膨大收集腹水。
1.8.4 MAb与腹水效价测定以及免疫球蛋白亚类鉴定 将MAb分别做 10×21~10×28倍稀释及腹水分别做101~108倍稀释作为一抗,同时设立阴阳性血清对照,利用已建立的间接ELISA方法测定其效价。采用MAb亚型鉴定试剂盒进行亚类鉴定。
1.8.5 杂交瘤细胞的稳定性检测 将冻存3个月的杂交瘤细胞复苏连续多次传代,检测其上清液的抗体效价,鉴定其分泌抗体的稳定性。
1.9 抗原表位的鉴定 将VP2蛋白截短为相互重叠6个氨基酸的96条短肽,分别以100 ng/孔包被ELISA反应板,以制备的2株MAbs为一抗,羊抗鼠IgG-HRP为二抗进行间接ELISA鉴定,同时HRP标记的MBP MAb作为阳性对照,以抗西尼罗病毒NS1蛋白MAb 4D1作为阴性对照,根据OD492nm值初步鉴定VP2的抗原表位,对鉴定出的线性表位利用NCBI Blast进行同源性比较。
2 结 果
2.1 VP 2蛋白在杆状病毒中的表达及纯化 重组供体质粒pFast-VP2经BamHⅠ和HindⅢ双酶切鉴定得到两个片段,与预期大小4856 bp和2886 bp相符(图略),测序结果正确。采用通用M13上下游引物和特异性亲本上下游引物对所提取的重组杆粒BAC-VP2进行PCR鉴定,分别扩增出大小约5300 bp和2900 bp的片段,与预期大小相符(图略)。利用杆状病毒表达系统表达出BTV8重组蛋白VP2,通过包涵体纯化方法对其进行了纯化。SDS-PAGE结果显示,VP2蛋白在Sf21细胞株得到表达,其分子量约为110 ku,大小与预期相符(图1A)。Western blot结果显示该蛋白可以与抗BTV8绵羊阳性血清产生反应,显示出良好的抗原性(图1B)。
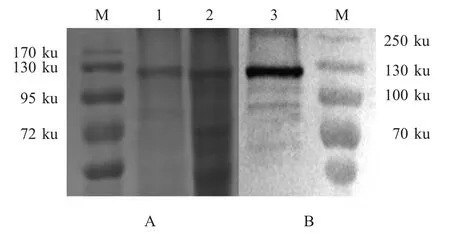
图1 重组VP2蛋白SDS-PAGE(A)分析及western blot(B)鉴定Fig.1 The analysis of recombinant protein VP2 by SDS-PAGE(A)and western blot(B)
2.2 间接ELISA方法的建立 经方阵法测定间接ELISA最佳反应条件为:VP2蛋白和野毒杆状病毒感染的Sf21细胞分别做1∶500稀释即每孔约为100 ng,5%脱脂乳4℃封闭过夜,阴阳性血清1∶2000稀释,羊抗鼠IgG-HRP二抗工作浓度1∶5000时,作用条件均为37℃孵育1 h,底物显色时间为10 min,可以用于阳性杂交瘤细胞的筛选。
2.3 阳性杂交瘤细胞株的获得及MAb的制备 免疫的BALB/c鼠脾细胞与SP2/0细胞融合后,经间接ELISA方法筛选阳性的杂交瘤细胞,经3次细胞克隆纯化后,得到2株稳定分泌抗BTV8 VP2蛋白MAb的阳性杂交瘤细胞,命名为2G4和3B7。
2.4 MAb的鉴定
2.4.1 IFA鉴定 分别利用2株MAbs对接种BTV1~24,茨城病毒,中山病毒和赤羽病毒的BHK-21细胞及未接种病毒的BHK-21细胞进行IFA试验,结果显示2G4和3B7均仅与BTV8发生阳性反应,与其他血清型BTV以及茨城病毒,中山病毒和赤羽病毒均呈阴性反应(图2),表明这2株MAbs具有较强的特异性。
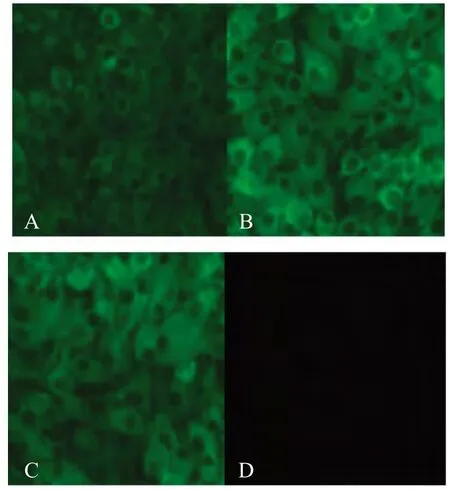
图2 MAbs与BTV8的IFA试验Fig.2 IFA assay of MAbs reaction with BTV8 infected cells
2.4.2 MAb的western blot鉴定 利用western blot鉴定这2株MAbs,结果显示其与真核表达的VP2蛋白、BTV8病毒呈阳性反应,在110 ku处出现特异性条带(图3),而与野生型杆状病毒表达蛋白、BHK-21细胞呈阴性反应,证明这2株MAbs与BTV8 VP2蛋白发生特异性反应。
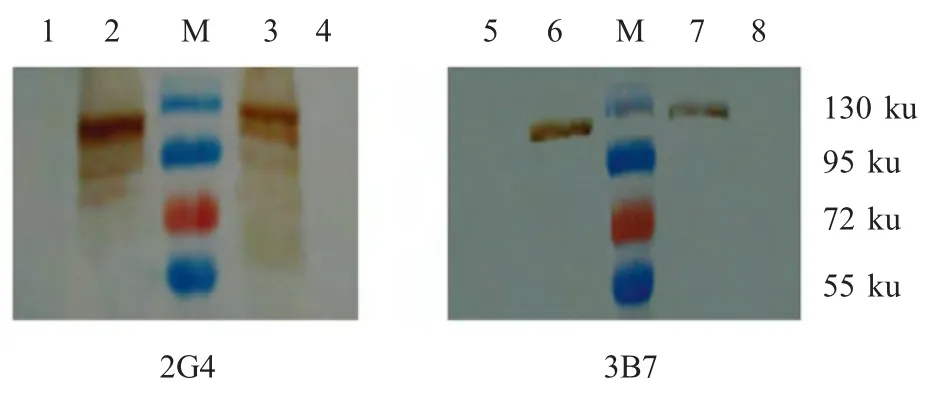
图3 MAb的western blot鉴定Fig.3 Identification of the MAbs by western blot
2.4.3 MAb与腹水效价测定以及免疫球蛋白亚类鉴定 经间接ELISA测定MAb 2G4和3B7杂交瘤细胞上清液的效价分别为1∶1280、1∶5120,腹水效价分别为 1∶105、1∶106。2G4 和 3B7 亚类均为 IgG1/κ 链。
2.4.4 杂交瘤细胞的稳定性检测 将冻存3个月的2G4和3B7杂交瘤细胞复苏后,多次连续传代收集培养上清液进行间接ELISA检测,结果显示2株MAbs的OD492nm值未发生明显变化,表明2G4和3B7均能够稳定分泌特异性MAb。
2.5 抗原表位的鉴定 将VP2蛋白截短表达,以2株MAbs为一抗,ELISA试验初步鉴定2G4的抗原表位位于短肽VP2-29上,抗原表位定位到281LCRLLSTIGRKMCNTE296(图 4),而 3B7与96条短肽均不发生反应,推测3B7可能为构象表位。利用BLAST对2G4抗原表位进行保守性分析,结果显示所鉴定的BTV8 VP2蛋白的抗原表位在不同地域来源的BTV8病毒株中完全保守。此外,比对结果还表明2G4的抗原表位与BTV3、BTV13、BTV18和BTV23相对应区域的氨基酸序列的同源性较大,而与其他血清型病毒株差异显著,同源性低。
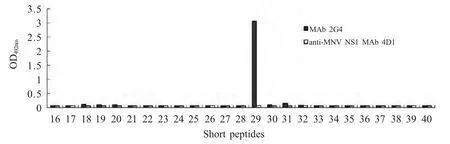
图4 合成短肽的间接ELISA分析Fig.4 Analysis of synthetic short peptides by indirect ELISA
3 讨 论
BTV呈蔓延趋势,不断有新地区发生疫情[8]。BTV具有多型性,当前已存在26个血清型,不同血清型之间无交叉免疫力,因此防控BTV的重要措施是建立型特异性鉴别诊断方法。本研究制备的这两株针对BTV8 VP2蛋白MAbs,只与BTV8发生特异性反应,而与BTV其他血清型、茨城病毒、中山病毒和赤羽病毒不发生反应,为BTV8型特异性MAbs。为进一步鉴定这两株MAbs所识别的B细胞抗原表位,通过原核表达的96条覆盖VP2全长的连续重叠的MBP融合短肽初步断定MAbs所识别的抗原表位,获得一个新型线性表位。通过氨基酸序列进行比对,结果表明2G4的线性抗原表位在不同地区来源的BTV8病毒株中是高度保守的,同时,比对结果还表明与 BTV3、BTV13、BTV18和BTV23相对应区域的氨基酸序列的同源性较大,而与其他血清型病毒株以及呼肠孤病毒科环状病毒属内的代表病毒之间差异显著,这与Maan等研究表明BTV8、BTV18和BTV23以及BTV3和BTV13均具有相同的核酸型是一致的[9]。所鉴定的这个线性B细胞表位为BTV8型特异性抗原表位,为标记疫苗和型特异性诊断方法的建立奠定了基础。
利用MAbs鉴定抗原表位已成为研究蛋白结构功能的重要工具[10],本研究中也通过DNAStar软件对BTV8 VP2蛋白结构做了初步分析,显示这个线性表位区域具有较高的抗原指数,但是亲水性和表面呈现指数偏低,为BTV8 VP2蛋白的立体结构特性和功能的研究提供参考数据,也有利于表位疫苗的研制。
[1]宋红梅,杨涛,马健男,等.蓝舌病病毒VP7基因的原核表达[J].中国预防兽医学报,2009,31(12):925-928.
[2]Schwartz-Cornil I,Mertens P P,Contreras V,et al.Bluetongue virus:virology,pathogenesis and immunity[J].Vet Res,2008,39(5):46.
[3]Maan S,Maan N S,Nomikou K,et al.Complete genome characterisation of a novel 26th bluetongue virus serotype from Kuwait[J].PLoS One,2011,6(10):e26147.
[4]Mann S,Mann N S,Nomikou K,et al.Novel bluetongue virus serotype from Kuwait[J].Emerg Infect Dis,2011,17(5):886-889.
[5]White J R,Eaton B T.Conformation of the VP2 protein of bluetongue virus(BTV)determines the involvement in virus neutralization of highly conserved epitopes within the BTV serogroup[J].J Gen Virol,1990,71:1325-1332.
[6]秦永丽.蓝舌病病毒8型VP2蛋白单克隆抗体制备及其抗原表位鉴定[D].哈尔滨:中国农业科学院哈尔滨兽医所,2012.
[7]马健男.西尼罗病毒NS1蛋白单克隆抗体的制备及B细胞表位鉴定[D].哈尔滨:中国农业科学院哈尔滨兽医所,2010.
[8]Wilson A J,Mellor P S.Bluetongue in Europe:past,present and future[J].Philos Trans R Soc Lond B Biol Sci,2009,364:2669-2681.
[9]Maan S,Maan N.,Samuel A,et al.Analysis and phylogenetic comparisons of full-length VP2 genes of the 24 bluetongue virus serotypes[J].J Gen Virol,2007,88:621.
[10]Sukupolvi-Petty S,Austin S K,Engle M,et al.Structure and function analysis of therapeutic monoclonal antibodies against dengue virus type 2[J].J Virol,2010,84:9227-9239.
