猪细小病毒高效纳米PCR检测方法的建立
2014-05-21崔宇超彭永刚马兴杰崔尚金
崔宇超,彭永刚,马兴杰,崔尚金*
(1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150001)
猪细小病毒(Porcine parvovirus,PPV)是引起母猪繁殖障碍的主要病原之一,临床症状以死胎和母猪流产为主要特征[1]。目前,PCR是检测PPV的一种主要技术。此外还有环介导等温扩增法(LAMP)[2]和荧光定量PCR方法[3-4]。这些方法均是为了提高现有PCR的敏感性,但荧光定量PCR需要昂贵的定量PCR仪,LAMP容易形成气溶胶污染,这些缺点限制了其在临床中的简便应用。因此,本研究针对PPV VP2基因,建立一种快速、敏感、特异的纳米PCR检测技术。
1 材料和方法
1.1 病毒核酸和病料样品 猪的主要病毒核酸包括PPV BQ-C株DNA,猪圆环病毒Ⅱ型(PCV2)SH株DNA,猪捷申病毒(PTV-8)cDNA,猪伪狂犬病毒(PRV)JL株DNA,猪繁殖与呼吸综合征病毒(PRRSV)HB株cDNA,猪瘟病毒(CSFV)cDNA均由本实验室保存;病料样品为黑龙江、河北和河南3个省份的43份临床疑似PPV感染组织样品,主要包括发病猪的心、肝、脾、肺、肾等组织。
1.2 主要试剂 PrimeSTARRHS DNA高保真酶、DL2000 Marker、DNA A-Tailing Kit、pMD18-T 载体、E.coliDH5α感受态细胞、2×GC bufferⅡ购自TaKaRa公司;质粒抽提试剂盒购自OMEGA公司;DNA提取试剂盒购自TIANGEN公司;胶回收试剂盒购自AXYGEN公司;纳米PCR试剂盒购自山东大正医疗器械股份有限公司。
1.3 引物设计 参照GeneBank中登录的PPV BQ株序列的VP2基因,应用Oligo6.0软件设计扩增PPV VP2基因全长序列的引物,通过与已公布的VP2基因全长序列进行比对后筛选保守区域设计扩增472 bp片段的引物。引物由哈尔滨博士生物公司合成(表 1)。

表1 引物序列Table 1 Primer sequences
1.4 VP 2重组质粒模板的制备 以PPV BQ-C株细胞培养物提取的DNA为模板,以P1/P2为引物,利用PrimerSTAR高保真酶扩增VP2基因全长序列,并将其克隆至pMD18-T载体中构建重组质粒pMD-VP2,测序正确后作为PCR的阳性模板。
1.5 纳米PCR的建立以及条件优化 根据文献[5]的方法,将纳米PCR反应体系预设定为:2×nano buffer 6 μL,P3/P4(10 μmol/L)0.6 μL,pMD-VP2(100 ng/μL)0.8 μL,Taq 酶(5 U/μL)0.2 μL,ddH2O补至12 μL;反应条件预设定为:94℃5 min;94℃30 s、50℃30 s、72℃40 s,30个循环;72℃7 min。普通PCR反应体系中,缓冲液为不含有纳米颗粒的2×GC bufferⅡ,同时添加dNTP,其他的反应试剂和反应条件与优化的纳米PCR相同。
利用温度梯度PCR仪设置温度为46℃~55℃,间隔1℃,进行退火温度优化,反应体系和其他反应条件均相同。引物(初始浓度为10 μmol/L)的使用体积从 0.2 μL 到 1.2 μL 进行优化,间隔 0.2 μL,优化的各组引物的终浓度为1/6 μmol/L~6/6 μmol/L,反应条件以优化后的退火温度为准。
1.6 敏感性试验 阳性模板测定浓度后根据浓度计算拷贝数,10倍倍比稀释后得到浓度梯度标准品。分别利用纳米PCR和普通PCR对倍比稀释的阳性模板进行扩增,以比较二者的敏感性。重复4次。
1.7 特异性试验 应用纳米PCR分别对PPV、PCV2和PRV的DNA以及PTV-8、PRRSV和CFSV的cDNA进行检测,以此验证纳米PCR方法的特异性。试验重复进行4次。
1.8 纳米PCR与普通PCR对临床样品的检测比较将43份临床组织样品分别剪碎、研磨,参照基因组DNA提取试剂盒说明书提取DNA,分别应用纳米PCR和普通PCR对提取的DNA进行检测。
2 结 果
2.1 阳性模板的制备 以PPV细胞培养物提取的DNA作为模板,扩增VP2基因全长序列,获得产物为1758 bp。将其经过胶回收纯化后连接到pMD18-T载体中构建重组质粒,并且测序正确,将其命名为pMD-VP2,作为PCR的阳性模板。
2.2 纳米PCR的建立以及条件优化经过 经各种条件的优化,最终确定纳米PCR体系:2×nano buffer 6 μL,P3/P4(10 μmol/L)0.6 μL(引物终浓度为 1/2 μmol/L),模板(100 ng/μL)0.8 μL,Taq 酶(5 U/μL)0.2 μL,ddH2O 补至 12 μL;反应条件:94 ℃5 min;94℃ 30 s、48℃ 30 s、72℃ 40 s,30个循环;72℃7 min。普通PCR反应体系中添加4.5 μL 2×GC bufferⅡ和 1.5 μL dNTP,其他试剂和反应条件同纳米PCR。
2.3 敏感性试验 构建的重组质粒测定其浓度为100 ng/μL,换算成拷贝数浓度为 4×1010拷贝 /μL。将重组质粒进行10倍倍比稀释,得到浓度梯度标准品(4 拷贝 /μL~4×1010拷贝 /μL)。纳米 PCR 的最低检出量为4拷贝/μL(图1A),而普通PCR的最低检出量为4×103拷贝/μL(图1B),表明纳米PCR比普通PCR敏感1000倍。

图1 纳米PCR(A)和普通PCR(B)的敏感性试验Fig.1 Sensitivity tests of the nano PCR(A)and conventional PCR(B)
2.4 特异性试验 应用纳米PCR对猪的6种主要病毒DNA或者cDNA进行检测,只有以PPV DNA为模板时扩增出472 bp特异性条带,而其他5种病毒核酸检测结果均呈阴性(图2),表明该纳米PCR具有良好的特异性。
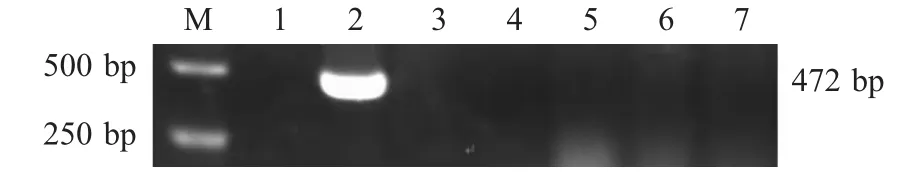
图2 纳米PCR的特异性试验Fig.2 Specificity test of the nano PCR
2.5 纳米PCR与普通PCR对临床样品的检测比较分别应用纳米PCR和普通PCR对3个省份送检的43份临床样品进行检测。结果显示,纳米PCR和普通PCR检测PPV阳性率分别为95%(41/43)和72%(31/43),表明该纳米PCR比普通PCR更加敏感,适用于低含量PPV临床样品的检测。
3 讨 论
目前,检测PPV的PCR主要包括普通PCR和荧光定量PCR。在临床应用中,普通PCR较为常用,但其敏感性不显著,荧光定量PCR较为精准,但需要精密的仪器并且操作程序复杂。纳米PCR是一种新型的PCR技术,它比普通PCR更加敏感,比荧光定量PCR更加方便快捷。纳米PCR缓冲液中含有粒径为1 nm~100 nm的纳米金属颗粒,当反应时纳米金属颗粒悬浮在液体里形成纳米流体,这种纳米流体相对于普通流体具有更强的导热性,高导热性能够加快温度升高和下降的速度,使反应体系快速达到目标温度,减少在非目标温度的停留时间,增加特异性反应时间,因而最终达到消除非特异性扩增,提高扩增效率和敏感性的目的[6-7]。本研究首次应用纳米PCR技术针对PPV VP2基因进行检测,建立一种快速、敏感、特异的PPV检测方法。本研究建立的纳米PCR比普通PCR敏感1000倍。并且具有良好的特异性。
临床中,在PPV感染初期或者后期病毒载量较低时,应用纳米PCR检测PPV更加高效,适合于基层实验室的使用。本研究中分别应用纳米PCR和普通PCR检测临床样品,结果表明纳米PCR比普通PCR更加敏感。该PPV纳米PCR具有较高的敏感性和特异性,是一种高效的检测手段,可以应用于流行病学调查,同时也为PPV的及时检测、预防和治疗奠定基础。
[1]Martínez C,Dalsgaard K,López de Turiso J A,et al.Production of porcine parvovirus empty capsid with high immunogenic activity[J].Vaccine,1992,10(10):684-690.
[2]Chen Hao-tai,Zhang Jie.Rapid detection of porcine parvovirus DNA by sensitive loop-mediated isothermal amplification[J].J Virol Methods,2009,158(1-2):100-103.
[3]Chen Hong-ying,Li Xiao-kang,Cui Bao-an,et al.ATaqManbased real-time polymerase chain reaction for the detection of porcine parvovirus[J].J Virol Methods,2009,156(1-2):84-88.
[4]Zheng Lan-lan,Wang Ya-bin,Li Ming-feng,et al.Simultaneous detection of porcine parvovirus and porcine circovirus type 2 by duplex real-time PCR and amplicon melting curve analysis using SYBR Green[J].J Virol Methods,2013,187(1):15-19.
[5]Ma Xing-jie,Cui Yu-chao.A nanoparticle-assisted PCR assay to improve the sensitivity for rapid detection and differentiation of wild-type pseudorabies virus and gene-deleted vaccine strains[J].J Virol Methods,2013,193(2):374-378.
[6]Li Hai-kuo.Colorimetric detection of DNA sequences based on electrostatic interactions with unmodified gold nanoparticles[J].Proc Natl Acad Sci,2004,101(39):14036-14039.
[7]Keblinski P,Phillpot S R,Choi S U S,et al.Mechanism of heat flow in suspension of nano-sized particles(nanofluids)[J].Int J Heat Mass Transf,2002,45(4):855-863.
