非洲猪瘟病毒p54抗体胶体金试纸检测方法的建立
2014-05-21张鑫宇左伟勇朱善元夏晓莉孙怀昌
张鑫宇,左伟勇,朱善元,夏晓莉,孙怀昌*
(1.扬州大学兽医学院,江苏 扬州 225009;2.江苏畜牧兽医职业技术学院,江苏 泰州 225300)
非洲猪瘟(African swine fever,ASF)是由ASF病毒(ASFV)引起的一种家猪和野猪的烈性传染病,具有死亡率高和传播迅速的特点,给疫区国家造成严重的经济损失[1]。该病最早发现于肯尼亚[2],随后逐渐在非洲、欧洲和美洲等数十个国家传播,并有继续蔓延的趋势[3]。近几年来,我国周边国家格鲁吉亚、亚美尼亚、阿塞拜疆、俄罗斯等国先后发生多起ASF疫情[4],但我国暂未发现ASF,因而建立有效的检测方法对防止该病进入国内具有重要意义。
OIE推荐的ASF实验室检测方法有病毒分离、PCR、ELISA和荧光抗体试验等[5],这些诊断方法一般限制在ASFV参考实验室内进行。Beggs等首次用胶体金快速免疫层析法(GICA)测定人绒毛膜促性腺激素[6],后来逐步应用到微生物病原、抗体的快速检测[7-8],该方法具有快速、灵敏、特异等优点,尤其适合临床的快速诊断。ASFV E183L基因编码的p54蛋白存在于病毒粒子内层囊膜,参与病毒的吸附与进入[9-10],该蛋白可以刺激机体产生具有一定中和能力的抗体[11],可以作为ASFV抗体诊断抗原[12]。本研究将表达的重组p54蛋白标记上胶体金颗粒,制备了一种ASFV抗体快速检测胶体金试纸,在5 min~10 min内可以判定结果,适合临床ASF血清学快速诊断、流行病学调查以及生猪国际贸易检疫检验。
1 材料和方法
1.1 主要实验材料及实验动物 pET-30a(+)表达载体购自Novagen公司;大肠杆菌BL21(DE3)购自海基生物科技有限公司;pGEX-4T-1-E183L由葡萄牙Gulbenkian de Ciência研究所RM Parkhouse博士惠赠;猪瘟病毒(CSFV)、猪伪狂犬病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)及猪圆环病毒2型(PCV-2)抗体阳性血清均由中国兽医药品监察所丁家波博士惠赠;ASFV抗体阳性和阴性猪血清、ASFV诊断抗原(ASF AG CYTO-SOL 92/1)由英国Pirbright研究所OIE ASF参考实验室提供;所有工具酶购自TaKaRa公司;辣根过氧化物酶标记的羊抗猪IgG(IgG-HRP)、氯金酸(HAuCl4)、牛血清白蛋白(BSA)、葡萄球菌A蛋白(SPA)、弗氏完全佐剂及弗氏不完全佐剂购自Sigma公司;His亲和层析凝胶购自Qiagen公司;CN1403硝酸纤维素膜购自Sartorius公司;硬质塑料底板、黏附吸水滤纸、玻璃纤维素膜以及塑料壳购自上海杰一生物技术有限公司;XYZ3060胶体金点样系统为Biodot公司产品;2月龄姜曲海猪由江苏省畜牧兽医技术学院种猪场提供。
1.2 p 54基因片段亚克隆 利用DNAStar软件包中Protean软件对Ba71V株ASFV p54氨基酸序列进行分析,表明其前50个氨基酸为疏水性氨基酸集中区,不仅无潜在的B细胞表位,而且可能影响其在原核细胞中可溶性表达。从编码第51个氨基酸DNA序列(GenBank FJ174390)开始,设计一对特异性引物:正向引物:5-TAGAATTCCTATTCTCTTCA AGAAAG-3;反向引物:5-TACTCGAGTTACAAGG AGTTTTCTAGG-3。
以质粒pGEX-4T-1-E183L为模板,扩增的p54基因片段(402 bp),扩增产物经EcoRⅠ、XhoⅠ酶切后,连入载体pET-30a(+),获得重组质粒pETE183L,并转化大肠杆菌BL21(DE3)感受态细胞。
1.3 重组p 54蛋白表达、纯化及鉴定 按照文献[13]中的方法进行重组蛋白p54的诱导表达,超声波破碎裂解细菌,SDS-PAGE对表达的重组蛋白进行初步鉴定。
按照Qiagen公司说明书,用His亲和层析凝胶纯化表达的重组蛋白,ND-1000紫外分光光度计定量蛋白,并用0.01 M pH7.4 PBS调整最终浓度为1 mg/mL。SDS-PAGE分析重组蛋白的纯度。
以ASFV抗体阳性猪血清为一抗(1∶200),以羊抗猪 IgG-HRP 为二抗(1∶10000),western blot鉴定纯化的重组蛋白。
1.4 抗p 54重组蛋白多抗制备 将1 mg纯化的重组p54蛋白与等体积弗氏完全佐剂混合,乳化,肌肉注射2月龄姜曲海猪;免疫后第11 d,肌肉注射同样剂量弗氏不完全佐剂乳化的重组蛋白;10 d后加强免疫1次。加强免疫后第7 d,无菌采集猪血,分离血清,以5 μg/mL重组蛋白p54包被酶标板,与连续10倍稀释的猪血清进行间接ELISA,测定p54蛋白抗体的ELISA效价,同时设立阴性猪血清对照。饱和硫酸铵法沉淀免疫血清中的IgG,PBS 4℃透析过夜,紫外分光光度计测定蛋白浓度,-20℃保存。
1.5 重组p 54蛋白胶体金标记
1.5.1 胶体金溶液制备 用超纯水配制0.01%HAuCl4溶液和1%枸橼酸三钠溶液,0.45 μm滤膜过滤配制的溶液,去除其中的聚合物以及其他可能混入的杂质,参照文献[14]制备直径为20 nm的胶体金。
1.5.2 重组p54蛋白预处理 PBS 4℃透析处理制备的p54重组蛋白,再用0.005%pH7.0的NaCl溶液4℃透析,除去蛋白中的高浓度盐离子。10000×g 4℃离心1 h,去除蛋白聚合物。
1.5.3 重组p54蛋白胶体金标记及纯化 参照文献[15],确定重组蛋白p54标记胶体金时的最佳pH以及最佳蛋白标记剂量。根据上述实验结果,10 mL胶体金溶液中加入适量重组p54蛋白溶液,继续搅拌30 min;缓慢加入适量的10%BSA,使其终浓度为1%,搅拌30 min;1200×g 4℃离心15 min,取上清液;12000×g 4℃离心30 min,弃上清液,沉淀用1 mL 0.01 mol/L pH9.2硼酸盐缓冲液(含5%蔗糖、1%BSA、0.5%Tween-20、0.2%PEG20000以及0.02%叠氮钠)悬浮。
1.6 试纸制备及判定
1.6.1 试纸组装 采用XYZ3060胶体金点样系统以2 μL/cm的喷量在玻璃纤维膜金标垫上均匀喷涂浓度为0.3 mg/mL金标抗原,37℃烘箱干燥1 h;以1 μL/cm喷量在硝酸纤维素膜喷涂 1 mg/mL SPA、0.5 mg/mL抗p54 IgG,分别作为检测线(T线)和质控线(C线),两者线间距为5 mm,干燥后切割成4 mm宽的硝酸纤维素膜条,进行组装[16],密封保存备用。
1.6.2 检测判定标准 吸取40 μL稀释的血清,滴加于胶体金试纸的加样孔中,室温静置5 min~10 min,判定结果。质控线和检测线均出现红色条带为阳性;质控线出现红色条带,检测线处无红色条带为阴性;质控线无红色条带则该试纸失效。
1.7 特异性试验 用制备的胶体金试纸检测已知的CSFV、PRV、PRRSV、PPV、PCV-2以及ASFV抗体阳性猪血清,并根据上述标准判定结果。
1.8 敏感性试验 用PBS将制备的抗P54多抗分别稀释至终浓度1000 ng/mL、800 ng/mL、600 ng/mL、400 ng/mL、200 ng/mL、100 ng/mL,取 40 μL 上述稀释液滴加于试纸的加样孔中,室温静置5 min~10 min,肉眼观察并判定结果。
1.9 重复性试验 取同一批次及3个不同批次制备的胶体金试纸对10份ASFV抗体阳性和10份ASFV抗体阴性的猪血清进行检测,并比较检测结果。
1.10 试纸比对试验 将ASFV诊断抗原以23 μg/mL浓度包被酶标板,OIE间接ELISA[6]检测141份待检猪血清,其中26份为健康猪血清,24份为ASFV弱毒OURT88/3接种后第13 d的猪血清,34份为ASFV强毒(ASFV OURT88/1、Benin以及Georgia)攻毒后存活下来猪的血清,57份为刚果民主共和国疫区猪血清;同时采用western blot以及胶体金试纸对上述血清进行验证,比较3种方法的检测结果。
2 结 果
2.1 p 54基因亚克隆 PCR扩增编码ASFVp54(aa 51~aa 183)基因,将其连入载体pET-30a(+),采用EcoRⅠ和XhoⅠ进行酶切鉴定。结果表明重组质粒pET-E183L构建正确(图1)。
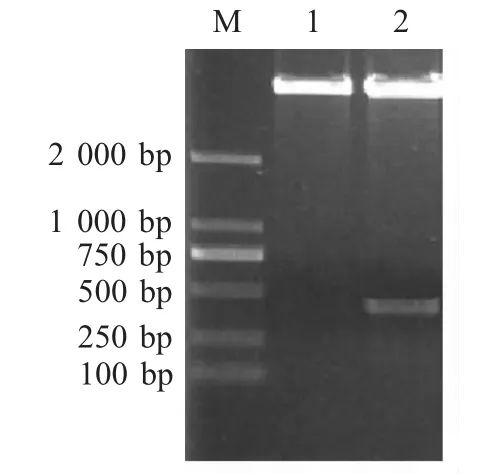
图1 重组质粒pET-E183L鉴定结果Fig.1 Identification of recombinant plasmid of pET-E183L
2.2 重组p 54蛋白表达、纯化及鉴定 pET-E183L/BL21重组菌经IPTG诱导表达,SDS-PAGE电泳结果显示,表达了约为21 ku的重组蛋白;亲和层析法纯化表达的重组蛋白,经分析,纯化后的重组蛋白纯度达94%;western blot试验表明,该蛋白能够与ASFV抗体阳性血清发生特异性反应(图2)。
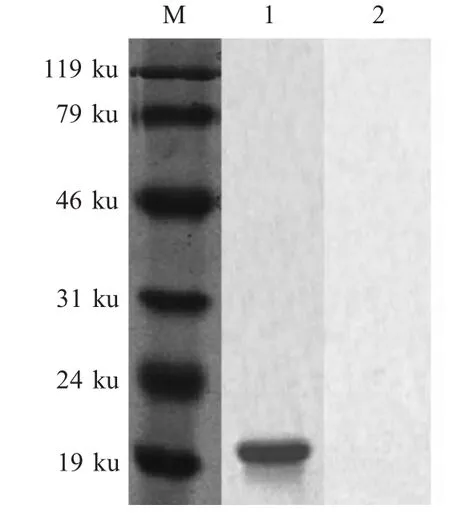
图2 纯化的重组p54蛋白western blot鉴定Fig.2 Identification of purified p54 by western blot
2.3 重组p 54蛋白多抗制备 将制备的重组p54蛋白免疫健康猪3次,分离猪血清,间接ELISA测定p54抗体,结果显示制备的多抗与重组蛋白反应良好,效价达到 1∶106。
2.4 重组p 54蛋白胶体金标记 对胶体金标记条件进行优化,结果表明最佳标记pH为8.0,最佳蛋白标记浓度为5 μg/mL。
2.5 特异性试验 用制备的胶体金试纸对CSFV、PRV、PRRSV、PPV、PCV-2以及ASFV抗体阳性猪血清进行检测,结果显示,仅ASFV抗体阳性猪血清呈阳性反应,而其他血清均呈阴性反应(图3),表明该方法具有高度的特异性。

图3 胶体金试纸特异性试验Fig.3 Specificity of the colloidal gold strips
2.6 敏感性比较试验 将制备的抗P54多抗梯度稀释后,分别用胶体金试纸进行检测,结果显示当稀释至200 ng/mL时,结果仍呈阳性,而100 ng/mL时呈阴性(图4)。
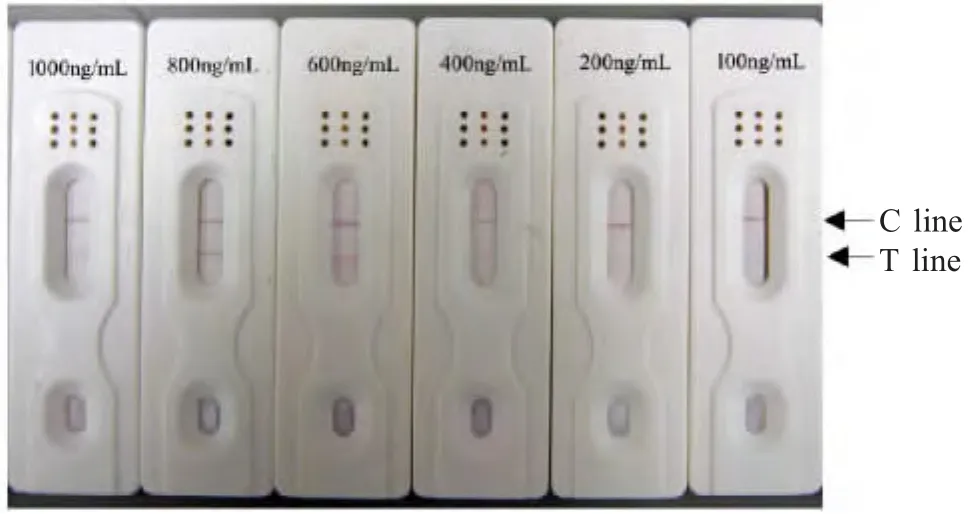
图4 胶体金试纸敏感性试验Fig.4 Sensitivity of the colloidal gold strips
2.7 重复性试验 用同一批次和不同批次胶体金试纸对10份ASFV抗体阳性和10份ASFV抗体阴性猪血清进行检测,结果显示,批内及批间检测符合率为100%。
2.8 试纸条比对试验 采用OIE ELISA、western blot以及胶体金试纸条对26份健康猪血清、24份ASFV弱毒免疫后第13 d采集的猪血清、34份ASFV强毒攻毒后存活猪血清以及57份刚果民主共和国疫区猪血清进行检测,检测结果如表1。以western blot为参照标准,OIE ELISA和胶体金试纸条检测刚果民主共和国的猪血清与其阳性符合率分别为87.5%(42/48)和 91.7%(44/48)。
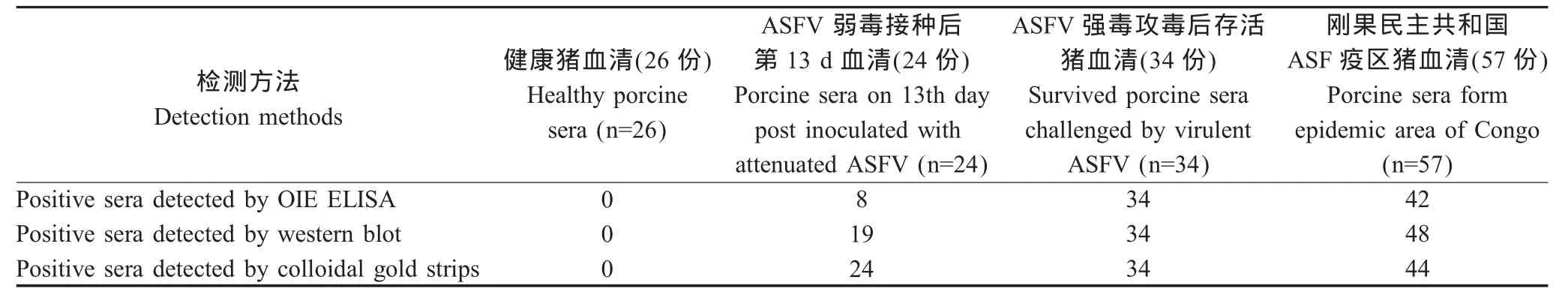
表1 不同ASFV抗体检测方法比对Table 1 Comparison of different methods in detecting antibodies to ASFV
3 讨 论
由于ASF可以感染各种年龄段的家猪和野猪,并且目前没有预防该病的疫苗,因此快捷、准确的检测方法是防止该病扩散蔓延的重要手段之一。OIE规定的检测方法主要包括两方面:一是病原检测,这需要特定的仪器设备和专业的技术人员;二是血清学检测,在ASF流行疫区和低毒力ASFV初期感染的地区,血清学方法是首推的诊断方法,其中最常用的是间接ELISA,所用包被抗原为病毒感染细胞的裂解物[5],在制备抗原时,有散毒的风险,诊断阳性的血清还需用其他的免疫学方法进一步验证。
胶体金免疫层析技术是近年来发展迅速的一项诊断技术,具有操作简便、检测灵敏度和特异性高、携带方便、肉眼直接观察等优点,与ELISA方法相比,更适合临床和基层单位的使用。前期研究表明,ASFV感染后,结构蛋白p54激发猪体产生的抗体时间较早,抗体滴度高(数据尚未公开),而SPA又可以与猪IgG及部分IgM结合。在此基础上制备了以重组p54蛋白(aa 51~183 aa)为抗原,SPA捕捉胶体金标记的p54抗原抗体复合物为检测系统的胶体金免疫层析试纸。通过对常见猪源CSFV、PRV、PRRSV、PPV、PCV-2抗体阳性的猪血清检测,表明制备的胶体金试纸具有特异性良好,批内、批间重复性高的特点。
用该胶体金试纸检测ASFV弱毒免疫后第13 d的猪血清,抗体检测阳性率为100%,而OIE ELISA检出阳性率为33.3%。Gallardo等认为这是由于待检血清保存不善造成的[17],本实验中所用的血清保存了约两年,抗体滴度可能有所下降,从而导致ELISA检测敏感性降低;另外,最主要的是OIE ELISA包被的抗原为ASFV病毒感染细胞后提取的可溶性成分,在实际检测中背景值较高,对于一些抗体滴度较低的血清样品,高的背景值会影响阴性临界值的确定,造成检测结果的假阴性,OIE也认为用表达纯化的蛋白作为ELISA包被抗原,检测效果会更好[5,17]。在检测ASFV抗体阴性和强阳性猪血清时,试纸条与OIE ELISA、western blot结果完全一致;对来自刚果民主共和国疫区幸存猪ASFV抗体检测时,胶体金试纸检测阳性率高于OIE ELISA和 western blot, 以 western bolt检测结果为参照,胶体金试纸检测符合率更高。上述结果表明,所制备的胶体金检测试纸条比OIE ELISA具有更高的检测准确性,尤其在ASFV感染早期的检测。
[1]Straw B E,Zimmerman J J,Allaire S D,et al.Disease of Swine.9th ed[M].Wiley-Blackwell Publishing,2006.
[2]Montgomery R E.On a for m of swine fever occurring in British East Africa(Kenya Colony)[J].J Comp Pathol,1921,34:59-191.
[3]Nix R J,Gallardo C,Hutchings G,et al.Molecular epidemiology of African swine fever virus studied by analysis of four variable genome regions[J].Arch Virol,2006,151:2475-2494.
[4]Sánchez-Vizcaíno J M,Mur L,Martínez-López B.African swine fever:an epidemiologic update[J].Transbound Emerg Dis,2012,59:1-9.
[5]OIE.African swine fever.In:Manual of Diagnostic Tests and Vaccines for Terrestrial Animals[M].Office International des Epizooties,Paris,France(Chapter 2.8.1,NB:version adopted in May 2012).
[6]Beggs M,Novotny M,Samocdro S.A self performing chromatographic immunoassay for the qualitative determination of human chorionic gonadotrophin in urine and serum[J].Clin Chem,1990,36:1084-1085.
[7]夏兴霞,孟祥升,王永山,等.大肠杆菌O157∶H7胶体金免疫层析检测试纸条在感染牛和小鼠排菌检测中的应用[J].中国兽医科学,2012,42(3):285-289.
[8]王铁成,张涛,杨松涛,等.狂犬病病毒抗体胶体金检测试纸的制备[J].生物工程学报,2011,27(5):799-804.
[9]Rodriguez J M,Garcia-Escudero R,Salas M L,et al.African swine fever virus structural protein p54 is essential for the recruitment of envelope precursors to assembly sites[J].J Virol,2004,78(8):4299-4313.
[10]Gomez-Puertas P,Rodriguez F,Oviedo J M,et al.The African swine fever virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response[J].Virology,1998,243:461-471.
[11]Ruiz G F,Carnero M E,Caballero C,et al.Inhibition of African swine fever infection in the presence of immune serain vivoandin vitro[J].Am J Vet Res,1986,47(6):1249-1252.
[12]Gallardo C,Reis A L,Kalema-Zikusoka G,et al.Recombinant antigen targets for serodiagnosis of African swine fever[J].Clin Vaccine Immunol,2009,16(7):1012-1020.
[13]李新苹,刘欢欢,普燕,等.重组凝乳酶原基因的原核表达及其抗血清的制备[J].细胞与分子免疫学杂志,2012,28(7):715-721.
[14]高利利,程金平,刘元嫄,等.软骨藻酸胶体金免疫层析检测试纸条的研制[J].环境科学,2011,32(8):2492-2496.
[15]宋阳威,张鑫宇,张常印,等.牛白血病病毒GP51蛋白在大肠杆菌中表达及胶体金免疫层析试纸条检测方法的建立[J].中国预防兽医学报,2010,32(4):272-275.
[16]Jiang Tao,Liang Zhong,Ren Wei-wei,et al.A simple and rapid colloidal gold-based immunochromatogarphic strip test for detection of FMDV serotype A[J].Virol Sin,2011,26(1):30-39.
[17]Gallardo C,Blanco E,Rodriguez J M,et al.Antigenic properties and diagnostic potential of African swine fever virus protein pp62 expressed in insect cells[J].J Clin Microbiol,2006,44(3):950-956.
