两种阿卡斑病毒抗体ELISA检测方法的建立与初步应用
2014-05-21刘晓婧
刘晓婧,王 芳,赵 权,于 力*
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/牛羊传染病研究创新团队,黑龙江 哈尔滨 150001)
阿卡斑病(Akabane disease,AKA),又称赤羽病,是由布尼病毒科布尼病毒属辛波病毒群的阿卡斑病毒(Akabane virus,AKAV)引起的,以牛羊流产、早产、死胎及犊牛先天性关节弯曲和积水性无脑症为特征[1]。AKA首次于1949年在日本暴发,目前AKA广泛分布于澳大利亚、东南亚、亚洲东部、中东和非洲的热带和温带地区[2]。1994年,李昌琳等首次证明在我国大部分省份均存在AKA的流行[3]。1996年~1997年上海暴发该病,牛胎儿死亡率约占20%~30%,给养牛业造成严重的经济损失[4-5]。次年,李其平等从上海地区采集的蚊、蠓等标本中分离到3株AKAV[6]。该病在我国被列为二类动物传染病。
AKAV为单链负股RNA病毒,其基因组由L、M和S 3个基因节段组成,分别编码RNA-依赖的RNA聚合酶L、囊膜糖蛋白G1、G2、NSm和核衣壳蛋白N、NSs蛋白[7]。N蛋白具有高度保守性,并可以诱导机体产生良好的抗体反应,适合用作该病毒的检测抗原[8-9]。
目前,我国没有商品化的检测试剂盒,中和试验是经典的检测方法,但耗时较长。本研究以纯化的重组N蛋白和纯化的全病毒作为包被抗原分别建立AKAV抗体的间接ELISA检测方法,以中和试验进行比对。建立的AKAV抗体间接ELISA检测方法为我国AKAV感染的大规模流行病学调查和防控技术研究奠定基础。
1 材料和方法
1.1 主要实验材料 AKAV由云南畜牧兽医研究院惠赠;247份现地牛血清于2013年分别采自湖北省(99份)、江苏省(52份)和广东省(96份)的不同牛群;BHK21细胞、AKAV鼠阳性血清、AKAV牛阳性血清、口蹄疫病毒(FMDV)阳性血清、牛流行热病毒(BEFV)阳性血清和牛支原体M.leachii阳性血清、pET-28a(+)载体和E.coliBL21感受态细胞均由本实验室保存。
1.2 主要试剂 PrimeSTARRHS DNA聚合酶、限制性内切酶、DNA Marker均购自TaKaRa公司;T4 DNA连接酶购自NEB公司;质粒抽提试剂盒和胶回收试剂盒购自Axygen公司;辣根过氧化物酶标记的兔抗牛IgG(IgG-HRP)和羊抗鼠IgG-HRP均购自Sigma公司;Ni-NTA Agarose和Chromatography Column纯化柱均购自Qiagen公司;Prestained Protein Ladder购自MBI公司。
1.3 AKAVN蛋白重组质粒的构建 根据AKAV N基因序列设计表达引物,上游引物NU:5'-CGCGG ATCCATGGCAAATCAATTC-3'(BamHⅠ),下游引物NL:5'-CCGCTCGAGTTAGATCTGGATACC-3'(XhoⅠ)。全长N基因PCR产物与表达载体pET-28a(+)分别用BamHⅠ和XhoⅠ双酶切,连接后转化,获得的阳性重组质粒由上海英骏生物技术有限公司进行测序。
1.4 重组N蛋白诱导表达及纯化 将阳性重组菌进行IPTG诱导表达,经SDS-PAGE电泳和western blot鉴定后进行大量诱导。参照Qiagen蛋白纯化手册进行N蛋白纯化。BCA法测定蛋白浓度。
1.5 AKAV全病毒纯化及鉴定 参照文献[10]并适当改进。收获60 h BHK21细胞培养物,4000 r/min离心30 min,将上清液中加入终浓度为8%PEG6000,4℃过夜,8000 r/min离心30 min取沉淀,20%~60%蔗糖不连续梯度32000 r/min离心3 h,取乳白色条带,进行SDS-PAGE和western blot鉴定。BCA法测定纯化病毒的含量,作为包被抗原。
1.6 中和试验筛选阴阳性血清 对采自湖北省、江苏省和广东省的247份牛血清进行中和试验检测,具体方法参照AKA行业标准[11]及文献[12]进行。
1.7 间接ELISA检测方法的反应条件优化 对ELISA工作条件进行优化,包括抗原包被浓度、封闭液和作用时间、样品血清及酶标抗体稀释倍数和作用时间、显色液和显色时间等。同时进行重复性和特异性试验。
1.8 临界值的确定 为确定两种ELISA检测方法的判断标准,采用受试者工作特征(ROC)曲线分析。选择中和试验检测为阴性和阳性的247份血清进行ELISA检测。应用ROC曲线确定阴性、阳性血清区分的最佳阈值。根据统计结果中各个切点的敏感性及特异性,计算Youden指数(Youden指数=敏感性+特异性-1),并选择Youden指数最大的切点为临界值。可疑区间范围选择曲线上敏感性上升速度减缓而特异性下降明显的折点和曲线基本呈水平到达点(1,1)坐标的折点,两折点之间包含了较多的阴阳性重叠区域[13]。
1.9 特异性试验 采用建立的两种ELISA方法对AKAV牛阳性血清、FMDV阳性血清、BEFV阳性血清和牛支原体M.leachii阳性血清进行ELISA检测,确定两种ELISA检测方法的特异性。
1.10 临床血清样品检测 分别用重组N蛋白和AKAV全病毒作为抗原,以间接ELISA方法对现地血清进行检查,并与中和试验结果进行比较。
2 结 果
2.1 重组N蛋白的表达与纯化 将全长N基因克隆于表达载体pET-28a(+),转化E.coliBL21(DE3)感受态细胞中,用IPTG诱导目的蛋白的表达,经SDS-PAGE和western blot检测表明,重组N蛋白获得表达,大小与预期(26.1 ku)一致,其与标准阳性血清呈特异性免疫反应(图1)。经镍柱纯化后测定蛋白浓度为0.24 mg/mL。
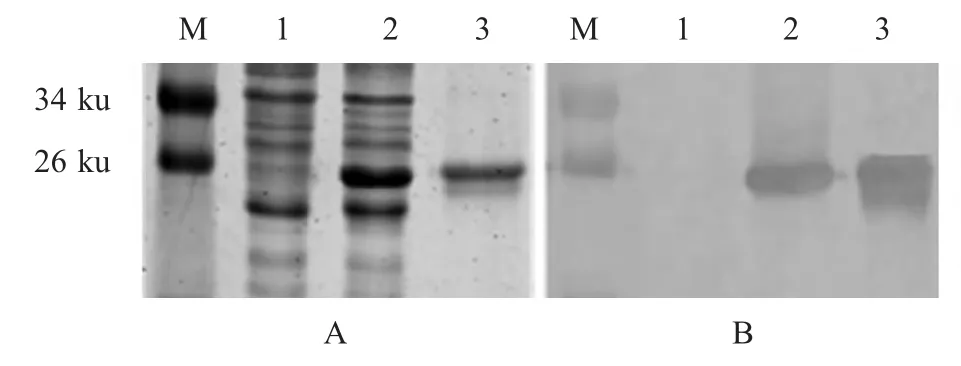
图1 重组N蛋白的SDS-PAGE(A)和western blot(B)鉴定Fig.1 The SDS-PAGE(A)and western blot(B)analysis of the expressed N recombinant protein
2.2 AKAV的纯化与鉴定 AKAV全病毒经差速离心和蔗糖密度梯度离心后,进行SDS-PAGE和western blot鉴定,结果显示纯化的病毒与AKAV阳性血清发生特异性反应,其中N蛋白条带的反应明显。测定的蛋白浓度为0.64 mg/mL。
2.3 中和试验 对采自湖北省、江苏省和广东省的247份牛血清进行中和试验检测,共筛选出73份阳性血清,174份阴性血清,表明这3个省区牛群中均有AKA感染(表1)。

表1 中和试验检测现地牛血清的结果Table 1 The neutralization tests of bovine diagnose samples
2.4 间接ELISA检测方法的最佳反应条件 经过对反应条件的优化,确定的最佳工作条件为:AKAV重组N蛋白和AKAV全病毒的最佳包被浓度分别为 3 μg/mL和 6 μg/mL,4℃包被过夜,1%BSA 37℃封闭1 h。待检血清用PBST做1∶100稀释,37℃作用1 h;羊抗鼠(或兔抗牛)IgG-HRP(1∶5000)为二抗37℃作用1 h;加入TMB底物室温避光显色10 min测定OD450nm值。批内和批间重复性试验显示,两种ELISA检测方法的OD450nm值变异系数均小于10%。
2.5 临界值确定 应用ROC曲线对247份血清进行ELISA检测的结果进行分析,选择图中最靠近左上方的点(图2)。最终确定N-ELISA检测方法最佳临界值为0.36,可疑范围选择在0.35~0.42之间,其敏感性为0.804~1。即血清样品OD450nm值≥0.42为抗体阳性,OD450nm值<0.35为抗体阴性;AKAVELISA检测方法最佳临界值为0.46,可疑范围选择在0.46~0.73之间,其敏感性为0.591~1。即血清样品OD450nm值≥0.73为抗体阳性,OD450nm值<0.46为抗体阴性。

图2 间接ELISA检测牛血清ROC分析Fig.2 ROC analysis of the bovine sera detected by indirect ELISA
2.6 特异性试验 采用建立的N-ELISA和AKAVELISA方法对FMDV、BEFV和牛支原体M.leachii的阳性血清进行检测。结果表明,重组N蛋白和AKAV与上述3种病原的阳性血清均无交叉反应,这两种ELISA方法均具有良好的特异性(表2)。
2.7 临床血清样品检测 对采自湖北省、江苏省、广东省的247份牛血清进行ELISA检测,结果显示,N-ELISA和AKAV-ELISA检测的抗体阳性率分别为23%和27.9%,与中和试验的符合率,分别为72.5%和 76.5%(表 3)。
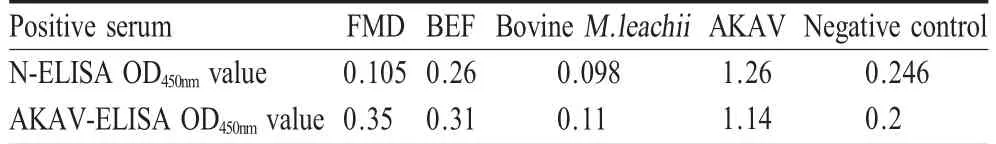
表2 特异性试验结果Table 2 The specificity tests of the indirect ELISA

表3 N-ELISA和AKAV-ELISA的符合率Table 3 The comparison of detection between N-ELISA and AKAV-ELISA
3 讨 论
目前我国对AKA的研究还处于起步阶段,缺少有效的商品化检测试剂盒,也无用于预防该病的疫苗。徐树兰等建立了AKA重组N蛋白抗原间接ELISA检测方法,但未见后续报道[14]。目前市场上主要是用法国ID-VET公司研制的竞争ELISA试剂盒,该试剂盒价格昂贵,不适合用于大规模的流行病学调查和检测。
AKAV N蛋白中存在保守的抗原表位,可以刺激机体产生抗体,因此通过检测N蛋白抗体可以诊断该病的流行[15]。由于我国尚未发现辛波病毒群的其他病毒,因此N蛋白可以用于AKAV的血清学诊断。本研究表达的重组N蛋白为可溶性蛋白,并且包含载体的6×His标签,因此可以采用Ni-NTA Agarose亲和层析方法对融合蛋白进行纯化。所获得的蛋白经western blot检测具有良好的免疫学活性。此外,以重组N蛋白作为诊断抗原建立的ELISA试剂盒,其生物安全性好,生产成本低,易于规模化生产,便于推广应用。
建立间接ELISA检测方法的关键是抗原的质量。本实验除了用纯化的重组N蛋白作为抗原,也尝试了用纯化的AKAV全病毒作为包被抗原。用两种ELISA检测方法同时检测牛血清,并与中和试验进行符合率的比较,结果表明,N-ELISA和AKAVELISA与中和试验的符合率分别为72.5%和76.5%。两种方法均具有较好的实用价值,但鉴于使用全病毒作为抗原存在生物安全性问题,因此建议优先选择N-ELISA应用于临床血清样品的检测及流行病学调查研究。
[1]徐淑菲,孔繁德.赤羽病病原学研究进展[J].福建畜牧兽医,2005,27(5):25-26.
[2]Kirkland P D,Barry R D,Harper P A,et al.The development of Akabane virus-induced congenital abnormalities in cattle[J].Vet Rec,1988,122(24):582-586.
[3]李昌琳,封启民,张瑞珍,等.我国赤羽病血清学调查报告[J].动物检疫,1994,11(2):35-36.
[4]刘焕章,李树清.赤羽病琼脂免疫扩散试验诊断方法的研究[J].中国预防兽医学报,2000,22(4):299-301.
[5]刘焕章,吴东来,胡守萍,等.赤羽病、中山病和茨城病流行病学调查初报[J].中国奶牛,2002,5:46-47.
[6]李其平,周立桥,姚龙涛,等.阿卡斑(赤羽病)病毒的分离与初步鉴定[J].中国动物检疫,2000,17(7):27-29.
[7]Akashi H,Kaku Y,Kong Xiang-gang,et al.Sequence determination and phylogenetic analysis of the Akabane bunyavirus S RNA genome segment[J].J Gen Virol,1997,78:2847-2851.
[8]Lee J K,Park J S,Choi J H,et al.Encephalomyelitis associated with Akabane virus infection in adult cows[J].Vet Pathol,2002,39(2):269-273.
[9]Stram Y,Brenner J,Braverman Y,et al.Akabane virus in Israel:a new virus lineage[J].Virus Res,2004,104(1):93-97.
[10]Taylor W P,Mellor P S.The distribution of Akabane virus in the Middle East[J].Epidemiol Infect,1994,113(1):175-185.
[11]SN/T 1128-2007.赤羽病检疫技术规范.中华人民共和国出入境检验检疫行业标准[S].
[12]刘焕章,李树清,吴东来,等.赤羽病微量病毒中和试验诊断方法的研究[J].中国预防兽医学报,2001,23(1):53-55.
[13]陈卫中,倪宗瓒,潘晓平,等.用ROC曲线确定最佳临界点和可疑值范围[J].现代预防医学,2005,32(7):729-731.
[14]徐树兰,李少英,辛九庆,等.赤羽病病毒核衣壳蛋白抗体间接ELISA检测方法的建立[J].中国兽医科学,2006,36(11):868-875.
[15]Blacksell S D,Lunt R A.Rapid identification of Australian bunyavirus isolates belonging to the Simbu serogroup using indirect ELISA for mats[J].J Virol Methods,1997,66(1):123-133.
