短时间睡眠剥夺对全脑缺血/再灌注大鼠海马神经元损伤的影响
2014-05-19承欧梅余丽娟谌贝贝杨俊卿
赵 磊,承欧梅,余丽娟,杨 彬,王 佳,李 蓉,谌贝贝,杨俊卿
(重庆医科大学1.药理学教研室、2.附属第一医院神经内科,重庆 400016)
缺血性中风是仅次于癌症和心肌梗死的高致死性和致残性疾病。大量的药物和非药物干预措施研究用于减轻或防治缺血性损伤,然而这些干预措施对于缺血性脑损伤的临床疗效并不十分理想。因此,缺血性脑损伤机制及防治措施的研究至今仍显得十分重要。正常的睡眠是保证机体正常运行的生理因素之一,然而大部分患者中风后表现为睡意增强和睡眠-觉醒周期紊乱,研究提示睡眠过度和紊乱可引起疲劳、注意力不集中及记忆减退等类似抑郁的表现,并加重缺血后脑损伤[1]。而一定程度的睡眠剥夺,可改善中风后睡眠紊乱[2]。近年来研究显示,短时间睡眠剥夺对局灶性脑缺血损伤的影响多为矛盾性结果,有研究发现有保护性作用[3],也有研究发现可增强脑损伤[4];研究表明短时间睡眠剥夺能促进正常大鼠的神经发生[5],而也有报道睡眠剥夺可减少正常成年大鼠齿状回细胞增殖[6]。造成这些矛盾性研究结果可能与动物模型、睡眠剥夺的方式和时程不同有关。目前,少见国内外对全脑缺血/再灌注脑损伤后睡眠剥夺干预作用及机制的研究报道。本研究拟对大鼠全脑缺血/再灌注后给予一定程度的睡眠剥夺,观察其对缺血/再灌注大鼠海马神经元损伤和增殖的影响。
1 材料与方法
1.1 主要材料 SD大鼠由重庆医科大学实验动物中心提供,饲养于重庆医科大学附属第一医院SPF级动物实验室;Morris水迷宫系统,淮北正华生物仪器设备有限公司;TUNEL细胞凋亡免疫组化试剂盒购自罗氏公司;5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyUridine,BrdU)、小鼠抗BrdU单克隆抗体,均购自Sigma公司。
1.2 实验动物分组 ♂SD大鼠42只,质量200~250 g,大鼠随机分为3组:假手术组(S)、全脑缺血/再灌注损伤组(GCIR),全脑缺血/再灌注损伤+睡眠剥夺组(GCIR+SD),每组14只。
1.3 大鼠全脑缺血/再灌注模型制备 双侧颈总动脉夹闭合并低血压建立全脑缺血/再灌注模型[7]。水合氯醛(0.24 mol·L-1)麻醉,分离左、右颈总动脉及右侧颈总静脉,静脉插管,输入肝素化生理盐水,按照大鼠总血容量0.3体积分数抽取,夹闭双侧颈总动脉20 min,然后缓慢回输血液,缝合。假手术组仅分离双侧颈总动脉和右侧颈总静脉。
1.4 睡眠剥夺干预及Brd U标记 睡眠剥夺采用小平台水环境法[8]。自制装置为直径40 cm的水桶,桶中放置一直径6 cm圆形平台,平台高出水面约1 cm,大鼠睡眠剥夺期间正常饮食。造模前1周大鼠每天站立平台适应5 min。自再灌注后48 h开始睡眠剥夺12 h(8∶00AM~8∶00PM),连续3 d,给予自然光照环境。为排除该方法所产生的应激、活动限制等因素,全脑缺血/再灌注组和假手术组选用直径18 cm平台,大鼠在平台上可以维持正常的睡眠-觉醒周期。标记干细胞增殖的大鼠于睡眠剥夺d 2~d 3,按50μg·g-1量腹腔注射BrdU(Sigma,10 g·L-1)生理盐水,每日3次,间隔4 h。
1.5 行为学测试[9]Morris水迷宫直径150 cm、高60 cm,内含直径12 cm平台一个,置于水面下1 cm。水池四壁标记A、B、C、D象限,为实验时大鼠入水点,实验全程实时监控,电脑记录数据。训练d 1将大鼠放于平台适应1 min,由任意象限池壁放入水中让其自由游泳至平台,90 s内未找到平台者,由试验者将其引导至平台停留15 s后终止试验。d 2~d 4大鼠直接由4个象限沿池壁放入水中进行训练,寻台时间超过90 s按照90 s计算。d 5时,撤去平台,随机选定一个象限将大鼠放入水迷宫中,记录大鼠寻台潜伏期和轨迹。
1.6 组织病理学检查 再灌注后d 7,麻醉大鼠后进行在体灌流固定。分离海马浸泡于4 g·L-1多聚甲醛中固定48 h,梯度乙醇脱水,石蜡包埋,冠状连续厚4μm切片,HE染色,显微镜下观察海马神经元形态结构变化。每个样本分别取3张切片,每张切片取5个高倍视野进行细胞计数。
1.7 TUNEL法检测细胞凋亡 上述石蜡切片进行细胞凋亡检测,按试剂盒说明,滴加蛋白酶K(20 mg·L-1)溶液,37℃恒温消化 60 min,滴加 Triton-X100(0.01%)通透 20 min,滴加 TUNEL(50μl)反应液,4℃过夜。复温后滴加POD,37℃恒温孵育60 min。DAB显色,显微镜下观察海马阳性凋亡细胞。每个样本分别取3张切片,每张切片取5个高倍视野进行细胞计数。
1.8 Brd U免疫组化 再灌注后d 14,麻醉大鼠后进行在体灌流固定。脑组织石蜡包埋,冠状连续切厚4μm切片。枸橼酸加热修复,分别用HCl(1 mol·L-1)、HCl(2 mol·L-1)处理,滴加胰酶(1 g·L-1)处理20 min。山羊血清封闭,滴加BrdU一抗(Sigma)(PBS阴性对照),4℃过夜。加二抗 37℃30 min,滴加辣根过氧化物酶标记的链霉素卵白素工作液37℃30 min,DAB显色,显微镜下观察海马增殖阳性细胞,细胞核呈深棕黄色的颗粒为增殖阳性细胞,每个样本分别取3张切片,每张切片取5个高倍视野进行细胞计数。
1.9 统计学分析 数据用¯x±s表示,免疫组化应用Image-pro plus6.0图像分析,SPSS 10.0统计软件包进行统计学处理。
2 结果
2.1 短时间睡眠剥夺对全脑缺血/再灌注大鼠学习与记忆功能的影响 水迷宫结果显示,与假手术组比,全脑缺血/再灌注组大鼠平均寻台潜伏期明显延长(P<0.05)。与全脑缺血/再灌注组相比,全脑缺血/再灌注+睡眠剥夺组的寻台潜伏期的平均时间明显缩短(P<0.05),见 Fig 1、2。
2.2 大鼠海马CA1区组织病理学形态变化 假手术组海马CA1区锥体细胞核清晰,结构完整。全脑缺血/再灌注组CA1区胞核固缩深染、结构排列散乱、数量减少。与全脑缺血/再灌注组相比,全脑缺血/再灌注+睡眠剥夺组大鼠海马神经元损伤明显减轻(P<0.01),见 Fig 3、4。
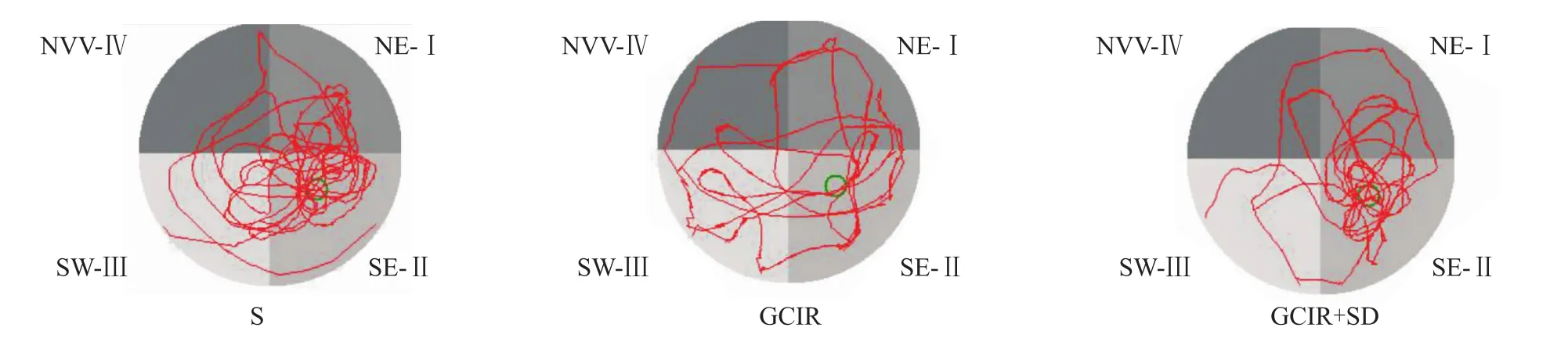
Fig 2 Morris typical track of rats

Fig 3 Effect of short-term sleep deprivation on CA1 area pathomorphology of rats 7 days after surgery.HE stain(×200)
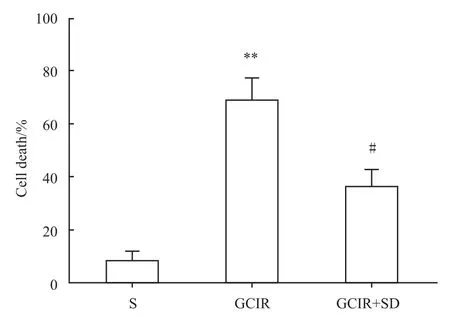
Fig 4 Percentage of dead neurons in the CA1 area of hippocampus(¯x±s,n=4)
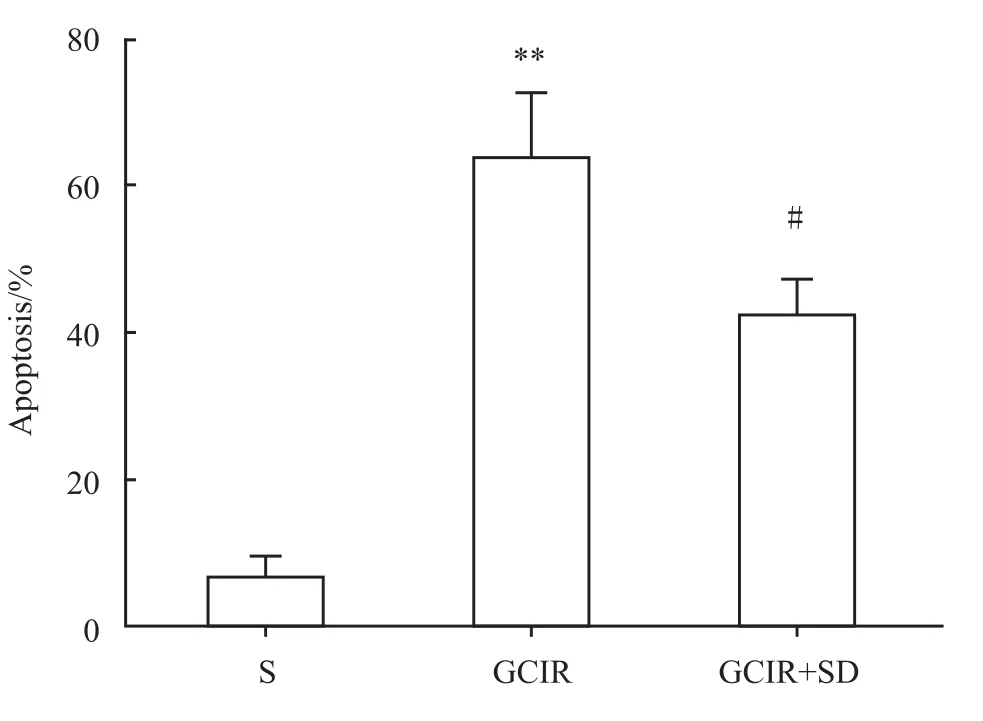
Fig 6 Percentage of positive apoptotic cells in the CA1 area of hippocampus(¯x±s,n=4)
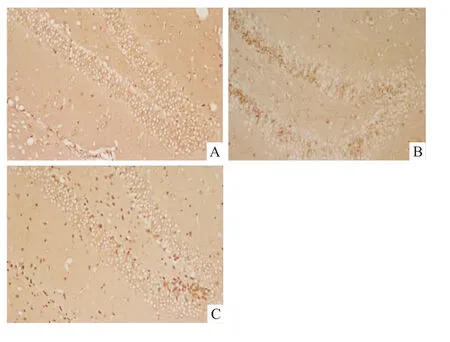
Fig 7 Effect of short-term sleep deprivation on the number of BrdU-positive cells in DG area 14 days after surgery(×200)
2.3 大鼠海马CA1区细胞凋亡变化 假手术组CA1区仅有少量的散在的TUNEL阳性细胞。而全脑缺血/再灌注组和全脑缺血/再灌注+睡眠剥夺组TUNEL阳性细胞数量较假手术组明显增多(P<0.01)。与全脑缺血/再灌注模型组相比,全脑缺血/再灌注+睡眠剥夺组大鼠海马CA1区阳性细胞百分比明显降低(P<0.05),见 Fig 5、6。
2.4 大鼠海马神经细胞增殖改变 BrdU免疫组化结果显示,假手术组海马齿状回仅见少量的阳性细胞。全脑缺血/再灌注组和全脑缺血/再灌注+睡眠剥夺组的阳性细胞数均有明显增加(P<0.01)。与全脑缺血/再灌注模型组相比,全脑缺血+睡眠剥夺组大鼠海马齿状回区BrdU阳性细胞百分比明显升高(P<0.05),见 Fig 7、8。
3 讨论
本研究结果显示,全脑缺血/再灌注大鼠学习记忆功能明显下降,海马神经元明显核固缩、凋亡。短时间睡眠剥夺能明显改善缺血/再灌注大鼠学习记忆障碍、海马神经元损伤和细胞凋亡。已有相似研究发现短时间剥夺可明显减轻局灶性缺血大鼠海马神经细胞损伤[3]。正常情况侧脑室室管膜下区(SVZ)和海马齿状回颗粒细胞下层区(SGZ)神经发生并不明显,脑损伤及脑缺血等刺激可增强这两个区域的神经元增殖分化[10],齿状回新生神经元能替代部分丢失神经元[11],这种替代对于中风、脑损伤、癫痫等疾病的恢复起到一定的代偿性保护作用[12],我们研究也发现全脑缺血/再灌注组大鼠齿状回的BrdU阳性细胞数明显增加,但是并不能明显减轻全脑缺血/再灌注导致的海马神经细胞损伤,其原因可能是此代偿性保护作用尚不足以对抗全脑缺血/再灌注带来的损伤。然而,我们也发现短时间睡眠剥夺能够进一步明显增加全脑缺血/再灌注大鼠齿状回BrdU阳性细胞数,同时全脑缺血/再灌注导致的海马神经细胞损伤明显减轻。我们的研究结果提示,短时间睡眠剥夺能通过促进全脑缺血/再灌注大鼠齿状回神经干细胞的增殖而发挥神经保护作用。关于短时间睡眠剥夺促进全脑缺血/再灌注大鼠海马神经发生的机制目前并不清楚,可能与大鼠海马脑源性神经营养因子(BDNF)的表达增加[13-14]、海马细胞外 5羟色胺 (5-HT)持续升高[15-16]和大鼠海马神经胶质相关炎症反应减轻[17]等有关,但是需要进一步深入研究。
总之,我们的研究结果显示,短时间睡眠剥夺能明显促进海马神经细胞增殖,从而改善全脑缺血/再灌注大鼠学习记忆障碍和海马神经元损伤,其具体的机制需要进一步深入研究。
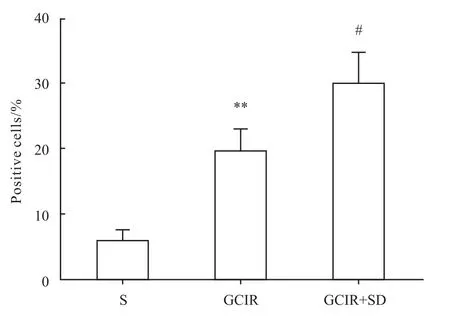
Fig 8 Percentage of positive BrdU cells in the DG area of hippocampus(¯x±s,n=4)
参考文献:
[1]Lavie P.The touch of morpheus pre-20th century accounts of sleepy patients[J].Neurology,1991,41(11):1841-1841.
[2]刘国军,陈康宁.卒中后睡眠障碍研究进展[J].中国卒中杂志,2007,(05):455-8.
[2]Liu G J,Chen K N.Advance of sleep disorder after stroke[J].Chin J Strok,2007,2(05):459-462.
[3]Moldovan M,Constantinescu A O,Balseanu A,et al.Sleep deprivation attenuates experimental stroke severity in rats[J].Exp Neurol,2010,222(1):135-43.
[4]Gao B,Cam E,Jaeger H,et al.Sleep disruption aggravates focal cerebral ischemia in the rat[J].Sleep,2010,33(7):879.
[5]Grassi Zucconi G,Cipriani S,Balgkouranidou I,Scattoni R.‘One night’sleep deprivation stimulates hippocampal neurogenesis[J].Brain Res Bull,2006,69(4):375-81.
[6]Guzman-Marin R,Suntsova N,Methippara M,et al.Sleep deprivation suppresses neurogenesis in the adult hippocampus of rats[J].Eur J Neurosci,2005,22(8):2111-6.
[7]杨 彬,余丽娟,王 佳,杨俊卿,全脑缺血/再灌注大鼠皮层PGI2和TXA2时程变化特征[J].中国药理学通报,2013,29(12):1667-71.
[7]Bin Y,Yu L J,Wang J,Yang J Q.Time course change of PGI2 and TA2 levels in rat cortex following global cerebral ischemia reperfusion[J].Chin Pharmacol Bull,2013,29(12):1667-71.
[8]Medeiros R,Lenneberg-Hoshino C,Hoshino K,Tufik S.Neuroethologic differences in sleep deprivation induced by the single-and multiple-platform methods[J].Brazilian J Med Biol Res,1998,31(5):675-80.
[9]Vorhees CV,Williams M T.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nature Protocols,2006,1(2):848-58.
[10]Kee N J,Preston E,Wojtowicz JM.Enhanced neurogenesis after transient global ischemia in the dentate gyrus of the rat[J].Exp Brain Res,2001,136(3):313-20.
[11]Björklund A,Lindvall O.Neurobiology:Self-repair in the brain[J].Nature,2000,405(6789):892-5.
[12]Magavi SS,Leavitt B R,Macklis JD.Induction of neurogenesis in the neocortex of adult mice[J].Nature,2000,405(6789):951-5.
[13]Hairston I S,Peyron C,Denning D P,et al.Sleep deprivation effects on growth factor expression in neonatal rats:a potential role for BDNF in the mediation of delta power[J].J Neurophysiol,2004,91(4):1586-95.
[14]Fujihara H,Sei H,Morita Y,et al.Morita,Short-term sleep disturbance enhances brain-derived neurotrophic factor gene expression in rat hippocampus by acting as internal stressor[J].J Molecul Neurosci,2003,21(3):223-31.
[15]Penalva RG,Lancel M,Flachskamm C,et al.Effect of sleep and sleep deprivation on serotonergic neurotransmission in the hippocampus:a combined in vivo microdialysis/EEG study in rats[J].Eur J Neurosci,2003,17(9):1896-906.
[16]Lopez-Rodriguez F C.Wilson N,Maidment R,et al.Total sleep deprivation increases extracellular serotonin in the rat hippocampus[J].Neuroscience,2003,121(2):523-30.
[17]Hsu J C,Lee Y S,Chang C N,et al.Sleep deprivation prior to transient global cerebral ischemia attenuates glial reaction in the rat hippocampal formation[J].Brain Res,2003,984(1):170-81.