基于UPLC-Q-TOF/MS研究参附注射液的物质基础
2014-05-19何家乐周思思马增春梁乾德王宇光谭洪玲肖成荣汤响林
何家乐,周思思,马增春,梁乾德,王宇光,谭洪玲,肖成荣,汤响林,高 月
(1.安徽医科大学研究生学院,安徽合肥 230032;2.军事医学科学院放射与辐射医学研究所,北京 100850)
方剂是临床主要的用药形式,传统的中药复方都是中药材按照一定的组方原理构成,近年来有效成分的配伍正在成为复方药物研究开发的一种新的趋势,通过配伍优化从而明显提升复方中药的科技含量[1]。
参附注射液是由红参和附片的提取物制成的复方制剂,本室前期考察了参附配伍后对双酯型二萜生物碱、药物代谢酶和转运蛋白的影响[2-4]。为进一步考察组分配伍对体内过程的影响,我们运用超高效液相色谱/四级杆飞行时间质谱联用(ultra performance liquid chromatography/quadrupole time-offlight mass spectrometer,UPLC/Q-TOF-MS)技术对参附注射液的成分以及入血成分进行定性定量分析,为参附成分间相互作用研究提供技术支持。
1 材料与方法
1.1 材料
1.1.1 动物 Wistar大鼠,6~8周龄,体质量180~220 g,由军事医学科学院实验动物中心提供[动物合格证号:SCXK-(军)2007-004]。
1.1.2 试剂与材料 甲醇(分析纯,国药集团化学试剂有限公司)、甲酸(色谱纯,CNW Technologies GmbH公司)、乙腈(色谱纯,Fisher Scientific公司)、参附注射液(雅安三九药业有限责任公司,批号121220010)、人参皂苷Rd、Ro、Rc(上海源叶生物科技有限公司,批号 20120505、20120805、20120427)、人参皂苷 Rg1、Rb1、Rb2(中国药品生物制品检定所,批号110703-201027、110704-201122、111715-200802)。
1.1.3 仪器 Acquity UPLC系统和Synapt MS四级杆飞行时间质谱系统(Waters公司)、Acquity HSS T3色谱柱(100 mm×2.1 mm I.D.,1.8μm,Waters公司)、MassLynx V4.1质谱工作站(Waters公司)、纯水仪(Millipore Simplicity)、氮气吹干仪(余姚市长江温度仪表厂,TTL-DCⅡ型)、冷冻离心机(Heraeus Labofuge 400R)。
1.2 方法
1.2.1 色谱条件 色谱柱Acquity HSS T3(100 mm ×2.1 mm I.D.,1.8μm,Waters公司),柱温45℃,进样量 5μl,流速0.45 ml·min-1;流动相 A:0.1%甲酸水溶液;流动相B:0.1%甲酸乙腈溶液,梯度洗脱条件(0→1 min:2%B;1→2 min:2%→5%B;2→3 min:5% → 20%B;3→6 min:20%→30%B;6→10 min:30%→33%B;10→13 min:33%→36%B;13→17 min:36%→40%B;17→18 min:40% → 100%B;18→19 min:100%→2%B;19→20 min:2%B)[5]。
1.2.2 质谱条件 采用电喷雾电离离子源(ESI),正离子V模式检测:m/z范围70-1000,锥孔电压40 V,毛细管电压2.9 V,脱溶剂温450℃,离子源温度100℃,锥孔气流量50 L·h-1,脱溶剂气体流速900 L·h-1,质量校正质核比 m/z 556.2771;负离子V模式检测:m/z范围 70-1200,锥孔电压为 40 kV,毛细管电压3 V,脱溶剂温为450℃,离子源温度为100℃,锥孔气流量50 L·h-1,脱溶剂气体流速为 900 L· h-1,质 量 校 正 质 核 比 为 m/z 554.2615[6]。
1.2.3 血清样品的制备 8只Wistar大鼠常规饲养数天适应环境后,随机编号,给药前禁食12 h,不禁水,按照临床剂量尾静脉注射给予参附注射液2 ml,于给药前,以及给药后 5、15、30、45、60、90、120 min,3、4、6、8、12、24、48 h眶后静脉采血 500μl,离心后分别取200μl的血清,加入800μl的甲醇,再加入100μl苦杏仁苷作为内标充分涡旋混合,13 000 r·min-1离心 10 min,取上清,吹干,200μl流动相(乙腈 ∶水=1∶1)复溶,高速离心,取上清,即为样品,4℃保存,待测。
1.2.4 人参皂苷混合标准溶液的配制 制备材料中所述6种人参皂苷的标准曲线,通过预实验确定人参皂苷 Rd的浓度分别为 8、10、20、40、60、80μmol·L-1;人参皂苷 Rg1的浓度分别为 4、8、16、24、32、40 μmol·L-1;人参皂苷 Rb1的浓度分别为 10、20、20、40、80、120μmol·L-1;人参皂苷 Ro的浓度分别为4、10、16、24、40、60μmol·L-1;人参皂苷 Rc的浓度分别为8、10、20、40、60、100μmol·L-1;人参皂苷 Rb2的浓度分别为8、10、20、40、60、100μmol·L-1。
1.2.5 方法学考察 取空白血清180μl,加6种人参皂苷混合对照品溶液,配制成系列血清样品,按上述样品处理方法处理后进样分析,以测得的峰面积Y对血药浓度X作线性回归。同法配置低、中、高3个浓度(即加入的人参皂苷Rd的浓度分别为10、40、80μmol·L-1;人参皂苷 Rg1的浓度分别为 8、24、40μmol·L-1;人参皂苷 Rb1的浓度分别为 20、40、120μmol·L-1;人参皂苷 Ro的浓度分别为 10、24、60μmol·L-1;人参皂苷 Rc的浓度分别为 10、40、100μmol·L-1;人参皂苷Rb2的浓度分别为10、40、100μmol·L-1)的样品,按上述样品处理方法处理操作,随标准曲线同时测定,计算方法回收率、日内、日间精密度和准确度。
2 结果
2.1 方法学考察 在所选的实验条件下,血清中的内源物质并不干扰人参皂苷的测定。Rd、Rg1、Rb1、Ro、Rc、Rb2等6种人参皂苷的最低检测限分别为0.10、0.17、0.11、0.09、0.11、0.11μg·L-1,定量下限分别是 0.54、0.30、0.99、0.51、0.96、2.02μg·L-1。该方法6种人参皂苷分别在7.93~79.3、3.38~33.8、11.1~132.8、3.82~57.33、8.62~107.76、8.62~107.76μg·L-1浓度范围内线性关系良好,回归方程分别为^Y=0.0187X+0.0693(r2=0.9934)、^Y=0.0399X+0.0052(r2=0.9984)、^Y=0.0294X-0.2007(r2=0.9870)、^Y=0.0428X+0.0568(r2=0.9954)、^Y=0.0225X-0.0643(r2=0.9962)、^Y=0.0112X+0.0209(r2=0.9977)。6种人参皂苷 Rd、Rg1、Rb1、Ro、Rc、Rb2在低中高3个浓度的日内精密度、日间精密度、准确度RSD均小于10%。回收率在76.8%~96.2%之间,RSD≤9.1%,符合SFDA的相关要求。由此可见,本实验建立的LC-MS方法适用于血清中6种人参皂苷浓度的测定。
2.2 体外实验 利用LC-MS对参附注射液中的化合物进行了定性鉴别,得到参附注射液正负离子模式下的总离子流图(Fig 1、2)。采用 MassLynx4.1对正负离子模式总离子流图进行处理,并进行峰标记。在电喷雾一级谱中获得标记峰的分子量信息,结合Mass值、保留时间和EMS软件数据库对主要分子峰进行归属,确定峰化合物信息,如Tab 1、2所示,质量精确度误差均小于5ppm。
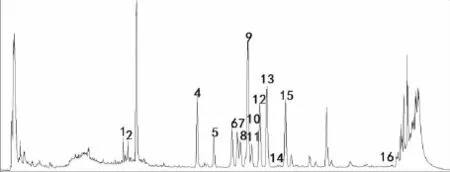
Fig 1 Total ion chromatogram of Shenfu injection in negative ion mode
2.3 体内实验 8只180~220 g健康Wistar大鼠饲养72 h适应环境后,尾静脉注射参附注射液2 ml,测得的人参皂苷平均血药浓度-时间曲线见Fig 3。主要的药物代谢动力学参数见Tab 3。
3 讨论
方剂作用的物质基础、作用机制、配伍规律及体内过程是中药研究的核心科学问题。附子的主要成分为乌头类生物碱,分为双酯型二萜类生物碱和单酯型二萜类生物碱,附子的化学成分含有多种既是有效成分又是有毒成分的成分,其中双酯型二萜类如乌头碱(aconitine)、中乌头碱(mesaconitine)、次乌头碱(hypaconitine)既表现出抗炎镇痛的药理作用,也表现出引发心率失常的毒理作用[7]。如何把握附子的“减毒存效”与“增效减毒”的问题,成为当前需要重点研究的内容之一[8]。
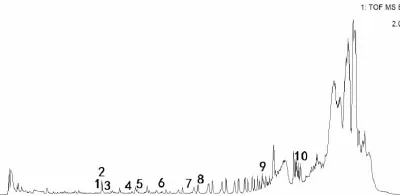
Fig 2 Total ion chromatogram of Shenfu injection in positive ion mode
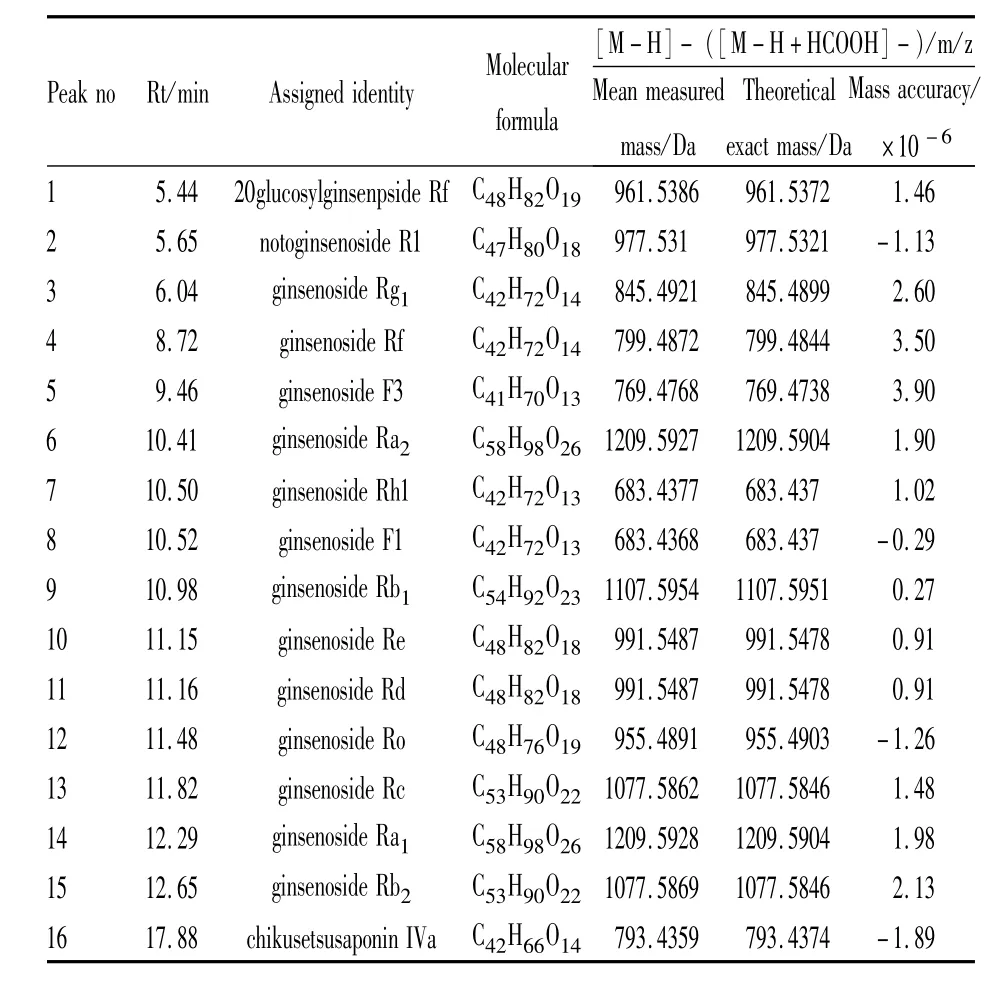
Tab 1 Ginsenosides detected in Shenfu injection
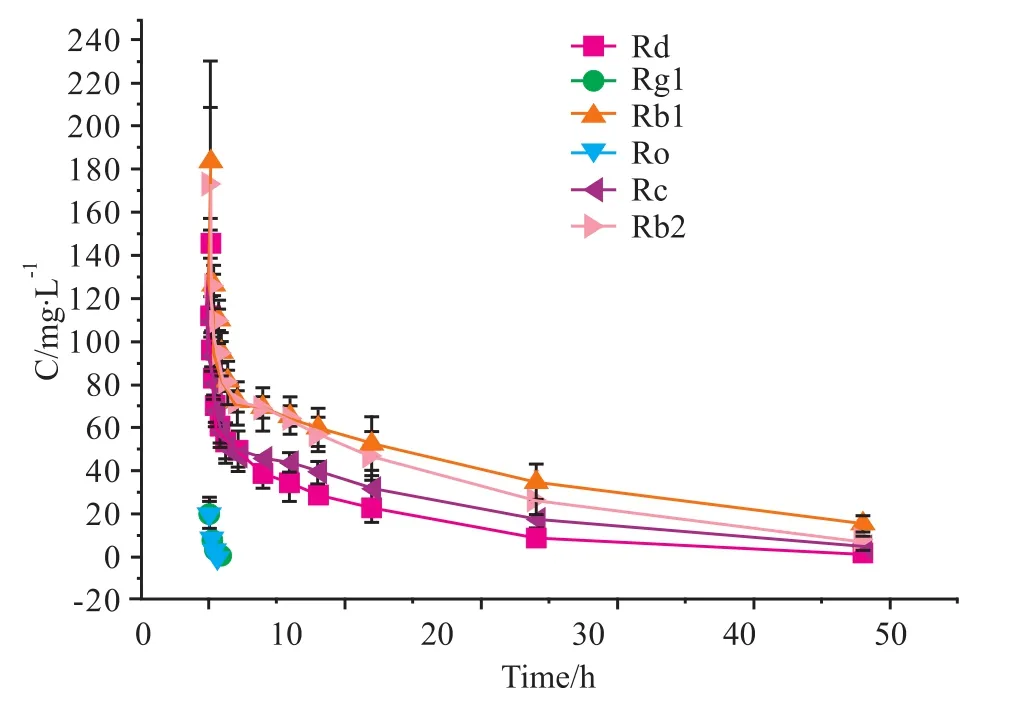
Fig 3 Mean serum concentration-time curves of ginsenosides after intravenous injection of 2 ml Shenfu in rats(n=8)
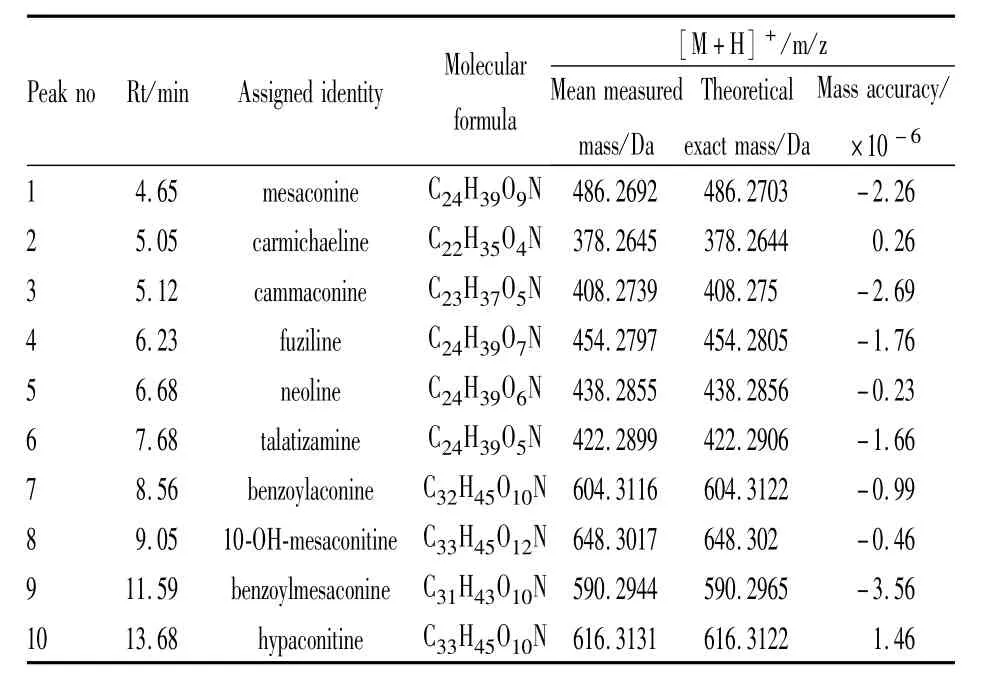
Tab 2 Alkaloids detected in Shenfu injection

Tab 3 Pharmacokinetic parameters of ginsenosides after intravenous injection of 2 ml Shenfu in rats(¯x±s,n=8)
对参附注射液的入血成分研究结果表明,血清中能够定量检测到的6种人参皂苷,人参皂苷Rg1、Ro的血药维持时间较短,人参皂苷 Rd、Rb1、Rb2、Rc的血药维持时间较长。观察其结构可发现人参皂苷Rb1、Rb2、Rc、Rd属于达玛烷型三萜皂苷原人参二醇型化合物,人参皂苷Rg1属于达玛烷型三萜皂苷原人参三醇型化合物,而Ro则属于齐墩果酸型皂苷,这种结构上的差异可能是造成血药维持时间差别的原因。目前对人参皂苷类成分的药代研究文献较多[9-10],但同时检测多个人参皂苷类成分的文献较少。参附注射液的入血成分中未发现生物碱类成分,这与参附注射液中生物碱的含量较低有关,而文献曾报道参附注射粉的入血成分中含有生物碱类成分[11]。
方剂组分配伍作用可发生在化学、药代、药效等多个层次,其作用模式可在药代-药效环节产生协同、拮抗等相互作用[12]。本文在药代层次上对参附注射液体外、体内成分的分析为组分配伍研究建立了可靠的方法。
参考文献:
[1]陶 丽,范方田,陆 茵,等.中药及其组分配伍的的整合作用研究实践与进展 [J].中国药理学通报,2013,29(2):153-6.
[1]Tao L,Fan F T,Lu Y,et al.Research development on the integration effect of traditional Chinese medicine and its prescriptions[J].Chin Pharmacol Bull,2013,29(2):153-6.
[2]马增春,周思思,高 月,等.基于 UPLC-TOF/MS分析人参附子配伍减毒的物质基础 [J].药学学报,2011,46(12):1488-92.
[2]Ma ZC,Zhou SS,Gao Y,et al.UPLC-TOF/MSbased chemical profiling approach to evaluate toxicity-attenuated chemical composition in combination of ginseng and radix aconiti praeparata[J].Acta Pharm Sin,2011,46(12):1488-92.
[3]李 晗,王宇光,马增春,等.基于临床用量的参附注射液对大鼠肝脏主要药物代谢酶的影响 [J].药学学报,2013,48(5):728-33.
[3]Li H,Wang Y G,Ma Z C,et al.Effect of Shenfu injection on CYP450s of rat liver[J].Acta Pharm Sin,2013,48(5):728-33.
[4]王宇光,刘浩生,张娴勰,等.人参中皂苷成分的孕烷X受体激动特性筛选 [J].药学学报,2013,48(1):144-8.
[4]Wang Y G,Liu H S,Zhang X X,et al.Screening of pregnane X receptor activation from ginsenosides[J].Acta Pharm Sin,2013,48(1):144-8.
[5]周思思,马增春,梁乾德,等.基于UPLC-TOF-MS分析人参麦冬配伍后人参皂苷的变化[J].质谱学报,2013,34(2):88-91.
[5]Zhou S S,Ma Z C,Liang Q D,et al.UPLC/Q-TOF-MS based chemical profiling approach to evaluate ginsenoside composition in combination of ginseng and radix ophiopogonis[J].J Chin Mass Spectr Soc,2013,34(2):88-91.
[6]周思思,马增春,高 月,等.基于UPLC/Q-TOF-MS分析附子半夏配伍相反的物质基础 [J].化学学报,2012,70(3):284-90.
[6]Zhou SS,Ma Z C,Gao Y,et al.UPLC/Q-TOF-MSbased chemical profiling approach to evaluate chemical composition of augmentation toxicity in combination of radix aconiti and pinellia praeparata[J].Acta Chim Sin,2012,70(3):284-90.
[7]周思思,马增春,高 月,等.人参附子不同比例配伍对小鼠急性毒性的影响[J].天津中医药,2013,30(1):43-6.
[7]Zhou SS,Ma Z C,Gao Y,et al.Influence of radix ginseng and radix aconiti lateralis preparata in different proportion compatibility on acute toxicity in mice[J].Tianjin J Trad Chin Med,2013,30(1):43-6.
[8]周思思,马增春,高 月,等.基于UPLC/Q-TOF-MS分析附子煎煮过程中化学成分变化 [J].中西医结合学报,2012,10(8):894-900.
[8]Zhou SS,Ma Z C,Gao Y,et al.UPLC/Q-TOF-MSbased chemical profilingapproach toevaluate the chemical constitution of radix aconiti lateralis preparata in the process of decoction[J].J Integr Med,2012,10(8):894-900.
[9]Chu Y,Zhang H C,Li SM,et al.Determination of ginsenoside Rc in rat plasma by LC-MS/MSand its application to a pharmacokinetic study[J].J Chromatogr B Analyt Technol Biomed Life Sci,2013,919-920(2013):75-8.
[10]Sun D,Wang B,Shi M,et al.Pharmacokinetic,tissue distribution and excretion of ginsenoside-Rd in rodents[J].Phytomedicine,2012,19(3-4):369-73.
[11]Zhang F,Tang M H,Chen L J,et al.Simultaneous quantitation of aconitine, mesaconitine, hypaconitine, benzoylaconine,benzoylmesaconine and benzoylhypaconine in human plasma by liquid chromatography-tandem mass spectrometry and pharmacokinetics evaluation of“SHEN-FU”injectable powder[J].JChromatogr B Analyt Technol Biomed Life Sci,2008,873(2):173-9.
[12]郝海平,郑超湳,王广基.多组分、多靶点中药整体药代动力学研究的思考与探索[J].药学学报,2009,44(3):270-5.
[12]Hao H P,Zheng CN,Wang G J.Thoughts and experimental exploration on pharmacokinetic study of herbal medicines with multiple-components and targets[J].Acta Pharm Sin,2009,44(3):270-5.