以大孔硅胶为载体的苯丙氨酸解氨酶交联酶聚体的制备及性质研究
2014-05-17李连连崔建东
李连连,崔建东
(河北省发酵工程技术研究中心,生物科学与工程学院,河北科技大学,河北石家庄050018)
苯丙氨酸解氨酶(Phenylalanine ammonia lyase,PAL,EC.4.3.1.5)是一种由四个亚基组成的寡聚酶,分子量一般在220~330ku[1]。存在于各种植物和少数微生物中,在植物体内是次生代谢的关键酶和限速酶,在微生物中可以催化L-苯丙氨酸非氧化脱氨生成反式肉桂酸和氨根离子。近20年来,PAL在临床,工业以及生物技术应用方面备受关注。纯化后,不仅可以用于治疗某些肿瘤,还可以诊断和治疗苯丙酮尿症[2]。但目前最主要的用途是催化反式肉桂酸转化,制备L-苯丙氨酸,而后者是合成阿斯巴甜的主要原料。由于游离酶的稳定性低,该酶的广泛应用受到限制。

表1 标准曲线操作表Table 1 Standed curve operating table
交联酶聚体技术(CLEAs)是一种新型的无载体固定化酶技术,制备容易,操作简单,可以在一定程度上提高酶的稳定性,但是在实际应用中交联酶聚体技术暴露出很多问题。一方面,CLEAs的粒度一般都在10μm以下,这样就很难通过简单地离心或过滤从反应体系中分离和回收CLEAs,尤其是底物和CLEAs的粒度处于相同水平时。另一方面,CLEAs压缩阻力很低,离心和过滤会使得其结成实心块,很难再重新均匀分散到反应体系中,使得催化效率降低。
硅胶是一种用途广泛的无机化学产品,多孔结构,机械强度高、热稳定性好、抗有机溶剂、抗微生物降解,受温度和压力的影响较小,安全无毒,廉价易得,并且可以在硅胶表面硅醇基的基础上进行化学键合和改性,所以较多的用作催化剂载体。目前,已应用于木瓜蛋白酶[3],脂肪酶[4],β-甘露糖酶[5],漆酶[6]等多种酶的固定化研究中。
为了弥补PAL-CLEAs在实际应用中的不足,本研究以大孔硅胶(MSG)为载体,利用CLEAs技术将PAL吸附后交联到MSG的孔道中,制备出新型的MSG-PAL-CLEAs。该 MSG-PAL-CLEAs不但具有较强的抗压缩能力,解决了回收过程中的结块问题;而且,MSG增大了CLEAs的粒度,使得催化剂的回收可以通过简单地静置完成。
1 材料与方法
1.1 材料与仪器
粘红酵母(Rhodotorula gluinis)中国工业微生物菌种保藏管理中心(CICC32913);大孔硅胶(孔径200~600Å,粒度0.5~1.0mm)中国青岛美高集团有限公司;L-苯丙氨酸、50%戊二醛 北京百灵威科技有限公司;3-氨丙基三乙氧基硅烷(APTES)曲阜万达化工有限公司;其他试剂均为市售分析纯。
NEXUS870傅里叶变换红外光谱仪 美国NICOLET公司;S-4800-Ⅰ型场发射扫描电子显微镜 日本HITACHI;752型紫外分光光度计 上海光谱仪器有限公司;DF-Ⅱ集热式磁力加热搅拌器 金坛市金南仪器制造有限公司;FD-27冷冻干燥机 北京德天佑科技发展有限公司;TGL-16C型离心机 上海安亭科学仪器厂;HC-3018型高速离心机 安徽中科中佳科学仪器有限公司;VORTEX-5型涡旋振荡器 海门市其林贝尔仪器制造有限公司;85-1B磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 PAL的提取 将培养后的粘红酵母利用微珠涡流法进行细胞破碎提取PAL粗酶液[7]。
1.2.2 苯丙氨酸解氨酶交联酶聚体(PAL-CLEAs)的制备 提取的粗酶液1mL(约1.2U/mL),边搅拌边加入硫酸铵粉末0.243g,使其终饱和度为40%,静置沉淀1h,加入10%的戊二醛水溶液,使戊二醛的终浓度为0.1%,搅拌交联1h,上述步骤均冰浴进行。
1.2.3 无氨基化硅胶为载体的苯丙氨酸交联酶聚体(SG-PAL-CLEAs)的制备 按照0.05g硅胶/mL酶液,室温,震荡吸附2.5h后,洗涤一次,加入饱和度为40%的硫酸铵溶液,震荡沉淀1h,加入戊二醛溶液,使其终浓度达到1.5%,冰浴震荡交联1h后,洗涤三次,即得 SG-PAL-CLEAs,置于4℃冰箱备用。
1.2.4 氨基键合硅胶为载体的苯丙氨酸解氨酶交联酶聚体(MSG-PAL-CLEAs)的制备
1.2.4.1 大孔硅胶氨基化 根据文献[8],称取5g大孔硅胶,浸入50mL 20%的盐酸中浸泡8h。用蒸馏水洗涤,至中性,真空干燥。准确称取活化后的硅胶1g,以1/25/2(w/v/v)加入甲苯和APTES,油浴加热回流一定时间。然后依次用适量的甲苯、蒸馏水、无水乙醇多次洗涤。真空干燥,得到氨基键合硅胶。
1.2.4.2 氨基键合硅胶为载体的苯丙氨酸解氨酶交联酶聚体(MSG-PAL-CLEAs)的制备 根据文献[9]按照0.05g硅胶/mL酶液,室温,震荡吸附2.5h后,洗涤一次,加入饱和度为80%的硫酸铵溶液,震荡沉淀1h,加入戊二醛溶液,使其终浓度达到1%,冰浴震荡交联 1h后,洗涤三次,即得 MSG-PALCLEAs,置于4℃冰箱备用。
1.2.4.3 大孔硅胶键合氨基数目的测定 根据文献[10],称取10mg氨基键合硅胶置于5mL的离心管中,用耦合溶液(冰醋酸∶无水甲醇为0.8∶100(v/v))充分洗涤三次,每次2mL。然后加入2mL对硝基苯甲醛溶液置于摇床上充分反应3h,反应结束后,再用耦合溶液洗去未反应的对硝基苯甲醛。和对硝基苯甲醛反应后的硅胶,加入2mL水解溶液(甲醇∶水∶冰醋酸比为 75∶75∶0.2(v/v/v)),置于摇床继续反应4h,静置分离。吸取上清液,稀释20倍,测定267nm吸光值。配制浓度为0.5μmol/mL的对硝基苯甲醛溶液(7mg对硝基苯甲醛溶于10mL耦合溶液),按表1混合,测定267nm下的吸光值,做出标准曲线。根据标准曲线计算硅胶表面的氨基数目。计算公式见
式中:C-对硝基苯甲醛的浓度(μmol/mL);V-水解溶液的体积(mL);G-参加反应的硅胶质量(g)。
1.2.5 酶活测定方法 一个酶活力单位定义为每分钟催化L-苯丙氨酸生成1μmol反式肉桂酸的酶量。以紫外分光光度法测定PAL的酶活[11]。
1.3 实验设计
1.3.1 大孔硅胶的氨基化条件的确定
1.3.1.1 加热回流时间的确定 准确称取0.5g活化后的硅胶,以1∶25(w/v)的比例,加入12.5mL甲苯,1∶1.5(w/v)的比例,加入 0.75mL APTES,110℃ 油浴加热回流。在7h后,每隔1h从反应体系中取出少量硅胶,依次用适量的甲苯,蒸馏水,无水乙醇多次洗涤,真空干燥。测定硅胶键合氨基的数目。
1.3.1.2 硅胶键合氨基的反应温度的优化 准确称取0.5g活化后的硅胶,以1∶25(w/v)的比例,加入12.5mL 甲苯,1∶1.5(w/v)的比例,加入 0.75g APTES,分别于60、90、110、150℃油浴回流相同时间。制备的硅胶依次用适量的甲苯,蒸馏水,无水乙醇多次洗涤,真空干燥。测定硅胶键合氨基的数目。
1.3.1.3 硅胶和APTES的比例的优化 准确称取0.5g活化的硅胶,加入12.5mL甲苯,分别以1/0.5,1/1,1/1.5,1/2(w/v)的比例加入 APTES,相同温度下由于回流相同时间。制备的硅胶依次用适量的甲苯,蒸馏水,无水乙醇多次洗涤,真空干燥。测定硅胶键合氨基的数目。
1.3.2 SG-PAL-CLEAs和 MSG-PAL-CLEAs的制备条件确定
1.3.2.1 吸附条件的确定
a.吸附时间的优化 室温条件下,将1mL粗酶液加入到0.05g大孔硅胶中,搅拌吸附后,洗涤一次,分被测定吸附 1.5、2.5、3.5、4.5、5.5h 后大孔硅胶的酶活。
b.吸附时硅胶和酶液比例的确定 室温条件下,分别将0.05、0.1、0.2、0.3、0.4g 大孔硅胶加入到 1mL粗酶液中,搅拌吸附2.5h后,洗涤一次,分别测定各份大孔硅胶酶活。
c.吸附pH的确定 将0.05g大孔硅胶分别加入到 pH 为5、6、7、8、8.8、10 的粗酶液中,搅拌吸附 2.5h后,洗涤一次,测大孔硅胶的酶活。
1.3.2.2 沉淀剂种类及浓度的确定 吸附后的大孔硅胶,洗涤一次,分别添加饱和度不同的硫酸铵溶液和浓度不同的PEG400溶液作为沉淀剂,室温下,震荡沉淀1h,分离出硅胶,测定酶活。
1.3.2.3 交联条件的确定
a.戊二醛浓度的确定 在室温条件下,将大孔硅胶加入到粗酶液中,搅拌吸附2.5h,洗涤后,氨基化硅胶加入饱和度为80%的硫酸铵溶液(无氨基化硅胶加入饱和度为40%的硫酸铵溶液),充分沉淀1h后,在此体系中,加入戊二醛作为交联剂,使得戊二醛的终浓度分别为0.1%、0.5%、1.0%、1.5%、2%、2.5%、3%,0℃震荡交联1h,洗涤三次后,测定各交联剂浓度下制备的以大孔硅胶为载体的交联酶聚体的酶活。
b.交联时间的确定 在室温条件下,将大孔硅胶加入到粗酶液中,搅拌吸附2.5h,洗涤后,氨基化硅胶加入饱和度为80%的硫酸铵溶液(无氨基化硅胶加入饱和度为40%的硫酸铵溶液),充分沉淀1h后,氨基化硅胶加入终浓度为1%的戊二醛,无氨基化硅胶加入终浓度为1.5%的戊二醛,0℃,震荡交联后,洗涤三次,测定交联0.5、1、2、3h后的以大孔硅胶为载体制备的交联酶聚体的酶活。
1.3.3 SG-PAL-CLEAs和 MSG-PAL-CLEAs的操作稳定性研究。
1.3.3.1 SG-PAL-CLEAs和 MSG-PAL-CLEAs的操作稳定性研究 将740mg反式肉桂酸溶解于45mL氨水(浓度为0.28mol/L)中,用硫酸调节pH为10,去离子水定容到100mL配制转化液。将 PALCLEAs与转化液按照 1∶4(v/v),MSG(SG)-CLEAs与转化液按照0.01∶1(m/v)的比例,30℃条件下进行转化反应,转化1h后分离出固定化酶后,用Tris-HCl(pH 8.8)缓冲液洗涤三次,测定洗涤后固定化酶的酶活。然后进行下一轮转化,直至第8轮。
1.3.3.2 SG-PAL-CLEAs和 MSG-PAL-CLEAs的储藏稳定性研究 将固定化酶和粗酶液储存在25℃条件下,分别于第0、5、10、17、24、29d 取出定量的固定化酶测定酶活。
2 结果与分析
2.1 大孔硅胶的氨基化
2.1.1 大孔硅胶的氨基化条件的确定 从图1、图2可以看出,以110℃加热回流10h的条件下,氨基化数目达到最高。在图3中,随着APTES/硅胶的比例的增高,氨基化程度也不断增高,但是考虑到较大APTES的浓度会在一定程度上提高固定化酶载体的成本,所以本实验选择的硅胶/APTES比为1/2(g/mL),得到的MSG的键接硅胶数目为478.3μmol/g。

图1 氨基化时间对硅胶键合氨基数目的影响Fig.1 Effect of amination time on the number of amino connected to macroporous silica gel
2.1.2 大孔硅胶氨基化前后的红外光谱(IR)分析 对于Si-O-Si的测定结果和 Jae-Won Lee[11]等的结果相同,在 1108cm-1为 Si-O-Si键反对称伸缩振动吸收峰;480cm-1为O-Si-O键的弯曲振动峰,796cm-1为Si-O-Si键反对称伸缩振动吸收峰。而氨基化后的大孔硅胶在3303cm-1出现了N-H键的伸缩振动吸收峰;在1604cm-1出现了N-H键弯曲振动吸收峰;在1195cm-1出现了 C-N的伸缩振动吸收峰[12]。大孔硅胶键接氨基过程发生的反应如图5所示,增加的基团和傅里叶红外光谱分析结果相对应。这些都说明在大孔硅胶表面已经成功键接上了氨基。

图2 氨基化温度对硅胶键合氨基数目的影响Fig.2 Effect of amination temperture on the number of amino connected to macroporous silica gel

图3 硅胶/APTES对硅胶键合氨基数目的影响Fig.3 Effect of macroporous silica gel/APTES on the number of amino connected to macroporous silica gel

图4 MSG和SG的IR图Fig.4 IR images of MSG and SG

图5 氨基化过程的方程式Fig.5 Reaction equation of amination process
2.2 SG-PAL-CLEAs和 MSG-PAL-CLEAs的制备条件确定
大孔硅胶为载体的PAL-CLEAs的制备过程包括三个步骤:PAL和硅胶的共吸附;PAL在沉淀剂的作用下在硅胶的孔道内形成超分子结构;在戊二醛的作用下,PAL超分子结构与氨基化硅胶表面键接的氨基,以及PAL超分子结构之间进行交联。
2.2.1 吸附过程的条件确定 吸附是通过酶分子与载体表面的相互作用对酶进行的一种非共价固定,这种方法成本低,过程温和。而酶与载体之间的相互作用会受到吸附时间,硅胶与酶的比例和环境pH等条件的影响。首先,吸附时间对酶活力的影响如图6,在2.5h前随着吸附时间的增加,越来越多的苯丙氨酸解氨酶分子扩散到大孔硅胶的孔内,在2.5h前后大孔硅胶的表面已经被吸附的酶分子饱和,随着时间的不断延长,吸附不够牢固的酶分子可能泄露到酶溶液中使得吸附酶活下降。其次,酶活力的高低还受硅胶和酶溶液比例的影响,图7中,随着酶液中硅胶量的增加,单位重量硅胶固定化酶的酶活降低了,这表明,硅胶/酶(g/mL)的提高并没有使得单位重量硅胶上负载的酶量,这可能是由于单位体积的酶液中添加的硅胶量越多,导致的硅胶之间的相互碰撞就越剧烈,增加了硅胶和酶分子之间相互吸附的难度。同时由于氨基化导致大孔硅胶孔道缩小[13],活化硅胶吸附的酶量明显高于氨基化硅胶。除此之外,pH对吸附能力的影响如图8所示,pH小于8.8时,随着酶液pH的升高,硅胶固定化酶的酶活均有所升高,在pH为8.8时,吸附后活化硅胶和氨基化硅胶的酶活均为最高,随着pH得继续升高,酶活开始下降,这可能是由于pH8.8恰好为活化硅胶和氨基化硅胶的吸附能力和苯丙氨酸解氨酶的活性的平衡点。

图6 吸附时间对吸附的影响Fig.6 Effect of adsorption time on the adsorption process
2.2.2 沉淀过程的条件确定 吸附后,苯丙氨酸解氨酶的游离酶已经吸附到大孔硅胶孔道表面。加入沉淀剂后,通过改变吸附在硅胶表面的酶分子的微环境,使其聚合形成酶超分子结构。通常会选择蛋白盐析试剂,如盐,有机溶剂,非离子聚合物或酸等作为沉淀剂,前期实验表明有机溶剂做沉淀剂制备交联酶聚体时,酶活损失严重。加入酸会改变溶液pH,也会大大降低酶活。本实验选择不同饱和度的硫酸铵和不同浓度的PEG400作为沉淀剂,如图9。可以观察到:对于活化的大孔硅胶,40%的硫酸铵做为沉淀剂时,酶活损失最少,酶活回收率几乎100%;对于氨基化的大孔硅胶,80%的硫酸铵作为沉淀剂时,酶活损失最少。
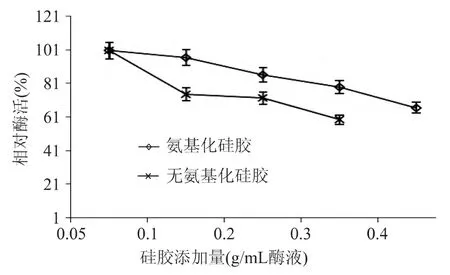
图7 硅胶添加量对吸附的影响Fig.7 Effect of silica gel(g)/mL enzyme solution on the adsorption process
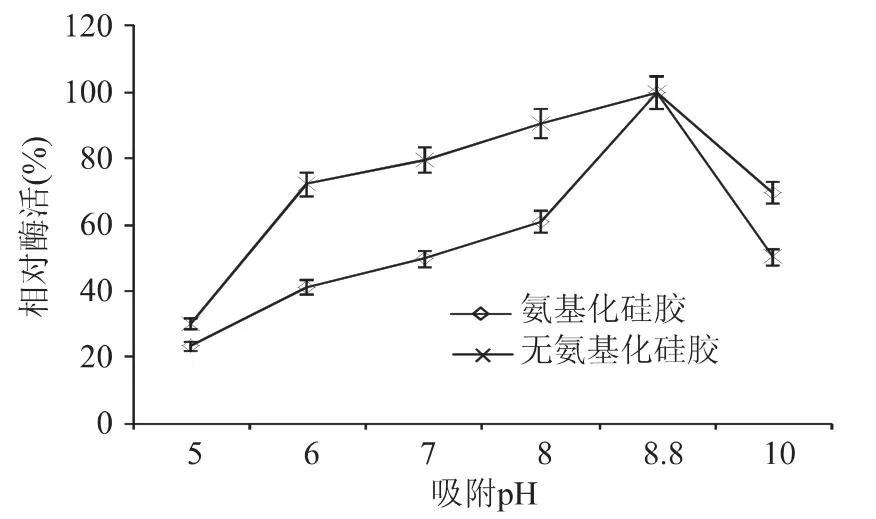
图8 pH对吸附的影响Fig.8 Effect of enzyme solution pH on the adsorption process

图9 沉淀剂对酶活回收率的影响Fig.9 The effect of precipitants on activity recovery of PAL
2.2.3 交联过程的条件确定
2.2.3.1 交联剂浓度的确定 交联是酶分子的自由氨基与双功能试剂进行的反应,常用的交联剂为戊二醛。通过交联剂戊二醛的交联,使得沉淀得到的超分子结构的苯丙氨酸解氨酶聚集体,在无氨基化的硅胶和氨基化大孔硅胶的孔道内生成CLEAs。由图10可以看出,当戊二醛终浓度为1%时,氨基化大孔硅胶负载的交联酶聚体的酶活回收率最高。戊二醛浓度为1.5%时,活化大孔硅胶负载的交联酶聚体的酶活回收率最高。戊二醛不仅是交联剂,而且是酶的变性剂。如果交联反应涉及酶活中心就有可能破坏酶的活性构象。高的戊二醛浓度还会引起酶分子的过度交联,使得酶分子变性失活。

图10 戊二醛浓度对酶活回收率的影响Fig.10 The effect of glutaraldehyde concentration on activity recovery of PAL
2.2.3.2 交联时间的确定 从图11可知,交联时间为1h时,氨基化硅胶为载体的苯丙氨酸解氨酶交联酶聚体和无氨基化硅胶为载体的苯丙氨酸解氨酶交联酶聚体的酶活回收率均为最高。时间太短,交联不够充分,交联效率下降;反之,如果延长交联时间,则会使酶暴露在戊二醛中的时间太长,易使酶失活。

图11 交联时间对酶活回收率的影响Fig.11 Effect of cross-linking time on activity recovery of PAL
2.3 扫描电镜(SEM)分析
修饰前后的硅胶分别如图12A、图12B所示,可以看出氨基化前后对硅胶的表面并没有太大的损伤,只是有文献报道氨基化后硅胶的孔径会减小。氨基化前后硅胶固载上酶后的电镜图如图C、D所示,活化硅胶固载的酶分布在硅胶孔道表面而氨基化硅胶固载的交联酶聚体则以颗粒状镶嵌在孔道中。此外,固体的多孔结构为CLEAs的附着提供框架。因此,MSG-PAL-CLEAs的粒度足够大使得生物催化剂适于工业应用。甚至,MSG-CLEAs可以在离心和过滤后由于MSG的支撑,避免在重复使用过程中形成CLEAs块。
2.4 MSG-PAL-CLEAs和 SG-PAL-CLEAs的稳定性研究

图12 电镜图Fig.12 SEM images
2.4.1 操作稳定性研究 MSG-PAL-CLEAs和SGPAL-CLEAs每反应一个批次后用缓冲液洗涤三次后,分离出硅胶,取一小份测定酶活性。MSG-PALCLEAs转化四个批次后酶活保留率79%,在反应四个批次后可能由于部分键接到硅胶上的氨基键能较弱造成部分链接上CLEAs的氨基从硅胶上脱落,从而使得少量酶泄露,但是 SG-PAL-CLEAs在反应一个批次后酶活保留率只剩下60%,硅胶氨基化以后再固载交联酶聚体可以在一定程度上防止酶泄露。而CLEAs在相同条件下由于回收过程,交联酶聚体颗粒较小,需由离心收集,离心过程使得交联酶聚体互相挤压结块,重新应用时导致分散不均匀,影响酶催化反应的传质过程,在转化两次后酶活残留率仅49%。这充分证明将CLEAs通过戊二醛交联固载到硅胶上不仅可以有效地防止酶泄露,而且可以有效地解决交联酶聚体的结块问题,使得交联酶聚体在重新应用过程中均匀分散。
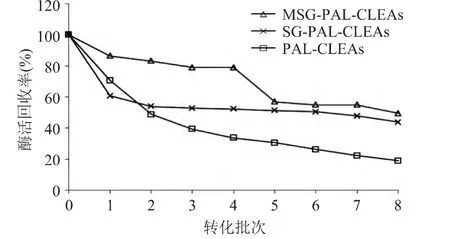
图13 PAL固定化酶的操作稳定性Fig.13 Operational stability of immobilized enzyme
2.4.2 储藏稳定性 将游离酶、CLEAs、MSG-PALCLEAs和SG-PAL-CLEAs均放置在25℃下贮存,检测 MSG-PAL-CLEAs和 SG-PAL-CLEAs的储藏稳定性结果如图14,MSG-PAL-CLEAs的酶活残留率在17d内均保持较高水平,之后有所下降,但29d后酶活残留仍高达50%;SG-PAL-CLEAs的酶活残留率在5d后急剧下降;这可能是由于在大孔硅胶形成的交联酶聚体颗粒在贮存过程中会发生泄露。游离酶和CLEAs在贮存10d后酶活残留率开始急剧下降,贮藏29d后酶活残留率分别下降到15%和26%。这可以充分的说明MSG-PAL-CLEAs在25℃下在溶液中贮存,半衰期在29d左右。交联可以有效地防止SG-PAL-CLEAs孔道中的CLEAs颗粒泄露,固载到硅胶上可以有效地延长苯丙氨酸解氨酶的贮藏时间。
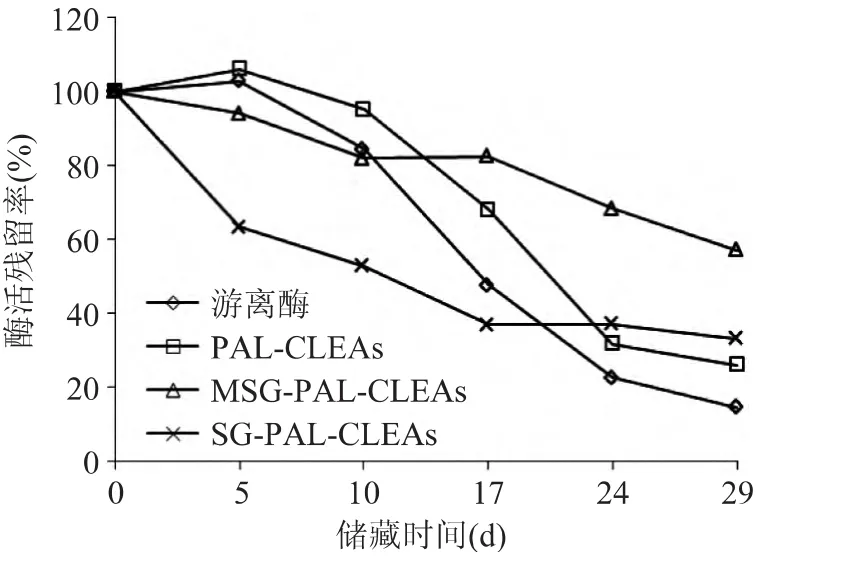
图14 PAL游离酶和固定化酶的储藏稳定性Fig.14 Storage stability of free enzyme and immobilized enzyme
3 结论
本研究以大孔硅胶为载体制备的交联酶聚体,酶活回收率在45%左右;并且其操作稳定性和储藏稳定性相对于CLEAs都有一定程度的改善。酶的这种固定化方法成功的解决了交联酶聚体在实际应用过程中抗压阻力小,易结块等问题。
[1]崔建东,李艳,牟德华.苯丙氨酸解氨酶(PAL)的研究进展[J].食品工业科技,2008,29(7):306-308.
[2]贺立红,张进标,宾金华.苯丙氨酸解氨酶的研究进展[J].食品科技,2006,7:31-34.
[3]刘海燕.固定化木瓜蛋白酶及其动力学性质的研究[D].保定:河北大学,2002.
[4]Kim M,Kim J B,Lee J.One-dimensional crosslinked enzyme aggregates in SBA-15:Superior catalytic behavior to conventional enzyme immobilization[J].Microporous and Mesoporous Materials,2008,101:18-23.
[5]许牡丹,杨伟东,柯蕾.壳聚糖-硅胶固定β-甘露聚糖酶方法的研究[J].食品工业科技,2007(2):160-162.
[6]牛军峰,蒋国翔,殷立峰.一种在多孔硅胶上固定漆酶的方法[P].2008.
[7]Cui J D,Zhang S,Sun L M.Cross-linked enzyme aggregates of phenylalanine ammonia lyase:novel biocatalysts for synthesis of L- Phenylalanine[J].Applied Biochemistry and Biotechnology,2012,167(4):835-844.
[8]Hürrem I,Süleyman A,ünel K.Sorption and preconcentration of copperand cadmium on silica gelmodified with 3-aminopropyltriethoxysilane[J].Fresenius’Journal of Analytical Chemistry,1992,342:560-562.
[9]Wang M F,Qi W,Yu Q X,et al.Cross-linking enzyme aggregates in the macropores of silica gel:A practical and efficient method for enzyme stabilization[J].Biochemical Engineering Journal,2010,52:168-174.
[10]赵丽娜,沈鹤柏,朱龙章.核壳型磁性纳米粒子界面氨基的测定[J].现代生物医学进展,2008,8(3):475-477.
[11]Lee J W,Kong S M,Kim W S,et al.Preparation and characterization of SiO2/TiO2core-shell particles with controlled shell thickness[J].Materials Chemistry and Physics,2007,106:39-44.
[12]Ralph L.Shriner.有机化合物系统鉴定手册[M].化学工业出版社,2007:165-171.
[13]Wang L N,Qi T,Zhang Y.Novel organic-inorganic hybird mesoporous materials for boron adsorption[J].Colloids and Surfaces A:Physicochem.Eng,2006,275:73-78.
