星油藤种仁碱提蛋白和浓缩蛋白功能性质的比较研究
2014-05-17李秀芬许又凯
赵 旻,张 萍,李秀芬,许又凯,*
(1.中国科学院西双版纳热带植物园热带植物资源可持续利用重点实验室,云南勐腊666303;2.中国科学院大学,北京100049)
星油藤(Plukenetia volubilis Linneo.)又名印加果,美藤果,印加语称 SachaInchi,为大戟科(Euphorbiaceae)多年生木质藤本植物,原生长在海拔80~1700m南美洲安第斯(Andres)山脉热带雨林区[1]。美洲原住民印加人驯化利用了三千多年[2]。星油藤当年种植,当年挂果,2~3 年进入盛产期[2-3]。因星油藤种子富含多不饱和脂肪酸和高蛋白质,2006年,星油藤引入我国并在西双版纳试种,2008年试种成功[4],2013年批准为国家新食品原料(卫生部公告2013年第1号)。近年来,因星油藤效益高,种植范围快速扩大,并在西双版纳周边的老挝、缅甸等国家大面积种植,星油藤产业已列为西双版纳州“十二五”重点发展的新兴产业,“十二五”末计划种植面积 1 万 Km2[5]。
近些年星油藤产业主要集中其多不饱和脂肪酸的开发利用,大量饼粕未被利用。废弃的饼粕,不仅浪费了资源,还对环境造成污染,影响星油藤产业的长期发展。前期研究表明西双版纳引种的星油藤种仁中蛋白质含量高达30.1%,仅次于脂肪酸,必需氨基酸种类齐全[6-7]。蛋白质短缺已经成为世界性的问题,尤其在发展中和欠发达国家与地区,蛋白质供应量不足,优质蛋白紧缺现象更加明显,人们越来越关注产量巨大、成本较低的植物蛋白资源的开发[8-9]。
目前,对星油藤种子蛋白质的研究较少[7,10-11]。工业上提取蛋白质的方法主要有碱溶酸沉法、酶法除杂浓缩法、双水相萃取法、反胶束法等,其中碱溶酸沉法由于成本低廉、操作简单、易于控制等特点而成为食品工业中最常用的方法。本研究中分别采用碱溶酸沉法[12]和酶法除杂浓缩法[13-14]提取蛋白质,通过对两种工艺所得的蛋白质功能性质的分析与比较,寻找适用于工业生产的星油藤饼粕蛋白的利用途径。
1 材料与方法
1.1 材料与仪器
星油藤种子 采自中国科学院西双版纳热带植物园内,去壳冷榨油后的饼粕,保存于-20℃冰箱中备用。
石油醚、氢氧化钠、盐酸、磷酸、牛血清白蛋白、考马斯亮蓝G-250等均为国产分析纯。
PB-10Sartorius普及型pH计 赛多利斯科学仪器(北京)有限公司;ST 16R冷冻离心机 美国热电公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;SF-180型高速万能粉碎机 上海新诺仪器设备有限公司;LH-20冷冻干燥机 日本东京理化器械株式会等。
1.2 实验方法
1.2.1 原料预处理 将星油藤种仁饼粕捣碎后于高速粉碎机中粉碎,过40目筛,所得粉末45℃下用石油醚脱脂6h,然后置于通风橱中12h以上,挥干溶剂得星油藤种仁脱脂粉,再次粉碎过100目筛后置于4℃冰箱中保存备用。
1.2.2 星油藤种仁脱脂粉主要成分分析 脱脂粉中的蛋白质含量利用碳氮分析仪测定;粗灰分参照标准LY/T 1268-1999测定;粗纤维参照标准 GB/T 6434-2006测定;粗脂肪参照标准GB/T 14772-2008测定;水溶性糖参照标准YC/T 159-2002测定。
1.2.3 星油藤蛋白等电点的测定 星油藤蛋白等电点的测定[15]:取5.0g星油藤脱脂蛋白粉与蒸馏水按1∶20(g/mL)混合,用1mol/L NaOH调节溶液pH为4.5,50℃下搅拌浸提1h后,室温下以4000r/min的速度离心20min,取等量上清液若干份,用1mol/L HCl分别调至一定pH,离心分离后,采用考马斯亮蓝法测定上清液中蛋白质的含量。蛋白质残留最低的上清液的pH即为星油藤种仁蛋白的等电点。
1.2.4 蛋白粉的制备 碱溶酸沉工艺流程:星油藤种仁脱脂粉 → 碱溶解(碱溶液pH11.5,液料比v/w 20∶1,提取时间120min,提取温度60℃)→离心(4000r/min,20min)→等电点沉淀→静置分离→洗涤沉淀→冷冻干燥→PPI。
酶法除杂工艺流程:星油藤种仁脱脂粉→85%乙醇除糖→α-淀粉酶(酶量1.0%,提取温度50℃)→95%乙醇洗涤→离心(4000r/min,20min)→沉淀低温烘干(50℃)→PPC。
1.2.5 溶解性测定 参照文献[9]测定蛋白的溶解性:配制1%(w/v)蛋白溶液,分别用1mol/L的HCl溶液或lmol/L的NaOH溶液调节pH分别为2、3、……12,磁力搅拌20min后以4000r/min的速度离心分离30min,测定上清液中蛋白质的含量,以上清液中的蛋白含量占样品中总蛋白含量的百分比表示蛋白质的溶解度。
1.2.6 吸油性测定 准确称取0.5g蛋白样品,加入到10mL蒸馏水中,混合均匀并在室温下静置30min后,以3000r/min的速度离心20min,小心吸除上层油后称量离心管的重量。
吸油性(%)=(m2-m1)/m ×100
m:蛋白样品质量/g;m1:吸油前蛋白样品和离心管总质量/g;m2:吸油后蛋白样品和离心管总质量/g。
1.2.7 吸水性测定 准确称取0.5g蛋白样品,加入到10mL蒸馏水中,混合均匀后,在室温下静置30min,然后以3000r/min的速度离心20min,小心吸除上层水后称量离心管的重量。

m:蛋白样品质量/g;m1:吸水前蛋白样品和离心管总质量/g;m2:吸水后蛋白样品和离心管总质量/g。
1.2.8 起泡性及泡沫稳定性测定 准确称取1.25g蛋白样品,加入到50mL蒸馏水中,混合均匀后,用匀浆机以l2000r/min的高速搅打2min后,迅速倒入100mL的量筒中,测量泡沫体积。起泡性按下式计算:
起泡性(%)=停止时泡沫体积/蛋白溶液体积×100
将量筒置于 30℃水浴锅中,于 10、20、30、40、50及60min时分别记录下残留泡沫体积并计算相应起泡性。
1.2.9 黏度测定 准确称取0.5g蛋白,倒入50mL含有0.5%(w/v)海藻酸钠的蒸馏水中,混合均匀后,分别置于30、40、50、60及70℃下1h,用黏度计测定其黏度。
2 结果与分析
2.1 脱脂粉的主要化学成分
星油藤种仁脱脂粉的主要化学成分见表1。由表可知,脱脂粉中主要化学成分是蛋白质,含量高达64.81g/100g,具有作为一种蛋白质资源进行开发研究的价值。水溶性糖含量次之,达9.79g/100g,是蛋白提取工艺中需要除去的杂质,粗灰分和粗纤维的含量分别为6.70g/100g和5.76g/100g。
2.2 星油藤种仁蛋白的等电点
碱溶酸沉法提取蛋白时,通常将等电点作为酸沉的条件,星油藤种仁蛋白的等电点测定结果见图1。由图可知,在pH3~4.5间,吸光度随pH增大而降低,然后又逐渐升高。在pH为4.5时吸光度最小,上清液中蛋白质残留量最小,因为此时,溶液中蛋白质所带正、负电量相等,蛋白质分子之间静电排斥作用最小而相互聚集沉淀,以致析出的蛋白量最大,此时即为星油藤种仁蛋白的等电点。故可知星油藤蛋白的等电点在 pH4.5附近,与其他油料作物杏仁(pH4.5)[16]、文冠果(pH4.6)[17]相近。

表1 星油藤种仁脱脂粉的主要化学成分(g/100g)Table 1 Proximate chemical composition of defatted P.volubilis seed flours(g/100g)

图1 星油藤种仁蛋白的等电点Fig.1 Isoelectric point of protein from P.volubilis
2.3 蛋白的溶解性
溶解性是食品功能性质中最基本的性质,它对吸水性、吸油性、乳化性等其他功能特性都有重要影响。两种蛋白在不同pH下的溶解性见图2,图中两蛋白溶解性曲线随pH的变化呈现出U型趋势,在等电点附近(pH4~5)因蛋白质分子间斥力最小而凝集析出,溶解性最低,随后随着pH的增加而升高,这与大多数植物蛋白表现相似[15,17-18]。在受试 pH 范围内,PPI的溶解性高于PPC,在偏酸或偏碱性条件下,两蛋白溶解性差异更加明显。因此,碱溶酸沉工艺提取的蛋白具备更好的溶解性。
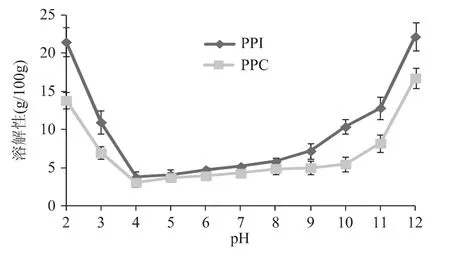
图2 PPI和PPC的溶解性比较Fig.2 The solubility of PPI and PPC
2.4 蛋白的吸油性
吸油性反映了蛋白与脂肪的结合能力,吸油性好的蛋白在乳类、肉类等制品加工过程可减少脂肪的损失,保证食品的风味[19]。由图3可知,PPC的吸油性明显高于PPI,两蛋白在30~50℃温度范围内,吸油性随温度升高而缓慢上升,继续升高温度则吸油性降低,在50℃时,PPC和PPI吸油性均达到最大值,分别为154.37%和294.70%。PPC具有较好的持油性,除了蛋白质本身的疏水性外,还因为PPC的堆密度更低,从而加大了与油接触的表面积。高温时,蛋白质出现变性而凝聚,减少了与油接触的表面积,另外油的黏度下降也会减弱与蛋白的结合能力,最终导致蛋白质吸油性的下降。
2.5 蛋白的吸水性

图3 PPI和PPC的吸油性比较Fig.3 Oil-holding capacity of PPI and PPC
蛋白质的吸水能力直接影响烘焙食品、凝胶类食品的质构,也与乳制品、肉质类制品的鲜嫩程度相关。蛋白质的吸水性受携带亲水基团的数量、溶解性及其他组分等因素的影响。pH对蛋白持水性的影响很大,pH的变化会引起蛋白质分子带电性和离子化作用,从而改变蛋白质分子与水的结合能力,影响吸水性[20]。图4显示PPI和PPC在不同pH下的吸水性,PPC的吸水性远高于PPI,它们吸水性趋势与溶解性相似,即在等电点附近吸水性最低,因为此时蛋白质分子带有的正、负电荷量相当,净电荷量几乎为0,蛋白质分子间作用力最强,而蛋白质与水的结合受到限制,所以导致吸水性最低。对于PPI,当pH以等电点为原点增高或降低时,蛋白质分子带有的净电荷量增加,与结合能力也随之增强,导致吸水性增大;而对于PPC,可能还受到少量纤维组分等因素的影响,所以变化较不规律。

图4 PPI和PPC的吸水性比较Fig.4 Water-holding capacity of PPI and PPC
2.6 起泡性及泡沫稳定性比较
起泡性是指蛋白质产品搅打生成泡沫的能力;泡沫的稳定性则反映泡沫存在的持久性。一般来说,蛋白质的起泡性影响面包、蛋糕等食品加工过程,起泡性及泡沫稳定性好的蛋白产品可作为良好的起泡剂用于改善烘焙食品的质构,保证食品口感舒适,此外也广泛用于冰激凌、奶乳等流体性食品中[17]。图5表示两种蛋白在不同时间的起泡性,显然PPC的起泡性高于PPI,但在泡沫稳定性上,两者没有明显差别。一般来说,溶解性好的蛋白质具备更好的起泡能力,在这里却表现出相反的现象,究其原因,在中性环境下,两蛋白溶解性相差不大,而PPC在水溶液中容易吸附在水-气界面形成蛋白质膜,从而降低界面张力,在受到搅打时更易形成泡沫[21]。

图5 PPI和PPC的起泡性Fig.5 The foaming property of PPI and PPC
2.7 黏度测定结果
黏度作为蛋白质流体的重要性质直接影响蛋白饮品类产品的生产过程及口感。图6为不同温度处理的蛋白溶液的黏度比较,由图可知,PPI的黏度高于PPC。温度升高时,蛋白溶液的流动性增强,蛋白溶液黏度因此而降低,当温度继续升高,还会促使蛋白变性,疏水作用力增大,进一步导致其黏度下降。所以两蛋白在温度升高时,黏度均呈降低趋势[22]。

图6 PPI和PPC的黏度比较Fig.6 The viscosity of PPI and PPC
3 结论
星油藤种仁脱脂粉的粗蛋白、粗灰分、粗纤维、粗脂肪、水溶性糖的含量分别为 64.81、6.70、5.76、2.20、9.79g/100g。星油藤种仁蛋白等电点在pH4.5附近。功能性质研究表明,在研究范围内,PPI具有更好的溶解性和更高的黏度,而PPC在吸油性、吸水性、起泡性方面明显高于PPI,故碱提法更易制备溶解性好的的蛋白,而酶法除杂工艺则保证了蛋白的吸油性、吸水性以及起泡性。两蛋白的溶解性和吸水性随pH升高,呈现出先降低后增高的趋势,在等电点附近最低。PPI和PPC在50℃时,吸油性最好,分别达到154.37%和294.70%。两蛋白的黏度在30~50℃内,随温度的上升而降低。
[1]Semino C A,Rojas F C,Zapata E S.Protocolo del cultivo de Sacha inchi(Plukenetia volubilis L.)[M].Peru:La Merced,2008:1-87.
[2]Mendoza N P.Obtención de los ácidos grasos del aceite de la Plukenetia volubilis L.Sacha Inchi” para la utilización en la industria y estudio fitoquímico cualitativo de la almendra [D].Lima:Universidad Nacional Agraria La Molina,2008.
[3]CaiZ Q.Shade delayed flowering and decreased photosynthesis,growth and yield of Sacha Inchi(Plukenetia volubilis)plants[J].Industrial Crops and Products,2011,34(1):1235-1237.
[4]蔡志全.特种木本油料作物星油藤的研究进展[J].中国油脂,2011,36(10):1-6.
[5]“十二五”发展规划编写组.中国科学院西双版纳热带植物园“十二五”(2011-2015)发展规划[R].西双版纳:中国科学院西双版纳热带植物园,2011.
[6]蔡志全,杨清,唐寿贤,等.木本油料作物星油藤种子营养价值的评价[J].营养学报,2011,33(2):193-195.
[7]Hamaker B R,Valles C,Gilman R,et al.Amino acid and fatty acid profiles of the Inca peanut(Plukenetia volubilis)[J].Cereal Chemistry,1992,69:461-463.
[8]Samanta T D,Laskar S.Chemical investigation of Erythrina variegata Linn.seed proteins[J].Food Chemistry,2009,114(1):212-216.
[9]Du Y X,Jiang Y,Zhu X M,et al.Physicochemical and functional properties of the protein isolate and major fractions prepared from Akebia trifoliata var.australis seed[J].Food Chemistry,2012,133(3):923-929.
[10]Sathe S K,Hamaker B R,Sze-Tao K W C,et al.Isolation,purification,and biochemical characterization of a novel water soluble protein from Inca peanut(Plukenetia volubilis L.)[J].Journal of Agricultural and Food Chemistry,2002,50(17):4906-4908.
[11]Sathe S K,Kshirsagar H H,Sharma G M.Solubilization,Fractionation,and Electrophoretic Characterization of Inca Peanut(Plukenetia volubilis L.)Proteins[J].Plant Foods for Human Nutrition,2012,67(3):247-255.
[12]邓红,田芸芸,田子卿,等.响应曲面法优化文冠果种仁蛋白的碱溶酸沉提取工艺[J].食品工业科技,2010,31(8):197-200.
[13]郭雪松,黄晓杰,王烁,等.醇法大豆浓缩蛋白提取工艺的优化[J].食品工业科技,2007,28(5):181-183.
[14]谭志光,唐书泽,张志森,等.酶法制取大米麦芽糊精和浓缩蛋白[J].食品工业科技,2006,27(10):114-117.
[15]孙小斐,乔玉辉.白果蛋白的提取分离及其等电点的测定[J].食品工业,2012(9):156-158.
[16]盛小娜,王璋,许时婴.甜杏仁蛋白的功能和结构的研究[J].食品工业科技,2008,29(5):133-136.
[17]范雪层,邓红,李招娣,等.文冠果蛋白的功能特性及其氨基酸组成分析[J].中国油脂,2009,34(6):26-30.
[18]史卿,杜研学,赵强,等.白木通籽分离蛋白的理化与功能性质研究[J].食品工业科技,2012,33(23):76-80.
[19]王风翼,钱方,李瑛,等.大豆蛋白质的生产与应用[M].北京:中国轻工业出版社,2004:84-103.
[20]Khalid E K,Babiker E E,El Tinay A H.Solubility and functional properties of sesame seed proteins as influenced by pH and/or salt concentration [J].Food Chemistry,2003,82(3):361-366.
[21]莫重文.蛋白质化学与工艺学[M].北京:化学工业出版社,2007:51-57.
[22]李志锐,刘波,张兰,等.玉米醇溶蛋白功能性质的研究[J].中国酿造,2009,5:28-31.
