两种非甾体类抗炎药对清醒状态血管源性头痛模型大鼠颅内Fos表达的影响
2014-05-10王晓辉朱浩静王恒孙宇吴士文于生元
王晓辉,朱浩静,王恒,孙宇,吴士文,于生元
(1.武警总医院,北京 100039;2.解放军总医院,北京 100853)
研究报告
两种非甾体类抗炎药对清醒状态血管源性头痛模型大鼠颅内Fos表达的影响
王晓辉1,朱浩静1,王恒1,孙宇1,吴士文1,于生元2
(1.武警总医院,北京 100039;2.解放军总医院,北京 100853)
目的通过观察血管源性头痛清醒动物模型中Fos阳性细胞在三叉神经节及三叉神经脊束核尾侧亚核的分布情况,明确两种非甾体类抗炎药NSAID对乙酰氨基酚及布洛芬在头痛控制中,在颅内特定区域的作用机理。方法 30只雄性SD大鼠随机分为对照组(生理盐水组)、对乙酰氨基酚组、布洛芬组,每组给药后50 min分别给予频率为20 Hz、电流为3~5 mA和脉宽为0.25 ms的电刺激,刺激后给予大鼠灌注固定取脑,分别在颅内取三叉神经节及三叉神经脊束核尾侧亚核制作石蜡切片,进行免疫组织化学染色,利用Image J软件对阳性细胞进行计数统计。结果电刺激后盐水组与非甾体类药物组在双侧三叉神经节、三叉神经脊束核尾侧亚核Fos蛋白表达的差异具有显著统计学意义,对乙酰氨基酚组与布洛芬组在双侧三叉神经节、三叉神经脊束核尾侧亚核Fos蛋白表达未见统计学差异。结论给予非甾体类抗炎前后在双侧三叉神经节、三叉神经脊束核尾侧亚核的Fos表达的改变提示三叉神经节、三叉神经脊束核尾侧亚核参与了疼痛的传递和表达以及药物对疼痛控制的药理过程。
偏头痛;非甾体类抗炎药;对乙酰氨基酚;布洛芬;Fos蛋白
偏头痛是一种常见的原发性头痛,属于血管源性头痛,为一种发作性疾病,其临床特点为头部单侧或双侧搏动性疼痛,发作时常伴有恶心、呕吐,畏光、畏声等伴随症状。据WHO调查研究所示,偏头痛全球患病率达10%,终生患病率为14%[1]。我国于2008~2009年最新的流行病学调查研究显示,偏头痛的年患病率为9.3%,其中对生活及工作造成中重度影响的偏头痛患者比例高达38%,全年带来的社会经济总损失高达3317亿元人民币,占GDP总额1.12%[2]。WHO把偏头痛列为最能使劳动能力下降的疾病之一[1],头痛被列为致残率最高的十大疾病之一[3],严重影响患者的工作能力及生活质量,给社会与家庭带来严重的经济负担。非甾体类抗炎解热镇痛剂在临床上已得到广泛应用,对乙酰氨基酚属乙酰苯胺类解热镇痛剂,布洛芬属丙酸类抗炎镇痛剂,二者均通过抑制中枢及外周前列腺素合成发挥其镇痛作用[4]。本研究应用清醒状态下电刺激大鼠上矢状窦硬脑膜的动物模型,分别在盐水组及非甾体类抗炎药物组观察模型大鼠颅内双侧三叉神经节及三叉神经脊束核尾侧亚核的Fos阳性细胞数的表达及变化情况,同时明确两种药物对疼痛控制的药理过程。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠30只,购自中国人民解放军军事医学科学院实验动物中心[SCXK(军)2012 -0004],分为对照组(A组)、对乙酰氨基酚组(B组)、布洛芬组(C组),每组10只,体重在250~350g之间,在解放军总医院动物实验中心实验室无特定病原体(specific-pathogen free,SPF)的饲养间【SYXK(军)2011-002】饲养。
1.2 实验方法
1.2.1 动物模型建立方法
实验大鼠用10%的水合氯醛(4 mL/kg)腹腔注射麻醉,于大鼠头正中部备皮,充分暴露头皮,固定于立体定位仪上,以手术切口为中心,直径约2 cm区域,常规碘伏消毒术野周围皮肤,逐层切开皮肤、皮下组织、肌肉,充分暴露颅骨,以颅中线与冠状缝交叉点前4 mm为前界,后6 mm为后界,用台式牙科钻分别钻开两个直径为1 mm的圆孔至上矢状窦硬脑膜,并充分使其暴露,将其作为刺激孔,钻孔过程中间断给予生理盐水冲洗降温,防止硬脑膜灼伤,整个过程中切勿损伤硬脑膜,将制作好的金属电极(由2根直径约1mm的金属导线组成正负极,仅最前端可导电,其他金属部分均涂抹绝缘材料,两电极相距9 mm,末端接连接插头,将于刺激时与刺激器和分离器相连接)的两端,将电极2个接头即正负极分别放入前述钻孔内,使两端导电处充分与硬脑膜接触,同时用502胶及牙托粉和义齿基托树脂(即牙托水)逐步将电极与颅骨充分固定,缝合头皮皮肤,避免触碰点击,电极接线口留置于头皮外侧,术后即可给予青霉素40万U/kg腹腔注射预防感染,术后单笼饲养3d,第4天给予电刺激。
1.2.2 电刺激方法
应用日本光电工业株式会社生产的刺激器(型号:SEN-7103,日本)和分离器(型号:SS-102J,日本)进行电刺激,每组大鼠均给予电刺激2次,参数为频率20 Hz、输出电流3~5 mA、刺激脉宽为0.25 ms,刺激时间为300 s,其中A组给药为生理盐水1.5 mL,B组给予对乙酰氨基酚(45 mg/kg,上海施贵宝制药,中国),C组给予布洛芬混悬液(27 mg/ kg,上海强生制药,中国),B、C组均将药物溶于1.5mL生理盐水。
1.2.3 免疫组化方法
各组均分别进行灌注固定:麻醉后用外科剪于胸部正中逐层分离皮肤,暴露心脏,于左心室处剪开小口,由此插细导管至升主动脉,先用300mL 0.9%生理盐水经心脏快速灌注,置换全血,然后用500 mL含4%多聚甲醛的0.1 mol/L的磷酸缓冲液(PB,pH 7.4)灌注固定,持续60 min以上。灌注结束后立即打开头颅,取出脑组织,并置入上述新鲜固定液中后固定6h,然后再将组织移入含30%蔗糖的PB中,置于4℃冰箱至其沉底。固定完成后将大鼠脑部分离,取双侧三叉神经节(trigeminal ganglia TG)、三叉神经脊束核尾侧亚核(trigeminal nucleus caudalis,TNC)3个部位,以冰冻切片机做连续冠状切片,每片厚度为25μm,每10张取2张,将切片分别收集与0.01 mol/L的磷酸缓冲盐水(PBS,pH= 7.4)之中进行免疫组织化学染色。
1.2.4 Fos阳性细胞观察方法及统计学处理
在模型大鼠颅内双侧三叉神经节及三叉神经脊束核尾侧亚核进行Fos阳性细胞计数,同时用配套数码相机采集图像。对每张标本,在10×10倍镜照片上任意选取三个区域,大小:100μm×100μm,并用ImageJ软件对阳性细胞进行计数统计,之后取三个区域的平均值,作为该大鼠该相应区域该蛋白阳性细胞数。计量数据利用Image-Pro Plus软件(6.0版)对10倍物镜下切片的c-Fos阳性细胞分别进行计数,用均数±标准差(±s)表示。统计学处理采用SPSS 16.0软件。
2 结果
各组在右侧三叉神经节的c-Fos平均免疫反应阳性细胞数分别为(66.60±7.35),(37.00± 8.10),(36.3±7.75),三者之间差异有显著性(P<0.05)。多重两两比较结果示盐水对照组与对乙酰氨基酚组比较差异有显著性(P<0.01),盐水对照组与布洛芬组比较差异有显著性(P<0.01);可见图1A、D及图2(图1见彩插6)。
各组在左侧三叉神经节的c-Fos平均免疫反应阳性细胞数分别为(64.50±5.28),(37.50± 5.80),(35.80±5.61),三者之间差异有显著性(P<0.01)。多重两两比较结果示盐水对照组与对乙酰氨基酚组差异有显著性(P<0.01),盐水对照组与布洛芬组差异有显著性(P<0.01);可见图1B、E及图3。
各组在三叉神经脊束核尾侧亚核的c-Fos平均免疫反应阳性细胞数分别为(80.80±7.47), (36.70±7.07),(35.30±6.55),三者之间差异有显著性(P<0.01)。多重两两比较结果示盐水对照组与对乙酰氨基酚组,差异有显著性(P<0.05),对照组与布洛芬组差异有显著性(P<0.01);可见图1C、F及图4。
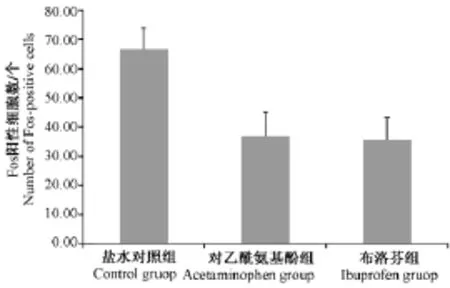
图2 各组在右侧三叉神经节Fos阳性细胞数比较Fig.2 Comparison of Fos-positive cells in the right trigeminal ganglia by each group
上述三个区域在Fos阳性细胞比较中对乙酰氨基酚组与布洛芬组差异均无显著性(P>0.05)。对照组中右侧三叉神经节与左侧三叉神经节之间的Fos阳性细胞数差异无显著性(P=0.673),对乙酰氨基酚组中右侧三叉神经节与左侧三叉神经节之间的Fos阳性细胞数差异无显著性(P=0.524),布洛芬组中右侧三叉神经节与左侧三叉神经节之间的Fos阳性细胞数差异无显著性(P=0.707)。
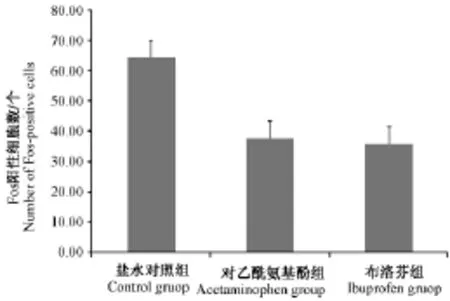
图3 各组在左侧三叉神经节Fos阳性细胞数比较Fig.3 Comparison of Fos positive cells in the left trigeminal ganglia by each group
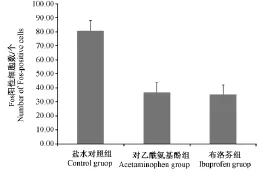
图4 各组在三叉神经脊束核尾侧亚核Fos阳性细胞数比较Fig.4 Comparison of Fos-positive cells in trigeminal nucleus caudalis by each group
3 讨论
c-fos基因是一类广泛存在于原核细胞和直核细胞基因组内高度保守的基因,属于即刻早期基因(immediate-early gene,IEG),它的转录产物Fos蛋白作为细胞功能活动状态的标志,对神经递质、激素、神经冲动及外界剌激引起的传入信息,在数分钟中就会作出反应,进行表达。基于此种原因,通过对c-fos的检测可探索研究机能与形态的关系[5]。既往研究表明,Fos蛋白的表达量可以较为直观的作为细胞水平的代谢性标记显示神经元活性:Fos蛋白表达增强可作为神经元活性增强的标志,既往有学者的研究表明伤害性刺激诱导的c-fos阳性标记神经元的表达结果与行为学和电生理学的研究结果相一致。c-Fos蛋白对外界刺激非常敏感,在中枢某些部位的表达可作为伤害性刺激所引起的疼痛在分子水平上的标志物。在疼痛研究中许多学者将c-Fos蛋白表达作为研究伤害性信息传导通路的标识物[6,7]。正常情况下,细胞内c-Fos蛋白很少表达,外周伤害性刺激等因素可激活脊髓内、三叉神经系统、丘脑-皮层通路中c-Fos基因并表达c-Fos蛋白。一定程度上,c-Fos蛋白免疫反应阳性神经元的数量与所受刺激的强度成正比,因此c-Fos蛋白可作为伤害性刺激的标志物,是疼痛在分子水平的标志[8]。由于三叉神经血管系统(TGVS)在偏头痛的病理生理中起着举足轻重的作用。三叉神经节神经元的活性增强,被认为是基础神经过敏促进慢性疼痛发作,包括偏头痛的发作。本实验发现刺激大鼠上矢状窦区硬脑膜后在双侧三叉神经节及三叉神经脊束核尾侧亚核质出现Fos表达,尤其在三叉神经节表达最明显[9]。三叉神经节是一个结构复杂,功能丰富的区域,它广泛参与疼痛与镇痛、恐惧和焦虑等功能活动的调控,是重要的感觉、运动整合中枢及自主调节中枢[10]。模型大鼠三叉神经节及TNC fos表达均明显增高,通过药物干预后fos表达均有所下降。也有研究表明,偏头痛发作时三叉神经脊束核尾侧亚核、丘脑等部位同样受影响,这些部位cfos同样会出现高表达。
本实验结果显示布洛芬及对乙酰氨基酚两药均可导致患者颅内双侧三叉神经节、三叉神经脊束核尾侧亚核c-fos的表达均较用药前明显减少,且差异具备统计学意义。在左侧、右侧三叉神经节区域表达未见明显差异,提示疼痛传递自双侧三叉神经节同时进行,向脑干、丘脑区域传递。在对乙酰氨基酚组及布洛芬组进行比较时,两组间差异无统计学意义,但仍存在不同,以布洛芬效果略优于对乙酰氨基酚,在一项针对高海拔头痛一项随机,对照试验中验证对乙酰氨基酚与布洛芬的疗效,结果显示两药对头痛均有效,未见明显差异[11,12];在一项托吡酯、布洛芬或对乙酰氨基酚对偏头痛影响的随机对照研究中结果显示,400 mg布洛芬或1000 mg对乙酰氨基酚280 mg托吡酯的结合并未显示出统计上的显着差异[13,14]。布洛芬为芳基丙酸类,为选择性COX-2抑制剂,可以实现非甾体抗炎药的全部作用,通过抑制诱导型致炎性环氧酶将花生四烯代谢为介质前列腺素或其他递质的合成,减轻前列腺素所致局部组织充血、肿胀、发热;通过抑制白细胞活动及溶酶体释放,降低局部周围神经对缓激肽等致痛物质的痛觉敏感性,减少组织冲动,从而起到镇痛作用[15]。对乙酰氨基酚为乙酰苯胺类,为非选择性COX抑制剂,对中枢神经系统前列腺素抑制作用比对外周的前列腺素抑制所用强,但其抗炎作用较弱。在组织损伤或炎症时,局部产生和释放致痛物质,同时PGs的合成增加。在本实验中,通过对c-Fos的检测可以看出两种药物在缓解偏头痛的疗效方面无明显差异,提示血管炎性反应可能不是引发电刺激上矢状窦大鼠模型偏头痛发作的主要因素,非甾体抗炎药可能通过对外周及中枢神经元的直接作用产生镇痛效应,结合此观点提示血管炎性反应可能不是引发电刺激上矢状窦模型大鼠偏头痛发作的主要因素,具体机理机制尚须进一步研究。
(本文图1见彩插6。)
[1] Silberstein SD.Preventivemigraine treatment[J].Neurol Clin, 2009,27:429-443.
[2] Yu S,Liu R,Zhao G,et al.The prevalence and burden of primary headaches in China:a population-based door-to-door survey[J].Headache,2012 Apr,52(4):582-591.
[3] Stovner L,Hagen K,Jensen R,et al.The global burden of headache:a documentation of headache prevalence and disability worldwide[J].Cephalalgia,2007,27:193-210.
[4] 匡培根.神经系统疾病药物治疗学[M].北京,人民卫生出版社.2008.
[5] Géraud G,Lantéri-Minet M,Lucas C,et al.French guidelines for the diagnosis and management ofmigraine in adults and children[J].Clin Ther,2004,26:1305-1310.
[6] Pace MC,Mazzariello L,Passavanti MB,et al.Neurobiology of pain[J].JCell Physiol,2006,209(1):8-12.
[7] Raskin NH,Hosobuchi Y,Lamb S,Headache may arise from perturbation of brain[J].Headache,1987,27(8):416-420.
[8] Zhang GH,Min SS,Lee KS,et al.Intraarticular pretreatment with ketamine and memantine could prevent arthritic pain:relevance to the decrease of spinal c-fos expression in rats[J]. Anesth Analg,2004,99(1):152-158.
[9] Chen T,Dong YX,Li YQ.Fos expression in serotonergic neurons in the rat brainstem following noxious stimuli:an immunohistochemical double-labelling study[J].J Anat,2003,203 (6):579-588.
[10] Barton-Donovan K,Blanchard EB.Psychosocial aspects of chronic daily headache[J].JHeadache Pain,2005,6:30-39.
[11] Vincent P,Maskos U,Charvet I,et al.Live imaging of neural structure and function by fibered fluorescence microscopy[J]. EMBO Rep,2006,7(11):1154-1161.
[12] Harris NS,Wenzel RP,Thomas SH.High altitude headache:efficacy of acetaminophen vs.ibuprofen in a randomized,controlled trial[J].JEmerg Med,2003,24(4):383-387.
[13] Hewitt DJ,Martin V,Lipton RB.Randomized controlled study of telcagepant plus ibuprofen or acetaminophen in migraine[J]. Headache,2011,51(4):533-543.
[14] Klein M,Gögenur I,Rosenberg J.Risk of anastomotic leakage in postoperative treatment with non-steroidal anti-inflammatory drugs[J].Ugeskrift for Laeger,2010,172(22):1660-1662.
Effects of NSAIDs on Fos expression in conscious rat model of vasculogenic headache
WANG Xiao-hui1,ZHU Hao-jing1,WANG Heng1,SUN Yu1,WU Shi-wen1,YU Sheng-yuan2,
(1.General Hospital of Armed Police Forces,Beijing 100039,China;2.PLA Postgraduate Medical School,Beijing 100853)
Ob jectiveTo define the functionalmechanisms of two NSAIDs,paracetamol and ibuprofen,in specific brain regions in headache control by observing the distribution of Fos-immunoreactive neurons in trigeminal ganglia and trigeminal nucleus caudalis in conscious ratmodels of vasculogenic headache.M ethodsThirtymale Sprague-Dawley rats were random ly divided into three groups:control group(saline group),acetaminophen group and ibuprofen group.Each ratwas given electrical stimulation(frequency 20 Hz,current3-5 mA,pulse width 0.25 ms)at50 minutes after injection.The ratswere killed and perfusion fixed after electrical stimulation.Trigeminal ganglia and trigeminal nucleus caudalis of the brainswere taken out for paraffin sections and immunohistochemical staining,and Fos-immunoreactive neuronswere counted under the Image J system.Resu ltsAfter electrical stimulation,there were significant differences of Fos protein expression in bilateral trigeminal ganglia and spinal trigeminal nucleus caudalis between the saline group and groups of nonsteroidal anti-inflammatory drugs,but no significant difference of Fos protein expression in bilateral trigeminal ganglia and spinal trigeminal nucleus caudalis between the acetaminophen group and ibuprofen group.ConclusionsThe changes of Fos expression in bilateral trigeminal ganglia and spinal trigeminal nucleus caudalis after treatment with NSAIDs suggest that such structures participate in the pain transmission and expression and the pharmacology course of analgesic drugs.
Migraine;Non-steroidal anti-inflammatory analgesics;Acetaminophen,Ibuprofen,Fos,expression
Q95-33
A
1005-4847(2014)03-0040-04
10.3969/j.issn.1005-4847.2014.03.008
2013-11-05
国家自然科学基金项目(30570264,30970417)。
王晓辉(1981-),男,硕士,研究方向:原发性头痛。E-mail:wangxh_001@sina.com
于生元,男,博士生导师。E-mail: yusy1963@126.com
