肝郁脾虚泄泻大鼠模型的建立及评价
2014-05-10张庆业廖小红范丽霞涂星房财富唐洪梅
张庆业,廖小红,范丽霞,涂星,2,房财富,唐洪梅
(1.广州中医药大学第一附属医院,广州 510405;2.广州中医药大学,广州 510006; 3.中山大学附属肿瘤医院药学部,广州 510407)
研究报告
肝郁脾虚泄泻大鼠模型的建立及评价
张庆业1,廖小红1,范丽霞1,涂星1,2,房财富3,唐洪梅1
(1.广州中医药大学第一附属医院,广州 510405;2.广州中医药大学,广州 510006; 3.中山大学附属肿瘤医院药学部,广州 510407)
目的采用多因素刺激方法建立吻合人类“肝郁脾虚泄泻”疾病特征的大鼠模型,并选取操作简单、结论实时、科学经济的评价指标。方法将幼年SD大鼠随机分为空白组和模型组,模型组采用母婴分离、束缚刺激、直肠醋酸刺激三种因素复合造模,选择不同时间测定大鼠体重变化、直肠敏感性、大鼠粪便分型积分及粪便含水量等指标,客观验证肝郁脾虚泄泻模型是否成功。结果模型大鼠出现食欲减退,饮水量增大,尿液减少的病理现象,部分大鼠出现活动增加、甚至躁狂。粪便积分在5~7分,粪便含水量远远高于正常组大鼠,而肠道敏感性显著增加。结论该模型较好的模拟了肝郁脾虚泄泻的临床表现,能满足该类疾病的相关研究。
肝郁脾虚泄泻;动物模型;母婴分离;直肠敏感性
中医学认为,肝属木,主疏泄,喜条达而恶抑郁;脾(胃)属土,主运化,脾气宜清宜升,胃主受纳腐熟,胃气宜降宜和,共同完成机体对饮食物的消化吸收和输布功能。若肝失疏泄,脾失运化,发为“肝郁脾虚”,容易引起慢性泄泻,与西医病症肠易激综合征(IBS)症状相似[1-3]。肝郁脾虚泄泻可见于许多疾病,如肠易激综合征、慢性胃炎、消化性溃疡等,在临床上的十分常见,如肠易激综合征在青少年人群中患病率就高达10%~20%[4]。
国内外众多学者从肝郁脾虚泄泻临床症状特点出发建立了多种模型,取得了一定的成果,但研究中还存在模型的建立与中医发病机理不完全符合、评价指标未能量化表示等问题[5,6]。本研究依据肝郁脾虚证的发病学说,运用精神-神经-外周刺激三种因素复合造模法构建肝郁脾虚证大鼠模型,模拟出符合肝郁脾虚证候及泄泻特点的模型,并且通过可量化测定、操作性强的多项指标评价模型,使模型可以重复操作。
1 实验材料
1.1 动物及饲养
初生SPF级SD大鼠4窝(30只),购自广州中医药大学实验动物中心【SCXK(粤)2013-0020】,雄雌不限,与母鼠同笼,第14天后断奶并与母鼠分笼,在广州中医药大学第一附属医院实验中心SPF级实验环境下操作【SYXK(粤)2013-0092】,常规摄食饮水,光照为保持昼夜节律各12h。温度控制在18~24℃,相对湿度控制在50%~70%,实验时室温维持在24~26℃。
1.2 试剂和仪器
醋酸;乙醚;4%甲醛;静脉留置管;石蜡油;HE染色液;龙胆紫液;0.01 mol/L PBS缓冲液(pH 7.4);75%酒精;二甲苯;中性树胶;生理盐水; 1 mL、5 mL、10 mL注射器;手术胶手套;电子秤;血压计;大鼠血管活性肠肽ELISA检测试剂盒(含量≥99%,规格:96T,上海恒远生物科技有限公司)。
2 模型制作与评价方法
2.1 动物分组和造模[5]
实验用幼年SD大鼠从出生第2天起开始造模,随机分为正常对照组(n=10)、模型组(n=20)。肝郁脾虚泄泻模型组:SD乳鼠从第1~7天适应性饲养,从第8~21天,将乳鼠每天取出单独小笼饲养2 h,再将乳鼠用乙醚麻醉后,用自制的直肠刺激注射装置经石蜡油润滑后轻柔地插入肛门,在8~14 d时插入约3 cm,在15~21d时插入约5 cm,每次插入稳定后,注入0.5%的醋酸每次0.4 mL/d,注入醋酸后,注射管在肠内停留1~2 min,以免醋酸流出。在22~35d时大鼠用纸带束缚前肩、前上肢及胸部,束缚时间为2 h/d,期间单独分离饲养,不限活动。正常对照组按相同处理方法直肠注射生理盐水,不做束缚处理。造模时,幼鼠放置到单独的小笼造模,造模完毕后放回与母鼠同笼饲养,第42天造模结束。
2.2 模型的评价及机理分析
2.2.1 大鼠体重及行为学评价
记录大鼠在实验过程中饮水、食欲、活动情况等变化,在造模开始的第7、35、42、49、56天进行称量大鼠体重,取三次测试的平均值,比较模型组与对照组大鼠体重情况。
2.2.2 大鼠粪便Bristol分型积分及含水量测定
在造模开始的第35天、第49天、第63天进行测试大鼠粪便分型评分,取三轮测试的平均值,并测定粪便含水量,判断其是否属于便秘还是腹泻。粪便测试方法如下:每天将模型大鼠单独置于代谢笼内4h,测试期间禁水禁食,单独静置,收集4h内大鼠的粪便,比较同日龄模型组与空白组幼鼠粪便差异,包括粪便溏稀程度、粪便形状、粪便颜色改变、有无异物等。并根据Bristol大便性状图谱记录大便性状[7](Bristol大便性状分型:1型为分离的硬团,2型为团块状,3型为干裂的香肠状,4型为柔软的香肠状,5型为软的团块,6型为泥浆状,7型为水样便。其中1、2型为便秘(constipation);3、4型为正常(ideal stools);5、6、7为腹泻(diarrhea or urgency)。按照中国药典附录烘干法测定粪便含水量。
2.2.3 直肠敏感性测试
在造模后的第35天、第49天、第63天对各组幼鼠进行大鼠的腹部回缩反射(AWR)测试,将血压计、针管与自制指套气囊用三通管连接,用针管向气囊内打气时可以在血压计上读出气囊内压力。大鼠在自制的密封麻醉瓶进行乙醚麻醉后,把用石蜡油润滑后的气囊经肛门轻柔地插入约3~5 cm,气囊末端距肛门1 cm,用胶布把导管和大鼠尾巴根部缠在一起,固定气囊。大鼠苏醒后,将其放在特制的不能转身的透明塑料瓶内。15 min后待大鼠适应环境,在大鼠意识完全清醒的情况下逐渐打气扩张肠道,分别观察引起大鼠腹部抬起以及背部拱起的压力阈值,相应的AWR腹部有回撤反应的标准参照Al-Chaer[8]的方法进行评分。记录第2分或第3分的压力值,当大鼠出现1分或4分时,待大鼠充分休息后重新测试。为得到准确的评估结果,对每一阈值都重复进行3次扩张,数据取均值。
2.2.4 结肠HE染色分析
正常组和模型组大鼠在第42日龄时,将实验大鼠禁食1d后,腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉处死大鼠,分离直肠和结肠,剪取乙状结肠肠段2cm及近降结肠处直肠肠段1 cm,水洗净,浸入5%福尔马林液中备用。使用脱水机和包埋机对大鼠标本进行石蜡包埋,标本用石蜡包埋后,放进全自动石蜡切片机中切片:4℃冰箱预冷40 min,以锋利刀片切出1μm的切片,贴附于载玻片上备用。
大鼠的结肠标本完成包埋后,放进常规染色的说明书操作步骤进行操作。
2.3 统计方法
应用SPSS 13.0统计软件包进行统计学处理,各组实验数据均用均数±标准差(±s)表示,组间变量比较用t检验,以P<0.05有统计学意义。
3 结果与分析
3.1 大鼠体重及行为学评价
大鼠在造模过程中出现食欲减退,饮水量增大,尿液减少的病理现象,部分大鼠出现活动增加、甚至躁狂的现象。大鼠第7、35、42、49、56天体重情况变化见图1。由图1可以看出,模型组大鼠的体重较正常大鼠体重减轻。

图1 造模过程模型组与正常组大鼠体重变化曲线Fig.1 Curves of body weight changes in rats of the two groups
3.2 大鼠粪便Bristol分型积分及含水量测定结果
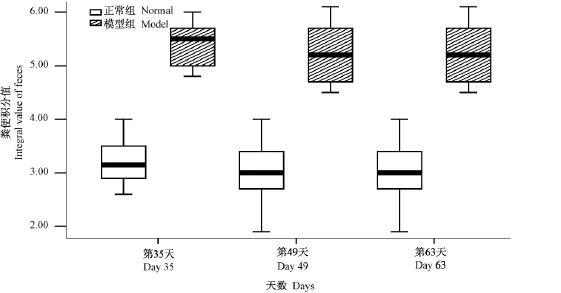
图2 大鼠粪便分型积分箱式图Fig.2 Box-plots of the integral classification of rat excrement in the two groups
对第35、49、63天大鼠粪便Bristol分型积分做箱式图分析,结果见图2。由图2可以看出,造模结束时(第35天)正常组粪便积分在3.2左右,而模型组粪便积分在5.7左右,表明所建立的模型为腹泻型。对第35天、第49天、第63天大鼠粪便含水量进行测定,测定结果见表1。由表1可以看出,模型组大鼠的粪便含水量远远高于正常组的粪便含水量,进一步验证了本研究所建立的模型为腹泻动物模型。此外,第49天和第63天,模型组大鼠粪便积分能较好的保持在5分以上,即依然保持腹泻状态,但是积分值逐渐下降,且粪便含水量也呈现下降趋势,表明模型组大鼠处于自然恢复状态,腹泻渐渐好转,提示造模结束后4周内为最佳的评价和研究阶段,可用于肝郁脾虚泄泻的机理和治疗研究。
表1 第35、49、63天大鼠粪便含水量测定结果(±s, n=10,%)Tab.1 Water content in the rat feces at days35,49 and 63
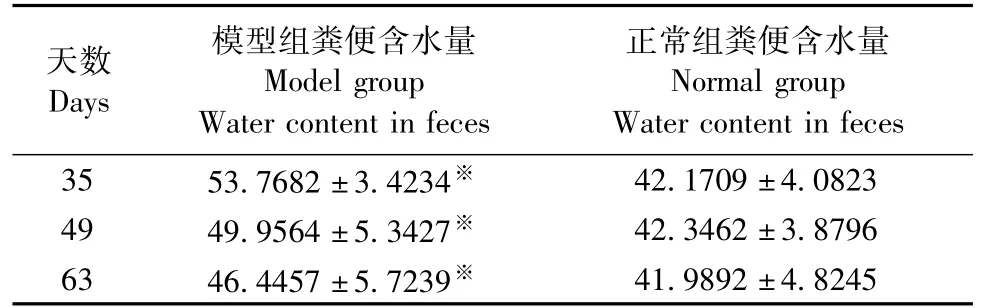
表1 第35、49、63天大鼠粪便含水量测定结果(±s, n=10,%)Tab.1 Water content in the rat feces at days35,49 and 63
注:与正常组相较,※P<0.05。Note:Compared with the normal group,※P<0.05.
天数Days模型组粪便含水量Model group Water content in feces 41.9892±4.8245正常组粪便含水量Normal group Water content in feces 35 53.7682±3.4234※42.1709±4.0823 49 49.9564±5.3427※42.3462±3.8796 63 46.4457±5.7239※
3.3 直肠敏感性测试结果
在造模后的第35天、第49天、第63天对各组幼鼠进行大鼠的腹部回缩反射(AWR)测试,结果见图3。由图3可见,模型组大鼠痛阈值下降,即对疼痛的耐受力下降,表明所建立的动物模型的肠道敏感性升高。
3.4 直肠HE染色结果分析
正常组的结肠黏膜表面完整,未见糜烂及溃疡;黏膜上皮细胞及杯状细胞形态、数量正常;黏膜下层及浆膜层未见水肿及炎细胞浸润。模型组的结肠黏膜表面正常,黏膜下层略有水肿增厚,并有轻度炎症细胞浸润(图4,见彩插3)。
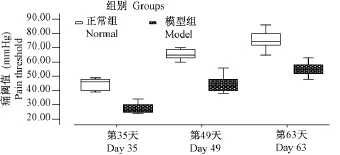
图3 正常组与模型组大鼠直肠敏感性评估结果箱式图Fig.3 Box-plots of the evaluation of rat rectal sensitivity in the two groups
4 讨论
肝郁脾虚证是中医脏腑最常见的病理症候之一。据统计,中医五脏中发病率最高的是肝脏,占五脏发病的39.6%,肝郁证及其相兼症候则占总肝病数的41.9%[9]。从现代医学观点来看,涉及神经、消化、免疫等多系统功能的改变。本研究在中医肝郁脾虚理论的指导下,采取母婴分离方法造成早期的应激反应,加束缚法联合模拟出情志不遂致病的病因病机,结合醋酸直肠注射造成炎症后康复的胃肠功能紊乱而制作出肝郁脾虚泄泻的动物模型。在一般行为学观察中出现食欲减退,饮水量增大,尿液减少的病理现象,部分大鼠出现活动增加、甚至躁狂的现象与人的肝郁脾虚证症状有许多相似之处。
本研究中,模型组大鼠粪便分型积分在5~7分,表现为腹泻症状,此外粪便含水量较正常组显著升高(P<0.05),表明本研究所制作的为肝郁脾虚泄泻的动物模型。直肠敏感性评估结果显示,以本研究方法所制作的肝郁脾虚泄泻动物模型的内脏敏感性升高,而易出现腹部回缩反射,提示内脏高敏性可能是肝郁脾虚泄泻的发病机理之一。
综上所述,在早期母婴分离的基础上,采用束缚应激法结合腹直肠注射醋酸致炎法制作肝郁脾虚泄泻大鼠模型,较成功的模拟出相关症候,为探索肝郁脾虚泄泻发生发展机制奠定了重要基础,也为治疗其病症的中药新药开发提供了更加科学合理的动物模型。但本研究缺乏对该肝郁脾虚泄泻动物模型进行药物反证,尚有待进一步研究和探讨。
(本文图4见彩插3。)
[1] 朱文锋,何清湖.现代中医临床诊断学[M].北京:人民卫生出版社,2003.576.
[2] 孙刚,杨云生,彭丽华,等.肠易激综合征大鼠内脏敏感性异常与结肠及中枢神经系统5-HT和c-fos表达的关系[J].胃肠病学和肝病学杂志,2008,17(4):313-317.
[3] Camilleri M,Katzka DA.Irritable bowel syndrome:methods, mechanisms,and pathophysiology.Genetic epidemiology and pharmacogenetics in irritable bowel syndrome[J].Am JPhysiol-Gastrointest Liver Physiol,2012,302(10):G1075-G1084.
[4] Lacy BE,Everhart KK,Weiser KT,etal.IBSpatients’willingness to take risks with medications[J].Am J Gastroenterol, 2012,107(6):804-809.
[5] 唐洪梅,李得堂,黄樱华,等.腹泻型IBS大鼠模型的建立及敏感性评估的实验研究[J].中国药理学通报,2009,25 (4):22-25.
[6] 诸琦,王静,赖华梅,等.中药肠吉安对肠易激综合征内脏高敏感模型大鼠的作用及其机制[J].中国中西医结合杂志,2008,28(9):813-817.
[7] 杨劲威,王茂贵,王宝西.健康儿童粪便重量、长度测量及分型[J].实用儿科临床杂志,2005,20(9):916-917.
[8] Al-Chaer ED,KawasaktM,Pasricha PJ.A new modelof chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development[J].Gastroenterology,2000,119: 1276-1285.
[9] 郭建丽,冯玛莉,宋美卿,等.情志刺激致大鼠肝郁脾虚证模型的研究[J].中华中医药杂志,2012,11:2842-2847.
Establishment and assessment of the diarrhea ratmodel of liver-QI stagnation w ith spleen deficiency
ZHANG Qing-ye1,LIAO Xiao-hong1,FAN Li-xia1,TU Xing1,2,FANG Cai-fu3,TANG Hong-mei1※
(1.the First Affiliated Hospital of Guangzhou University of Chinese Medicine,Guangzhou 510405,China; 2.Guangzhou University of Chinese Medicine,Guangzhou,510006;3.the Affiliated Tumor Hospital of Sun Yat-sen University,Guangzhou 510000)
ObjectiveTo establish a diarrhea ratmodel using multiple-stimulating factors and choosing the best indexes to assesswhether themodel is consistentwith the disease characteristics of liver-QIstagnation with spleen deficiency in traditional Chinesemedicine.M ethodsNewborn SD rats were randomly divided intomodel group(n=20)and control group(n=10).The rats ofmodel group were stimulated bymaternal separation,restraint stress and rectum acetic acid irritation,while the rats in control group were fed as normal.Weight changes,rectal sensitivity,Bristol scores and water content of feces and histology of the colon tissues were used as evaluation indexes to assesswhether themodelmeets the demands for further studies.ResultsThe rats in themodelgroup showed loss of appetite,increase ofwater intake and urine reduction.Some rats showed increased activity,and evenmania.Bristol scores and water contentof feceswere significantly higher than thatof the control group,and the rectal sensitivity was significantly increased.The colonmucosa showed slightly thickened submucosal layer and mild inflammatory cell infiltration in themodel rats.ConclusionsThe ratmodel established in this study is better to simulate the clinicalmanifestation of liver-QIstagnation with spleen deficiency in Chinesemedicine,and maymeet the demands of related researches of this disease.
Liver-QI stagnation with spleen deficiency;Ratmodel;Maternal separation;Rectal sensitivity
Q95-33
A
1005-4847(2014)03-0020-04
10.3969/j.issn.1005-4847.2014.03.004
2013-11-04
国家自然科学基金(81073160);广东省自然科学基金(S2012010010539);广州中医药大学科研创新基金(11CX027);广东省普通高校重点实验室中医病机与治法研究实验室开放课题(AAF110111A16)。
张庆业,男,主管药师,硕士,研究方向:临床药理学及治疗学。E-mail:zqy08@139.com,Tel:020-36591293.
唐洪梅,主任中药师,教授,博士生导师,研究方向:中药新药开发与安全性评价。E-mail:tanghongmei2000@163.com,Tel:020-36598708.
